1 . 碳化硅(SiC)晶体结构与金刚石相似,俗称金刚砂。下列说法正确的是
| A.SiC晶体中硅、碳元素的质量比为1∶1 |
| B.SiC晶体的熔点较高 |
| C.SiC晶体的硬度较小 |
| D.SiC属于分子晶体 |
您最近一年使用:0次
2023-07-29更新
|
447次组卷
|
5卷引用:江苏省常州高级中学高中学业水平合格性考试化学模拟试题(二)(附答案)
江苏省常州高级中学高中学业水平合格性考试化学模拟试题(二)(附答案)2023年江苏省扬州市普通高中学业水平合格性模拟试卷(二)化学试题江苏省淮安市2023-2024学年普通高中学业水平合格性考试化学模拟试题(已下线)热点07 分子晶体与共价晶体(已下线)3.2.2 共价晶体(巩固)
解题方法
2 . 超硬材料氮化硼常用于制作刀具和磨料,一种纳米立方氮化硼晶体的晶胞结构如图所示。下列有关该晶体的说法不 正确的是


| A.其化学式为BN |
| B.与金刚石成键、结构均相似,具有很高的硬度 |
| C.B原子周围距离最近且相等的N原子有2个 |
| D.X射线衍射是区分晶体和非晶体最可靠的科学方法 |
您最近一年使用:0次
名校
解题方法
3 . 下面的排序不正确的是
| A.晶体熔点由低到高:CF4<CCl4<CBr4<CI4 |
| B.硬度由大到小:金刚石>碳化硅>晶体硅 |
| C.熔点由高到低:Na>Mg>Al |
| D.晶格能由大到小:NaF>NaCl>NaBr>NaI |
您最近一年使用:0次
2021-05-29更新
|
576次组卷
|
29卷引用:江苏省常州高级中学2023-2024学年高二上学期期末质量检查化学试题
江苏省常州高级中学2023-2024学年高二上学期期末质量检查化学试题(已下线)2011-2012学年福建省晋江市季延中学高二上学期期末考试化学试卷(已下线)2012-2013学年福建省莆田一中高二下学期第一学段考试化学试卷2014-2015学年辽宁实验中学等五校高二下期末化学试卷2015-2016学年四川省雅安市高二上学期期末考试化学试卷2015-2016学年福建省福安八中高二下第二次月考化学试卷2015-2016学年福建省四地六校高二下第二次联考化学试卷2015-2016学年宁夏银川一中高二下期末化学试卷2015-2016学年云南省德宏州芒一中高二下学期期末化学试卷福建省莆田市第一中学2016-2017学年高二下学期期中考试化学试题福建省莆田市仙游县第二中学2019-2020学年高二下学期期中考试化学试题辽宁省大连市普兰店市第三十八中学2021届高三第一学期开学考试化学试题福建省龙岩市武平县第一中学2020-2021学年高二上学期10月月考化学试题湖北省黄梅国际育才高级中学2020-2021学年高二下学期3月月考化学试题辽宁省海城市高中教育集团2019-2020学年高二下学期6月联考化学试题新疆新源县第二中学2018-2019学年高二下学期期末考试化学试题江苏省苏州市新区实验中学2020-2021学年高二上学期12月月考化学试题福建省仙游县枫亭中学2020-2021学年高二下学期期中考试化学试题陕西省宝鸡市渭滨区2020-2021学年高二下学期期末考试化学试题河南省驻马店市新蔡县第一高级中学2021-2022学年高二下学期5月半月考化学试题福建省福州第一中学2021-2022学年高二下学期期中考试化学试题新疆乌鲁木齐市第四中学2021-2022学年高二下学期期末考试化学试题福建省泉州市泉港区第五中学等校2021-2022学年高二下学期期末联考化学试题福建省泉州市泉港区第五中学等校2021-2022学年高二下学期期末联考化学试题江苏省盐城市田家炳中学2021-2022学年高二下学期期中考试化学试题天津市滨海新区塘沽第一中学2023届高三第一次月考化学试题(已下线)化学(上海B卷)-学易金卷:2023年高考第一次模拟考试卷四川省盐亭中学2022-2023学年高二上学期期中教学质量监测(理科)化学试题(已下线)热点08 金属晶体和离子晶体
名校
解题方法
4 . 下列关于晶体的说法正确的组合是
①所有分子晶体中都存在共价键
②在晶体中只要有阳离子就一定有阴离子
③金刚石、SiC、NaF、NaCl、H2O、H2S晶体的熔点依次降低
④离子晶体中只有离子键
⑤SiO2晶体中每个硅原子与4个氧原子以共价键相结合
⑥晶体中分子间作用力越大,分子越稳定
⑦氯化钠熔化时离子键被破坏
⑧含有共价键的晶体熔沸点都比较高,因为熔化时需要破坏共价键
①所有分子晶体中都存在共价键
②在晶体中只要有阳离子就一定有阴离子
③金刚石、SiC、NaF、NaCl、H2O、H2S晶体的熔点依次降低
④离子晶体中只有离子键
⑤SiO2晶体中每个硅原子与4个氧原子以共价键相结合
⑥晶体中分子间作用力越大,分子越稳定
⑦氯化钠熔化时离子键被破坏
⑧含有共价键的晶体熔沸点都比较高,因为熔化时需要破坏共价键
| A.①②⑤ | B.③⑤⑦ | C.⑤⑥⑧ | D.④⑦⑧ |
您最近一年使用:0次
2021-04-16更新
|
332次组卷
|
4卷引用:江苏省常州市礼嘉中学2020-2021学年高二下学期第二次阶段质量调研化学试题
江苏省常州市礼嘉中学2020-2021学年高二下学期第二次阶段质量调研化学试题辽宁省锦州市义县高中2020-2021学年高二下学期4月考试化学试题(已下线)3.3 金属晶体与离子晶体(C级检测练)-2020-2021学年高二化学章节分层检测ABC(人教版2019选择性必修2)山东省泰安第十九中学2020-2021学年高二下学期期中考试化学试题
名校
5 . 现有几组物质的熔点(℃)数据:
据此回答下列问题:
(1)A组属于_______ 晶体。
(2)B组晶体共同的物理性质是_______ (填序号)。
①有金属光泽 ②导电性 ③导热性 ④延展性
(3)C组中HF熔点反常是由于_______ 。
(4)D组晶体可能具有的性质是_______ (填序号)。
①硬度小 ②水溶液能导电 ③固体能导电 ④熔融状态能导电
(5)D组晶体的熔点由高到低的顺序为NaCl>KCl>RbCl>CsCl,其原因为_______ 。
| A组 | B组 | C组 | D组 |
| 金刚石:3550 ℃ | Li:181 ℃ | HF:-83 ℃ | NaCl:801 ℃ |
| 硅晶体:1410 ℃ | Na:98 ℃ | HCl:-115 ℃ | KCl:776 ℃ |
| 硼晶体:2300 ℃ | K:64 ℃ | HBr:-89 ℃ | RbCl:718 ℃ |
| 二氧化硅:1723 ℃ | Rb:39 ℃ | HI:-51 ℃ | CsCl:645 ℃ |
据此回答下列问题:
(1)A组属于
(2)B组晶体共同的物理性质是
①有金属光泽 ②导电性 ③导热性 ④延展性
(3)C组中HF熔点反常是由于
(4)D组晶体可能具有的性质是
①硬度小 ②水溶液能导电 ③固体能导电 ④熔融状态能导电
(5)D组晶体的熔点由高到低的顺序为NaCl>KCl>RbCl>CsCl,其原因为
您最近一年使用:0次
2021-04-16更新
|
105次组卷
|
3卷引用:江苏省常州市礼嘉中学2020-2021学年高二下学期第二次阶段质量调研化学试题
名校
6 . 下列有关金刚石晶体和二氧化硅晶体(如图所示)的叙述正确的是
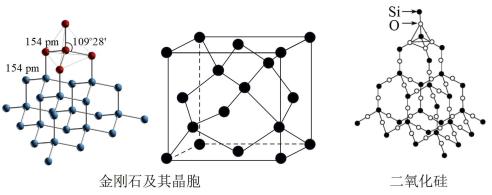

| A.金刚石晶体和二氧化硅晶体均属于原子晶体 |
| B.金刚石晶胞中含有6个碳原子 |
C.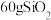 晶体中所含共价键数目为 晶体中所含共价键数目为 ( ( 是阿伏加德罗常数的值) 是阿伏加德罗常数的值) |
| D.金刚石晶体熔化时破坏共价键,二氧化硅晶体熔化时破坏分子间作用力 |
您最近一年使用:0次
2021-03-05更新
|
902次组卷
|
7卷引用:江苏省常州市礼嘉中学2020-2021学年高二下学期第二次阶段质量调研化学试题
江苏省常州市礼嘉中学2020-2021学年高二下学期第二次阶段质量调研化学试题辽宁省名校联盟2021届高三下学期开学考试(新高考)化学试题(已下线)2021年高考化学押题预测卷(湖北卷)03(含考试版、答题卡、参考答案、全解全析)专题3 微粒间作用力与物质性质 第三单元 共价键共价晶体 第2课时 共价键的键能与化学反应的反应热 共价晶体(已下线)3.2.2 共价晶体-同步学习必备知识湖北省武汉市洪山高级中学2022-2023学年高二下学期2月考试化学试题3.3.2共价晶体 课后
7 . 我们可以将SiO2的晶体结构想象为:在晶体硅的Si—Si键之间插入O原子.结构如图所示.

(1)根据SiO2晶体结构图,下列说法正确的是_________ .
A.石英晶体中每个Si原子通过Si—O极性键与4个O原子作用
B.每个O原子也通过Si—O极性键与2个Si原子作用
C.石英晶体中Si原子与O原子的原子个数比为1∶2,可用“SiO2”来表示石英的组成
D.在晶体中存在石英分子,故能叫分子式
(2) 离子结构可用
离子结构可用 图表示,在聚硅酸根离子
图表示,在聚硅酸根离子 中只有硅氧键,它的结构应是
中只有硅氧键,它的结构应是_____________ .

(1)根据SiO2晶体结构图,下列说法正确的是
A.石英晶体中每个Si原子通过Si—O极性键与4个O原子作用
B.每个O原子也通过Si—O极性键与2个Si原子作用
C.石英晶体中Si原子与O原子的原子个数比为1∶2,可用“SiO2”来表示石英的组成
D.在晶体中存在石英分子,故能叫分子式
(2)
 离子结构可用
离子结构可用 图表示,在聚硅酸根离子
图表示,在聚硅酸根离子 中只有硅氧键,它的结构应是
中只有硅氧键,它的结构应是
您最近一年使用:0次
8 . 在短周期主族元素中:
(1)属于非金属元素但又具有一定的金属性,可作半导体材料的是________ (填元素名称)。
(2)铝是活泼的金属元素,单质铝由于___________ ,而具有良好的抗腐蚀能力,美国化学家发现铝的“原子群”(如Al13、Al14、Al37)各具有与某种元素相似的化学性质,并符合元素周期律中的某些规律。例如:Al13与卤素具有相似的化学性质, 离子具有惰性气体元素的性质,可推测Al14的化学性质与
离子具有惰性气体元素的性质,可推测Al14的化学性质与________ 族元素相似。
(3)甲、乙两种元素是同一周期的相邻元素,甲元素是形成有机物的主要元素,乙元素的p亚层上有3个电子。
①写出甲元素的电子排布式____________ ,乙元素的原子结构示意图________________ 。
②甲、乙元素可形成硬度大于金刚石的一种化合物,该化合物属于____________ 晶体,其化学式为_______________ 。
(1)属于非金属元素但又具有一定的金属性,可作半导体材料的是
(2)铝是活泼的金属元素,单质铝由于
 离子具有惰性气体元素的性质,可推测Al14的化学性质与
离子具有惰性气体元素的性质,可推测Al14的化学性质与(3)甲、乙两种元素是同一周期的相邻元素,甲元素是形成有机物的主要元素,乙元素的p亚层上有3个电子。
①写出甲元素的电子排布式
②甲、乙元素可形成硬度大于金刚石的一种化合物,该化合物属于
您最近一年使用:0次
9 . 短周期主族元素X、Y、Z、W的原子序数依次增大,X原子核外最外层电子数是次外层的2倍,Y的氟化物YF3分子中各原子均达到8电子稳定结构,Z是同周期中原子半径最大的元素,W的最高正价为+7价。下列说法正确的是
| A.简单离子半径大小顺序: rX>rZ>rY |
| B.元素W的氧化物对应水化物的酸性比Y的强 |
| C.X与Y形成的原子晶体X3Y4的熔点比金刚石高 |
| D.X与W形成的化合物和Z与W形成的化合物的化学键类型相同 |
您最近一年使用:0次



