名校
1 . 红砷镍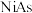 晶体结构如图所示,下列叙述正确的是
晶体结构如图所示,下列叙述正确的是

 晶体结构如图所示,下列叙述正确的是
晶体结构如图所示,下列叙述正确的是
A. 和 和 均为过渡元素 均为过渡元素 |
B.  原子的配位数为4 原子的配位数为4 |
C.下方 原子的分数坐标为 原子的分数坐标为 ,则上方 ,则上方 原子的分数坐标为 原子的分数坐标为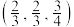 |
D.已知晶体密度为 ,晶胞参数为 ,晶胞参数为 ,则阿伏加德罗常数 ,则阿伏加德罗常数 可表示为 可表示为 |
您最近一年使用:0次
2 . 如图所示,铁有δ、γ、α三种晶体,三种晶体在不同温度下能发生转化。下列说法正确的是
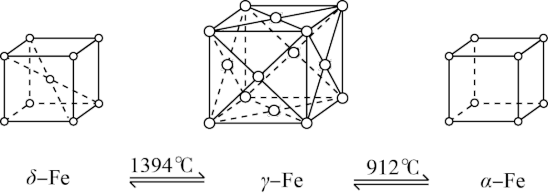

| A.γ-Fe晶体中与每个铁原子距离相等且最近的铁原子有6个 |
| B.α-Fe晶体中与每个铁原子距离相等且最近的铁原子有6个 |
| C.将铁加热到1500℃分别急速冷却和缓慢冷却,得到的晶体类型相同 |
| D.若α-Fe晶胞边长为acm,γ-Fe晶胞边长为bcm,则两种晶体的密度比为b3∶a3 |
您最近一年使用:0次
2022-08-24更新
|
653次组卷
|
7卷引用:黑龙江省佳木斯市第十二中学2021-2022学年高二下学期期中考试化学试题
名校
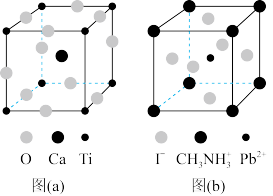
3 . 钙钛矿(CaTiO3)型化合物是一类可用于生产太阳能电池、传感器、固体电阻器等的功能材料。回答下列问题:
(1)基态Ti原子的核外电子排布式为___________ 。
(2)Ti的四卤化物熔点如下表所示,TiF4熔点高于其他三种卤化物,自TiCl4至TiI4熔点依次升高,原因是___________ 。
(3)CaTiO3的晶胞如图(a)所示,其组成元素的电负性大小顺序是___________ ;金属离子与氧离子间的作用力为___________ ,Ca2+的配位数是___________ 。
(4)一种立方钙钛矿结构的金属卤化物光电材料的组成为Pb2+、I-和有机碱离子CH3NH ,其晶胞如图(b)所示,其中Pb2+与图(a)中
,其晶胞如图(b)所示,其中Pb2+与图(a)中___________ 的空间位置相同。有机碱CH3NH 中,N原子的杂化轨道类型是
中,N原子的杂化轨道类型是___________ 。若晶胞参数为a nm,则晶体密度为___________ g·cm-3(列出计算式)。
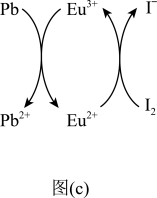
(5)用上述金属卤化物光电材料制作的太阳能电池在使用过程中会产生单质铅和碘,降低了器件效率和使用寿命。我国科学家巧妙地在此材料中引入稀土铕(Eu)盐,提升了太阳能电池的效率和使用寿命,其作用原理如图(c)所示,用离子方程式表示该过程的总反应:___________ ,Eu3+在反应中的功能___________ 。
(1)基态Ti原子的核外电子排布式为
(2)Ti的四卤化物熔点如下表所示,TiF4熔点高于其他三种卤化物,自TiCl4至TiI4熔点依次升高,原因是
| 化合物 | TiF4 | TiCl4 | TiBr4 | TiI4 |
| 熔点/℃ | 377 | -24.12 | 38.3 | 155 |
(3)CaTiO3的晶胞如图(a)所示,其组成元素的电负性大小顺序是
(4)一种立方钙钛矿结构的金属卤化物光电材料的组成为Pb2+、I-和有机碱离子CH3NH
 ,其晶胞如图(b)所示,其中Pb2+与图(a)中
,其晶胞如图(b)所示,其中Pb2+与图(a)中 中,N原子的杂化轨道类型是
中,N原子的杂化轨道类型是
(5)用上述金属卤化物光电材料制作的太阳能电池在使用过程中会产生单质铅和碘,降低了器件效率和使用寿命。我国科学家巧妙地在此材料中引入稀土铕(Eu)盐,提升了太阳能电池的效率和使用寿命,其作用原理如图(c)所示,用离子方程式表示该过程的总反应:

您最近一年使用:0次
名校
4 . CaO晶胞如图所示,其中Ca2+的配位数为( )
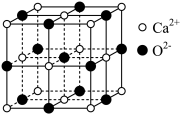

| A.4 | B.6 | C.8 | D.12 |
您最近一年使用:0次
2020-05-12更新
|
179次组卷
|
2卷引用:黑龙江省哈尔滨市第三十二中学2019-2020学年高二下学期期中考试化学试题
名校
解题方法
5 . 有关晶体的结构如下图所示,下列说法中不正确的是( )
A.在NaCl晶体 中,距Na+最近的Cl-有6个 中,距Na+最近的Cl-有6个 |
B.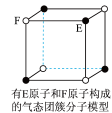 气态团簇分子的分子式为EF或FE 气态团簇分子的分子式为EF或FE |
C.在CaF2晶体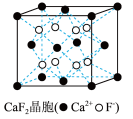 中,每个晶胞平均占有4个Ca2+ 中,每个晶胞平均占有4个Ca2+ |
D.在金刚石晶体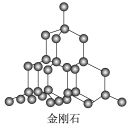 中,碳原子与碳碳键个数的比为1∶2 中,碳原子与碳碳键个数的比为1∶2 |
您最近一年使用:0次
2019-06-11更新
|
707次组卷
|
13卷引用:黑龙江省牡丹江市第三高级中学2018-2019学年高二下学期期中考试化学试题
黑龙江省牡丹江市第三高级中学2018-2019学年高二下学期期中考试化学试题【校级联考】福建省宁德市高中同心顺联盟校2018-2019学年高二下学期期中考试化学试题福建省福州市格致中学2018-2019学年高二下学期期中考试化学试题四川省武胜烈面中学校2019-2020学年高二下学期期中考试化学试题吉林省延边第二中学2020-2021学年高二下学期期中考试化学试题宁夏银川市第二中学2022-2023学年高二上学期期中考试化学试题福建省泉州市泉港区第一中学2018-2019学年高二下学期第二次月考化学试题(已下线)2019年12月8日 《每日一题》2020年高考化学一轮复习——每周一测辽宁省丹东市第四中学2019-2020学年高二 4 月线上月考化学试题湖北省恩施土家族苗族自治州高级中学2019-2020学年高二下学期第二次双周考试化学试题鲁科版2019选择性必修2第3章综合检测卷(人教版2019)选择性必修2 第三章 晶体结构与性质 综合检测卷重庆市育才中学校2021-2022学年高二下学期第一次月考化学试题
6 . 下面有关晶体的叙述中,不正确的是
| A.60gSiO2晶体中含Si-O键的个数为4NA(NA为阿伏伽德罗常数) |
B.在立方ZnS晶体(如图所示)中,Zn2+、S2-的配位数都是8 |
C.设NaCl的摩尔质量为Mg·mol-1,NaCl的密度为ρg·cm-3,阿伏伽德罗常数为NAmol-1,在NaCl晶体中,两个距离最近的Cl-中心间的距离为 cm cm |
| D.CaO晶体结构与NaCl晶体结构相似,CaO 晶体中Ca2+的配位数为6,且这些最邻近的O2-围成正八面体 |
您最近一年使用:0次
名校
7 . 有四种不同堆积方式的金属晶体的晶胞如图所示,有关说法正确的是

| A.①为简单立方堆积,②为六方最密堆积,③为体心立方堆积,④为面心立方最密堆积 |
| B.每个晶胞含有的原子数分别为①1个②2个③4个④4个 |
| C.晶胞中原子的配位数分别为①6 ②8 ③12 ④12 |
| D.空间利用率的大小关系为①<②<③<④ |
您最近一年使用:0次
2019-05-18更新
|
203次组卷
|
2卷引用:【全国百强校】黑龙江省牡丹江市第一高级中学2018-2019学年高二下学期期中考试化学试题
名校
8 . 下列有关离子晶体的数据大小比较不正确的是
| A.晶格能:NaF>NaCl>NaBr | B.硬度:MgO>CaO>BaO |
| C.熔点:NaF>MgF2>AlF3 | D.阴离子的配位数:CsCl>NaCl>CaF2 |
您最近一年使用:0次
2018-07-25更新
|
292次组卷
|
2卷引用:【全国百强校】黑龙江省牡丹江市第一高级中学2018-2019学年高二下学期期中考试化学试题
13-14高二下·江苏扬州·阶段练习
名校
解题方法
9 . (1)金属镍及其化合物在合金材料以及催化剂等方面应用广泛。回答下列问题:
①NiO、FeO的晶体结构类型均与NaCl的相同,Ni2+和Fe2+的离子半径分别为69pm和78pm,则熔点:FeO____ (填“<”或“>”)NiO。
②铁有δ、γ、α三种同素异形体,各晶胞结构如图所示,则δ、α两种晶胞中铁原子的配位数之比为____ 。

(2)元素金(Au)处于周期表中的第六周期,与Cu同族,一种铜金合金晶体具有立方最密堆积的结构,在晶胞中Cu原子处于面心,Au原子处于顶点位置,则该合金中Cu原子与Au原子数目之比为__ ;该晶体中,原子之间的相互作用是____ 。
(3)某钙钛型复合氧化物如图所示,以A原子为晶胞的顶点,A位可以是Ca、Sr、Ba或Pb,当B位是V、Cr、Mn、Fe等时,这种化合物具有CMR效应。


(a) (b)
①用A、B、O表示这类特殊晶体的化学式:____ 。
②已知La为+3价,当被钙等二价元素A替代时,可形成复合钙钛矿化合物La1-xAxMnO3(x<0.1),此时一部分锰转变为+4价,导致材料在某一温度附近有反铁磁—铁磁、铁磁—顺磁及金属—半导体的转变,则La1-xAxMnO3中三价锰与四价锰的物质的量之比为____ 。
③下列有关说法正确的是____ 。
A.镧、锰、氧分别位于周期表f、d、p区
B.氧元素的第一电离能比氮元素的第一电离能大
C.锰的电负性为1.59,铬的电负性为1.66,说明锰的金属性比铬强
D.铬的堆积方式与钾相同,则其堆积方式如图(b)所示
①NiO、FeO的晶体结构类型均与NaCl的相同,Ni2+和Fe2+的离子半径分别为69pm和78pm,则熔点:FeO
②铁有δ、γ、α三种同素异形体,各晶胞结构如图所示,则δ、α两种晶胞中铁原子的配位数之比为

(2)元素金(Au)处于周期表中的第六周期,与Cu同族,一种铜金合金晶体具有立方最密堆积的结构,在晶胞中Cu原子处于面心,Au原子处于顶点位置,则该合金中Cu原子与Au原子数目之比为
(3)某钙钛型复合氧化物如图所示,以A原子为晶胞的顶点,A位可以是Ca、Sr、Ba或Pb,当B位是V、Cr、Mn、Fe等时,这种化合物具有CMR效应。


(a) (b)
①用A、B、O表示这类特殊晶体的化学式:
②已知La为+3价,当被钙等二价元素A替代时,可形成复合钙钛矿化合物La1-xAxMnO3(x<0.1),此时一部分锰转变为+4价,导致材料在某一温度附近有反铁磁—铁磁、铁磁—顺磁及金属—半导体的转变,则La1-xAxMnO3中三价锰与四价锰的物质的量之比为
③下列有关说法正确的是
A.镧、锰、氧分别位于周期表f、d、p区
B.氧元素的第一电离能比氮元素的第一电离能大
C.锰的电负性为1.59,铬的电负性为1.66,说明锰的金属性比铬强
D.铬的堆积方式与钾相同,则其堆积方式如图(b)所示
您最近一年使用:0次
2016-12-09更新
|
1156次组卷
|
6卷引用:黑龙江省齐齐哈尔市第八中学2018-2019学年高二下学期期中考试化学试题
黑龙江省齐齐哈尔市第八中学2018-2019学年高二下学期期中考试化学试题(已下线)2013-2014江苏省扬州中学高二下学期阶段测试5月 化学试卷2018版化学(苏教版)高考总复习专题十一课时跟踪训练--微粒间作用力与物质性质(已下线)2018年12月6日 《每日一题》一轮复习-物质结构和性质综合题(已下线)2019年6月30日 《每日一题》选修3—— 每周一测(已下线)2019年12月5日 《每日一题》2020年高考化学一轮复习——物质结构和性质综合题
11-12高二下·山西临汾·期中
名校
解题方法
10 . 下列有关晶体的叙述中错误的是
| A.石墨的层状结构中由共价键形成的最小的碳环上有六个碳原子 |
| B.氯化钠晶体中每个Na+周围紧邻的有6个Cl— |
| C.CsCl晶体中每个Cs+周围紧邻的有8个Cl—,每个Cs+周围等距离紧邻的有6个Cs+ |
| D.在面心立方最密堆积的金属晶体中,每个金属原子周围紧邻的有4个金属原子 |
您最近一年使用:0次
2016-12-09更新
|
969次组卷
|
7卷引用:黑龙江省齐齐哈尔市第八中学2018-2019学年高二下学期期中考试化学试题
黑龙江省齐齐哈尔市第八中学2018-2019学年高二下学期期中考试化学试题(已下线)2011-2012学年山西省临汾一中高二下学期期中考试化学试卷(已下线)2011-2012学年山西省忻州一中高二下学期期中考试理科化学试卷宁夏石嘴山市平罗中学2022-2023学年高二上学期11月期中化学试题广西宾阳县宾阳中学2018-2019学年高二5月月考化学试题新疆维吾尔自治区伊犁哈萨克自治州奎屯市第一高级中学2019-2020学年高二期末考试试题(已下线)专题11 物质结构与性质——备战2021年高考化学纠错笔记



