名校
1 . 溴苯是一种化工原料,实验室合成溴苯的装置示意图及有关数据如下:
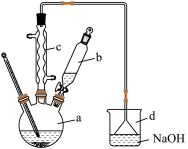
I.合成步骤:在a中加入15mL无水苯和少量铁屑。在b中小心加入5.0mL液溴。打开活塞,向a中滴入液溴,发生反应。
请回答下列问题:
(1)实验室制取溴苯的化学方程式为___________ 。
(2)反应过程中仪器a外壁温度升高,为提高原料利用率可利用温度计控制温度,适宜的温度范围为___________(填标号)。
(3)装置d的作用除了能防倒吸外,还有___________ 。
II.待反应完成后,取出a装置中的混合物,设计如下流程分离、提纯溴苯:
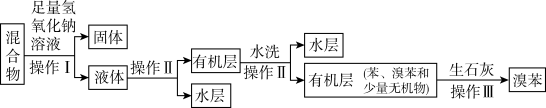
(4)流程中“固体”的化学式为___________ ,操作II所需主要玻璃仪器有___________ 。
(5)设计实验检验水洗是否达到目的:___________ 。
(6)若经过操作III后得纯溴苯11.30g.则溴苯的产率是___________ (计算结果保留2位有效数字)。

| 苯 | 溴 | 溴苯 | |
密度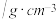 | 0.88 | 3.20 | 1.50 |
沸点/ | 80 | 59 | 156 |
| 水中溶解度 | 微溶 | 微溶 | 微溶 |
请回答下列问题:
(1)实验室制取溴苯的化学方程式为
(2)反应过程中仪器a外壁温度升高,为提高原料利用率可利用温度计控制温度,适宜的温度范围为___________(填标号)。
A. | B. | C.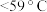 | D.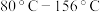 |
II.待反应完成后,取出a装置中的混合物,设计如下流程分离、提纯溴苯:

(4)流程中“固体”的化学式为
(5)设计实验检验水洗是否达到目的:
(6)若经过操作III后得纯溴苯11.30g.则溴苯的产率是
您最近一年使用:0次
2 . 一水硫酸四氨合铜(Ⅱ)的化学式为[Cu(NH3)4]SO4·H2O是一种重要的染料及农药中间体。某学习小组在实验室以氧化铜为主要原料合成该物质,设计的合成路线为:
相关信息如下:
①[Cu(NH3)2]SO4·H2O在溶液中存在以下电离(解离)过程:
[Cu(NH3)4]SO4·H2O=[Cu(NH3)4]2++SO42-+H2O [Cu(NH3)4]2+ Cu2++4NH3
Cu2++4NH3
②(NH4)2SO4在水中可溶,在乙醇中难溶。
③[Cu(NH3)4]SO4·H2O在乙醇、水混合溶剂中的溶解度随乙醇体积分数的变化曲线示意图如图
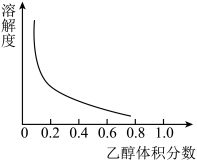
请根据以上信息回答下列问题:
(1)方案1的实验步骤为:a.加热蒸发,b.冷却结晶,c.抽滤,d.洗涤,e.干燥。
①步骤1的抽滤装置如图所示,下列有关抽滤操说法作正确的是_____ 。
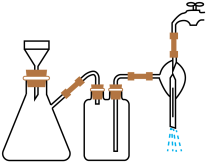
A.完毕后的先关闭水龙头,再拔下导管
B.上图装置中只有一处错误
C.抽滤后滤液可以从上口倒出,也可从支管倒出
D.滤纸应比漏斗内径小且能盖住所有小孔
②该方案存在明显缺陷,因为得到的产物晶体中往往含有_____ 杂质,产生该杂质的原因是______ 。
(2)方案2的实验步骤为:a.向溶液C中加入适量____ ,b.抽滤,c.洗涤,d.干燥。
①请在上述空格内填写合适的试剂或操作名称。
②下列选项中,最适合作为步骤c的洗涤液是________ 。
A.乙醇 B.蒸馏水 C.乙醇和水的混合液 D.饱和硫酸钠溶液
洗涤的具体操作是:____________ 。
③步骤d采用________ 干燥的方法。

相关信息如下:
①[Cu(NH3)2]SO4·H2O在溶液中存在以下电离(解离)过程:
[Cu(NH3)4]SO4·H2O=[Cu(NH3)4]2++SO42-+H2O [Cu(NH3)4]2+
 Cu2++4NH3
Cu2++4NH3②(NH4)2SO4在水中可溶,在乙醇中难溶。
③[Cu(NH3)4]SO4·H2O在乙醇、水混合溶剂中的溶解度随乙醇体积分数的变化曲线示意图如图

请根据以上信息回答下列问题:
(1)方案1的实验步骤为:a.加热蒸发,b.冷却结晶,c.抽滤,d.洗涤,e.干燥。
①步骤1的抽滤装置如图所示,下列有关抽滤操说法作正确的是

A.完毕后的先关闭水龙头,再拔下导管
B.上图装置中只有一处错误
C.抽滤后滤液可以从上口倒出,也可从支管倒出
D.滤纸应比漏斗内径小且能盖住所有小孔
②该方案存在明显缺陷,因为得到的产物晶体中往往含有
(2)方案2的实验步骤为:a.向溶液C中加入适量
①请在上述空格内填写合适的试剂或操作名称。
②下列选项中,最适合作为步骤c的洗涤液是
A.乙醇 B.蒸馏水 C.乙醇和水的混合液 D.饱和硫酸钠溶液
洗涤的具体操作是:
③步骤d采用
您最近一年使用:0次
2019-06-29更新
|
362次组卷
|
2卷引用:2019-2020学年新人教版必修2第5章第2节《氮及其化合物》作业
21-22高二·全国·课时练习
解题方法
3 . 3,5二甲氧基苯酚是重要的有机合成中间体,可用于天然物质白柠檬素的合成。一种以间苯三酚为原料的合成反应如下:
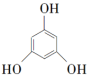 +2CH3OH
+2CH3OH
 +2H2O
+2H2O
甲醇、乙醚和3,5二甲氧基苯酚的部分物理性质如表所示:
(1)反应结束后,先分离出甲醇,再加入乙醚进行萃取。分离得到的有机层依次用饱和NaHCO3溶液、饱和食盐水、少量蒸馏水进行洗涤。用饱和NaHCO3溶液洗涤的目的是___________ ;用饱和食盐水洗涤的目的是____________ 。
(2)洗涤完成后,通过以下操作分离、提纯产物,正确的操作顺序是___________ (填字母)。
a.蒸馏除去乙醚 b.重结晶 c.过滤除去干燥剂 d.加入无水CaCl2干燥
(3)固液分离常采用减压过滤。为了防止倒吸,减压过滤完成后应先___________ ,再___________ 。
 +2CH3OH
+2CH3OH
 +2H2O
+2H2O甲醇、乙醚和3,5二甲氧基苯酚的部分物理性质如表所示:
| 物质 | 沸点/℃ | 熔点/℃ | 密度(20℃)/(g·cm-3) | 溶解性 |
| 甲醇 | 64.7 | 0.7915 | 易溶于水 | |
| 乙醚 | 34.6 | 0.7138 | 微溶于水 | |
| 3,5二甲氧基苯酚 | 40~43 | 易溶于甲醇、乙醚,微溶于水 |
(2)洗涤完成后,通过以下操作分离、提纯产物,正确的操作顺序是
a.蒸馏除去乙醚 b.重结晶 c.过滤除去干燥剂 d.加入无水CaCl2干燥
(3)固液分离常采用减压过滤。为了防止倒吸,减压过滤完成后应先
您最近一年使用:0次
解题方法
4 . 乙酸乙酯是重要的有机合成中间体,广泛应用于化学工业。实验室利用如图所示装置制备乙酸乙酯。

(1)若实验中用乙酸和含 的乙醇反应,则反应的化学方程式是
的乙醇反应,则反应的化学方程式是_______ 。与教材采用的实验装置不同,此装置中采用了球形干燥管,其作用是________ 。
(2)为了证明浓硫酸在该反应中起到了催化剂和吸水剂的作用,某同学利用如图所示装置进行了以下4个实验。实验开始时先用酒精灯微热3min,再加热使之微微沸腾3min。实验结束时充分振荡试管Ⅱ,静置后再测有机层的厚,度,实验记录如下:
①实验D的目的是与实验C相对照,证明 对酯化反应具有催化作用。实验D中应加入盐酸的体积和浓度分别是
对酯化反应具有催化作用。实验D中应加入盐酸的体积和浓度分别是________ mL和_______  。
。
②分析实验________ (填实验编号)的数据,可以推测出浓硫酸的吸水性提高了乙酸乙酯的产率。
(3)若现有乙酸90g,乙醇138g,发生酯化反应得到88g乙酸乙酯,试计算该反应的产率为______ 。
(4)用如图所示的分离操作流程分离含乙酸、乙醇和水的乙酸乙酯粗产品,图中内为适当的试剂,括号内为适当的分离方法。
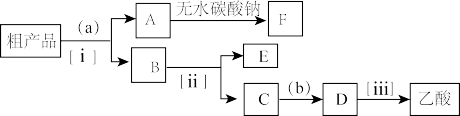
①试剂a是______ ;分离方法ii是_______ ,分离方法iii是______ 。分离方法i是分液,在具体操作中应充分振荡,然后静置,待分层后______ (填字母)。
A.直接将乙酸乙酯从分液漏斗上口倒出
B.直接将乙酸乙酯从分液漏斗下口放出
C.先将水层从分液漏斗的下口放出,再将乙酸乙酯从下口放出
D.先将水层从分液漏斗的下口放出,再将乙酸乙酯从上口倒出
②在得到的A中加入无水碳酸钠,振荡,目的是_____ 。
(5)为充分利用反应物,甲、乙两位同学分别设计了图中甲、乙两个装置制备乙酸乙酯(乙同学待反应完毕冷却后,再用饱和碳酸钠溶液提取烧瓶中的产物)。你认为最合理的是___________ 。


(1)若实验中用乙酸和含
 的乙醇反应,则反应的化学方程式是
的乙醇反应,则反应的化学方程式是(2)为了证明浓硫酸在该反应中起到了催化剂和吸水剂的作用,某同学利用如图所示装置进行了以下4个实验。实验开始时先用酒精灯微热3min,再加热使之微微沸腾3min。实验结束时充分振荡试管Ⅱ,静置后再测有机层的厚,度,实验记录如下:
实验编号 | 试管Ⅰ中试剂 | 试管Ⅱ中试剂 | 有机层的厚度/cm |
A | 2mL乙醇、1mL乙酸、 3mL18 | 饱和碳酸钠溶液 | 3.0 |
B | 2mL乙醇、1mL乙酸 | 0.1 | |
C | 2mL乙醇、1mL乙酸、 3mL2 | 0.6 | |
D | 2mL乙醇、1mL乙酸、盐酸 | 0.6 |
 对酯化反应具有催化作用。实验D中应加入盐酸的体积和浓度分别是
对酯化反应具有催化作用。实验D中应加入盐酸的体积和浓度分别是 。
。②分析实验
(3)若现有乙酸90g,乙醇138g,发生酯化反应得到88g乙酸乙酯,试计算该反应的产率为
(4)用如图所示的分离操作流程分离含乙酸、乙醇和水的乙酸乙酯粗产品,图中内为适当的试剂,括号内为适当的分离方法。

①试剂a是
A.直接将乙酸乙酯从分液漏斗上口倒出
B.直接将乙酸乙酯从分液漏斗下口放出
C.先将水层从分液漏斗的下口放出,再将乙酸乙酯从下口放出
D.先将水层从分液漏斗的下口放出,再将乙酸乙酯从上口倒出
②在得到的A中加入无水碳酸钠,振荡,目的是
(5)为充分利用反应物,甲、乙两位同学分别设计了图中甲、乙两个装置制备乙酸乙酯(乙同学待反应完毕冷却后,再用饱和碳酸钠溶液提取烧瓶中的产物)。你认为最合理的是

您最近一年使用:0次
解题方法
5 . 某化学小组以苯甲酸和异丙醇为原料,制取苯甲酸异丙酯。相关物质的沸点如下表:
Ⅰ、合成苯甲酸异丙酯粗产品:

在如上图所示的三颈烧瓶中加入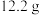 苯甲酸和
苯甲酸和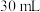 异丙醇(密度约为
异丙醇(密度约为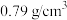 '),再小心加入
'),再小心加入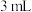 浓硫酸,混匀后,加入几块碎瓷片,维持温度
浓硫酸,混匀后,加入几块碎瓷片,维持温度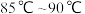 ,加热30分钟,使反应充分,得苯甲酸异丙酯粗产品。
,加热30分钟,使反应充分,得苯甲酸异丙酯粗产品。
(1)仪器 的名称是
的名称是___________ ,加入碎瓷片的作用是___________ 。
(2)制备苯甲酸异丙酯的化学方程式是___________ 。
(3)最适合该反应的加热方式是___________ (填序号)。
A.酒精灯直接加热 B.油浴加热 C.水浴加热 D.沙浴加热
Ⅱ、粗产品的精制:

(4)苯甲酸异丙酯粗产品中往往含有少量异丙醇、苯甲酸和水等,精制过程如上图所示,操作①中用到的一种重要玻璃仪器是___________ ;操作②的名称是___________ 。
(5)结合上述相关数据进行计算,苯甲酸异丙酯的产率为___________ %。
| 物质 | 异丙醇 | 苯甲酸 | 苯甲酸异丙酯 |
| 沸点/℃ | 82.4 | 249 | 218 |

在如上图所示的三颈烧瓶中加入
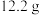 苯甲酸和
苯甲酸和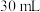 异丙醇(密度约为
异丙醇(密度约为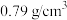 '),再小心加入
'),再小心加入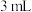 浓硫酸,混匀后,加入几块碎瓷片,维持温度
浓硫酸,混匀后,加入几块碎瓷片,维持温度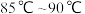 ,加热30分钟,使反应充分,得苯甲酸异丙酯粗产品。
,加热30分钟,使反应充分,得苯甲酸异丙酯粗产品。(1)仪器
 的名称是
的名称是(2)制备苯甲酸异丙酯的化学方程式是
(3)最适合该反应的加热方式是
A.酒精灯直接加热 B.油浴加热 C.水浴加热 D.沙浴加热
Ⅱ、粗产品的精制:

(4)苯甲酸异丙酯粗产品中往往含有少量异丙醇、苯甲酸和水等,精制过程如上图所示,操作①中用到的一种重要玻璃仪器是
(5)结合上述相关数据进行计算,苯甲酸异丙酯的产率为
您最近一年使用:0次
2021-06-09更新
|
582次组卷
|
2卷引用:(人教2019)选择性必修3第三章 B 素养拓展区
名校
解题方法
6 . 3,5﹣二甲氧基苯酚是重要的有机合成中间体,可用于天然物质白柠檬素的合成,一种以间苯三酚为原料的合成反应如下:
 +2H2O
+2H2O
甲醇、乙醚和3,5﹣二甲氧基苯酚的部分物理性质见下表:
(1)反应结束后,先分离出甲醇,再加入乙醚进行萃取。
①分离出甲醇的操作是__ 。
②萃取用到的分液漏斗使用前需__ 洗净,分液时有机层在分液漏斗的__ 填(“上”或“下”)层。
(2)分离得到的有机层依次用饱和NaHCO3溶液、饱和食盐水、少量蒸馏水进行洗涤。用饱和NaHCO3溶液洗涤的目的是__ ,用饱和食盐水洗涤的目的是__ 。
(3)洗涤完成后,通过以下操作分离、提纯产物,正确的操作顺序是__ (填字母)。
a.蒸馏除去乙醚 b.重结晶 c.过滤除去干燥剂 d.加入无水CaCl2干燥
 +2H2O
+2H2O甲醇、乙醚和3,5﹣二甲氧基苯酚的部分物理性质见下表:
| 物质 | 沸点/℃ | 熔点/℃ | 密度(20℃)/ g·cm-3 | 溶解性 |
| 甲醇 | 64.7 | / | 0.7915 | 易溶于水 |
| 乙醚 | 34.5 | / | 0.7138 | 微溶于水 |
| 3,5-二甲氧基苯酚 | / | 33-36 | / | 易溶于甲醇、乙醚,微溶于水 |
①分离出甲醇的操作是
②萃取用到的分液漏斗使用前需
(2)分离得到的有机层依次用饱和NaHCO3溶液、饱和食盐水、少量蒸馏水进行洗涤。用饱和NaHCO3溶液洗涤的目的是
(3)洗涤完成后,通过以下操作分离、提纯产物,正确的操作顺序是
a.蒸馏除去乙醚 b.重结晶 c.过滤除去干燥剂 d.加入无水CaCl2干燥
您最近一年使用:0次
2020-03-26更新
|
156次组卷
|
6卷引用:2015-2016学年辽宁省沈阳铁路实验中学高二下期中化学试卷
真题
名校
7 . 高纯硫酸锰作为合成镍钴锰三元正极材料的原料,工业上可由天然二氧化锰粉与硫化锰矿(还含Fe、Al、Mg、Zn、Ni、Si等元素)制备,工艺如下图所示。回答下列问题:
(1)“滤渣1”含有S和__________________________ ;写出“溶浸”中二氧化锰与硫化锰反应的化学方程式____________________________________________________ 。
(2)“氧化”中添加适量的MnO2的作用是将________________________ 。
(3)“调pH”除铁和铝,溶液的pH范围应调节为_______ ~6之间。
(4)“除杂1”的目的是除去Zn2+和Ni2+,“滤渣3”的主要成分是______________ 。
(5)“除杂2”的目的是生成MgF2沉淀除去Mg2+。若溶液酸度过高,Mg2+沉淀不完全,原因是_____________________________________________________________________ 。
(6)写出“沉锰”的离子方程式___________________________________________________ 。
(7)层状镍钴锰三元材料可作为锂离子电池正极材料,其化学式为LiNixCoyMnzO2,其中Ni、Co、Mn的化合价分别为+2、+3、+4。当x=y= 时,z=
时,z=___________ 。
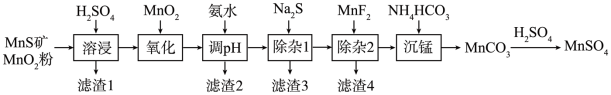
| 金属离子 | Mn2+ | Fe2+ | Fe3+ | Al3+ | Mg2+ | Zn2+ | Ni2+ |
| 开始沉淀的pH | 8.1 | 6.3 | 1.5 | 3.4 | 8.9 | 6.2 | 6.9 |
| 沉淀完全的pH | 10.1 | 8.3 | 2.8 | 4.7 | 10.9 | 8.2 | 8.9 |
(1)“滤渣1”含有S和
(2)“氧化”中添加适量的MnO2的作用是将
(3)“调pH”除铁和铝,溶液的pH范围应调节为
(4)“除杂1”的目的是除去Zn2+和Ni2+,“滤渣3”的主要成分是
(5)“除杂2”的目的是生成MgF2沉淀除去Mg2+。若溶液酸度过高,Mg2+沉淀不完全,原因是
(6)写出“沉锰”的离子方程式
(7)层状镍钴锰三元材料可作为锂离子电池正极材料,其化学式为LiNixCoyMnzO2,其中Ni、Co、Mn的化合价分别为+2、+3、+4。当x=y=
 时,z=
时,z=
您最近一年使用:0次
2019-06-09更新
|
19608次组卷
|
29卷引用:2019年全国统一高考化学试题(新课标Ⅲ)
2019年全国统一高考化学试题(新课标Ⅲ)河北省张家口市第四中学2018-2019学年高二下学期6月月考理科综合化学试题 河北省辛集中学2020届高三上学期入学考试化学试题安徽省阜阳市颍上二中等三校2020届高三上学期入学考试化学试题(已下线)专题七 工艺流程题(真题汇编)-2020年高考二轮模块化复习之《元素化合物》名师讲案与提分特训河北省承德市围场卉原中学2020届高三模拟自测联考试卷理综化学试卷2020届四川省成都市第七中学高三三月份网络教学质量监测卷化学试题(已下线)专题6.1 无机化工流程题(疑难突破)——巅峰冲刺2020年高考化学二轮专项提升四川省宜宾市叙州区第一中学校2020届高三下学期第四学月考试理综化学试题四川省宜宾市叙州区第二中学校2020届高三第一次高考适应性考试理综化学试题河南省信阳市罗山县2021届高三第一次调研(8月联考)化学试题鲁科版(2019)选择性必修1 第3章 物质在水溶液中的行为 第3节 沉淀溶解平衡高中必刷题高二选择性必修1第三章 水溶液中的离子反应与平衡 第三章素养检测(已下线)押全国卷理综第27题 工业流程-备战2021年高考化学临考题号押题(课标全国卷)天津市第二十五中学2021-2022学年高三上学期第一次月考化学试题(已下线)专题11 无机工艺流程题—2022年高考化学二轮复习讲练测(全国版)-讲义(已下线)押全国卷理综第27题 工业流程-备战2022年高考化学临考题号押题(全国卷)(已下线)回归教材重难点08 化学工艺流程分析-【查漏补缺】2022年高考化学三轮冲刺过关(全国通用)(已下线)专题16工艺流程题-五年(2018~2022)高考真题汇编(全国卷)四川省泸州市泸县第五中学2022届高三高考适应性考试理综化学试题(已下线)专题18 工艺流程题(已下线)T26-工业流程题陕西省西安市周至县第六中学2023-2024学年高三上学期11月期中化学试题河南省济源市高级中学2023-2024学年高三上学期高考模拟检测(10月)理科综合试题-高中化学甘肃省高台县第一中学2020届高三上学期期中考试化学试题山东省滕州市第一中学2020届高三3月线上模拟考试化学试题黑龙江省大庆市第四中学2020届高三下学期4月月考理综化学试题江西省宜春市第九中学2021-2022学年高三上学期10月月考化学试题黑龙江省七台河市勃利县高级中学2022-2023学年高三上学期11月期中考试化学试题



