解题方法
1 . 我国资源丰富,合理开发利用资源,才能实现可持续发展。
Ⅰ.以原油为原科生产有机高分子材料聚乙烯、聚丙烯的流程如下:

(1)流程中②表示的加工方法是____(填序号)。
(2)写出聚乙烯的结构简式_______ 。
Ⅱ.浩瀚的海洋中蕴藏着丰富的资源。从海水中可以提取很多有用的物质,例如从海水制盐所得到的卤水中可以提取碘。活性炭吸附法是工业提取碘的方法之一,其流程如下:
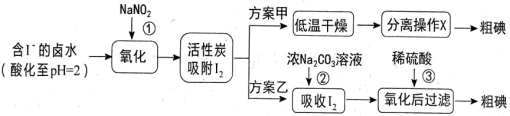
资料显示:
ⅰ. pH=2 时, NaNO2溶液只能将I-氧化为I2,同时生成 NO
ⅱ. I2+5Cl2+6H2O=2HIO3+10HCl; 氧化性:KMnO4>Cl2
ⅲ. 2Fe3++2I-=2Fe2++I2
(3)写出反应①的离子方程式_______ 。
(4)方案甲中,根据 I2的特性,分离操作 X 应为___________ 、冷凝结晶。
(5)Cl2、酸性KMnO4等都是常用的强氧化剂,但该工艺中氧化卤水中的 I-却选择了价格较高的NaNO2,原因是_______ 。
(6)方案乙中,已知反应③过滤后,滤液中仍存在少量的 I2、I-。 为了检验滤液中的 I-,某小组同学设计如下实验方案,请将实验步骤补充完整。
实验中可供选择的试剂:稀H2SO4、淀粉溶液、Fe2(SO4)3溶液、CCl4。
a.将滤液用CCl4多次萃取、分液,直到水层用淀粉溶液检验不出碘单质存在,
b.从水层取少量溶液于试管中,_______ 。
Ⅰ.以原油为原科生产有机高分子材料聚乙烯、聚丙烯的流程如下:

(1)流程中②表示的加工方法是____(填序号)。
| A.分馏 | B.聚合 | C.裂解 | D.干馏 |
Ⅱ.浩瀚的海洋中蕴藏着丰富的资源。从海水中可以提取很多有用的物质,例如从海水制盐所得到的卤水中可以提取碘。活性炭吸附法是工业提取碘的方法之一,其流程如下:

资料显示:
ⅰ. pH=2 时, NaNO2溶液只能将I-氧化为I2,同时生成 NO
ⅱ. I2+5Cl2+6H2O=2HIO3+10HCl; 氧化性:KMnO4>Cl2
ⅲ. 2Fe3++2I-=2Fe2++I2
(3)写出反应①的离子方程式
(4)方案甲中,根据 I2的特性,分离操作 X 应为
(5)Cl2、酸性KMnO4等都是常用的强氧化剂,但该工艺中氧化卤水中的 I-却选择了价格较高的NaNO2,原因是
(6)方案乙中,已知反应③过滤后,滤液中仍存在少量的 I2、I-。 为了检验滤液中的 I-,某小组同学设计如下实验方案,请将实验步骤补充完整。
实验中可供选择的试剂:稀H2SO4、淀粉溶液、Fe2(SO4)3溶液、CCl4。
a.将滤液用CCl4多次萃取、分液,直到水层用淀粉溶液检验不出碘单质存在,
b.从水层取少量溶液于试管中,
您最近一年使用:0次
名校
2 . 我国有广阔的海岸线,海水是巨大的资源宝库,海水淡化及其综合利用具有重要意义。请回答下列问题:

(1)步骤1中,粗盐中含有Ca2+、Mg2+、 等杂质离子,精制时常用的试剂有:①稀盐酸;②氯化钡溶液;③氢氧化钠溶液;④碳酸钠溶液。下列加入试剂的顺序正确的是_______ (填字 母)
等杂质离子,精制时常用的试剂有:①稀盐酸;②氯化钡溶液;③氢氧化钠溶液;④碳酸钠溶液。下列加入试剂的顺序正确的是_______ (填字 母)
(2)步骤II通入热空气或水蒸气吹出Br2,利用了溴的_______(填字母)
(3)写出步骤III反应的离子方程式_______ ;
(4)从理论上考虑,下列物质的溶液也能与Br2反应的是_______(填字母)
(5)在实验室中可以用萃取的方法提取溴,可选用的试剂是_______ (填字母)
A.酒精 B.醋酸 C.四氯化碳
所用主要玻璃仪器的名称是_______ 。

(1)步骤1中,粗盐中含有Ca2+、Mg2+、
 等杂质离子,精制时常用的试剂有:①稀盐酸;②氯化钡溶液;③氢氧化钠溶液;④碳酸钠溶液。下列加入试剂的顺序正确的是_______ (填字 母)
等杂质离子,精制时常用的试剂有:①稀盐酸;②氯化钡溶液;③氢氧化钠溶液;④碳酸钠溶液。下列加入试剂的顺序正确的是_______ (填字 母)| A.①②③④ | B.②③④① | C.④③②① | D.③④②① |
| A.氧化性 | B.还原性 | C.挥发性 | D.腐蚀性 |
(4)从理论上考虑,下列物质的溶液也能与Br2反应的是_______(填字母)
| A.NaCl | B.Na2CO3 | C.Na2SO3 | D.FeCl3 |
A.酒精 B.醋酸 C.四氯化碳
所用主要玻璃仪器的名称是
您最近一年使用:0次
3 . 由下列实验及现象不能推出相应结论的是
| 实验 | 现象 | 结论 | |
| A | 向2mL0.1mol·L-1的FeCl3溶液中加足量铁粉,振荡,加1滴KSCN溶液 | 黄色逐期消失,加KSCN溶液颜色不变 | 还原性:Fe>Fe2+ |
| B | 将金属钠在燃烧匙中点燃,迅速伸入集满CO2的集气瓶 | 集气瓶中产生大量白烟,瓶内有黑色颗粒产生 | CO2具有氧化性 |
| C | 加热盛有少NH4HCO3固体的试管,并在试管口放置湿润的红色石蕊试纸 | 石蕊试纸变蓝 | NH4HCO3显碱性 |
| D | 向2支盛有2mL相同浓度银氨溶液的试管中分别加入2滴相同浓度的NaCl和NaI溶液 | 一支试管中产生黄色沉淀,另一支中无明显现象 | Ksp(AgI)<Ksp(AgCl) |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2017-08-08更新
|
10594次组卷
|
24卷引用:2017年全国普通高等学校招生统一考试理综化学(新课标Ⅱ卷精编版)
2017年全国普通高等学校招生统一考试理综化学(新课标Ⅱ卷精编版)四川省双流中学2018届高三11月月考理科综合化学试题四川省广安市岳池中学2018届高三上学期第三次月考理综化学试题北京市101中学2018届高三3月月考化学试题西藏拉萨北京实验中学2018届高三第五次月考理科综合化学试题陕西省西安市远东第一中学2019届高三上学期10月月考化学试题百所名校联考-金属及其化合物黑龙江省哈尔滨市第六中学2020届高三上学期第三次调研考试化学试题河北省石家庄市第二中学2020届高三下学期教学质量检测模拟考试理综化学试题西藏自治区拉萨市拉萨中学2020届高三第七次月考试理综化学试题湖北省黄冈市黄梅国际育才高级中学2019-2020学年高二上学期10月月考化学试题四川省成都市龙泉中学2021届高三上学期开学考试化学试题四川省成都附属实验中学2021届高三上学期11月月考理科综合化学试题福建师范大学第二附属中学2019-2020学年高二上学期期末考试化学试题四川省内江市威远中学2020-2021学年高三12月月考化学试题(已下线)考向34 物质的检验、分离和提纯-备战2022年高考化学一轮复习考点微专题河南省商丘市夏邑县第一高级中学2021-2022学年高二下学期6月份月考化学试题辽宁省锦州市渤海大学附属高级中学2023-2024学年高三上学期第三次考试化学试题广东省揭阳市第一中学2018届高三上学期第二次阶段考试化学试题安徽省淮北市第一中学2017-2018学年高二下学期第一次月考化学试题1江苏省常州市第一中学2019届高三第一学期期初(8月)考试化学试题江苏师范大学附属实验学校2019届高三上学期10月学情调研化学试题湖北省鄂州市2019-2020学年高二上学期期末考试化学试题黑龙江省大庆铁人中学2020届高三考前模拟训练(一)理科综合化学试题
名校
4 . 海水中溴含量约为67mg•L-1,从海水中提取溴的一种工艺流程如图:

(1)步骤Ⅰ中已获得游离态的溴,步骤Ⅱ又将之转化为化合态的溴,其目的是___ 。
(2)步骤Ⅱ中通入热空气吹出Br2,利用了Br2的___ (填序号)。
A.氧化性 B.还原性
C.挥发性 D.腐蚀性
(3)步骤Ⅱ中涉及的离子反应如下,请在横线上填上适当的化学计量数:___ Br2+___ CO32-——___ BrO3-+___ Br-+___ CO2。
(4)上述流程中吹出的溴蒸汽也可先用二氧化硫的水溶液吸收,再用氯气氧化,最后蒸馏,写出Br2与SO2水溶液反应的化学方程式:___ 。

(1)步骤Ⅰ中已获得游离态的溴,步骤Ⅱ又将之转化为化合态的溴,其目的是
(2)步骤Ⅱ中通入热空气吹出Br2,利用了Br2的
A.氧化性 B.还原性
C.挥发性 D.腐蚀性
(3)步骤Ⅱ中涉及的离子反应如下,请在横线上填上适当的化学计量数:
(4)上述流程中吹出的溴蒸汽也可先用二氧化硫的水溶液吸收,再用氯气氧化,最后蒸馏,写出Br2与SO2水溶液反应的化学方程式:
您最近一年使用:0次
2020-04-19更新
|
319次组卷
|
2卷引用:鲁科版(2019)必修第二册第1章 本章自我评价
解题方法
5 . 水污染是常见的环境问题,每一个人都应该自觉地保护水资源,防止污染物随意排放到水体中。当化学实验中产生的废液酸性、碱性过强或含有超出排放标准的离子时,也需要集中处理后才能排放。某次化学实验后,回收的废液中可能含有 、
、 和
和 。
。
(1)如何确定废液中是否存在 ,写出你的实验方案及相关反应的离子方程式
,写出你的实验方案及相关反应的离子方程式________ 。
(2)若废液中存在 、
、 和
和 这三种离子,现需要从废液中除去这些离子,且对铜、银两种金属分别回收,以方便后续处理。请你设计废液处理方案,用流程图表示
这三种离子,现需要从废液中除去这些离子,且对铜、银两种金属分别回收,以方便后续处理。请你设计废液处理方案,用流程图表示_______ ,并写出相关反应的离子方程式_________ 。
 、
、 和
和 。
。(1)如何确定废液中是否存在
 ,写出你的实验方案及相关反应的离子方程式
,写出你的实验方案及相关反应的离子方程式(2)若废液中存在
 、
、 和
和 这三种离子,现需要从废液中除去这些离子,且对铜、银两种金属分别回收,以方便后续处理。请你设计废液处理方案,用流程图表示
这三种离子,现需要从废液中除去这些离子,且对铜、银两种金属分别回收,以方便后续处理。请你设计废液处理方案,用流程图表示
您最近一年使用:0次
名校
6 . 某研究性学习小组的学生为了从含 、
、 、
、 的废液中回收
的废液中回收 ,设计了两种方案并进行评价。
,设计了两种方案并进行评价。
方案1:向废液中加入过量的铁粉,充分反应后,___ 。向所得滤渣中加入足量的盐酸,充分反应后,过滤即得到铜。
方案2:向废液中加入适量盐酸调节溶液的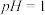 ,用铜和石墨做电极进行电解。当观察到
,用铜和石墨做电极进行电解。当观察到 ___ 时,停止电解,这时要回收的 已全部析出。
已全部析出。
(1)方案1中涉及的四种阳离子的氧化性由强到弱的顺序为________ ;过滤时,需要用到的玻璃仪器是_______ 。
(2)方案2在电极上直接回收铜,操作比方案1简便,但也有不足之处,主要表现为_____________________ 。
 、
、 、
、 的废液中回收
的废液中回收 ,设计了两种方案并进行评价。
,设计了两种方案并进行评价。方案1:向废液中加入过量的铁粉,充分反应后,
方案2:向废液中加入适量盐酸调节溶液的
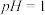 ,用铜和石墨做电极进行电解。当观察到
,用铜和石墨做电极进行电解。当观察到  已全部析出。
已全部析出。(1)方案1中涉及的四种阳离子的氧化性由强到弱的顺序为
(2)方案2在电极上直接回收铜,操作比方案1简便,但也有不足之处,主要表现为
您最近一年使用:0次
2020-09-16更新
|
142次组卷
|
3卷引用:鲁科版(2019)选择性必修1 第1章 化学反应与能量转化 第3节 电能转化为化学能——电解
解题方法
7 . 稀土是一种重要的战略资源。氟碳铈矿的主要化学成分为 ,它是提取铈(
,它是提取铈( )等稀土元素的重要矿物原料。常温下,氟碳铈矿的冶炼工艺流程如下:
)等稀土元素的重要矿物原料。常温下,氟碳铈矿的冶炼工艺流程如下:
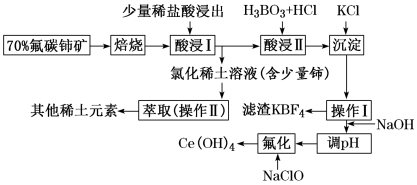
已知:ⅰ. 元素的常见化合价为
元素的常见化合价为 、
、 。焙烧后
。焙烧后 元素转化成
元素转化成 和
和 。
。 价的
价的 元素不易进入溶液,而
元素不易进入溶液,而 价稀土元素易进入溶液。
价稀土元素易进入溶液。
ⅱ.酸浸Ⅱ中发生反应: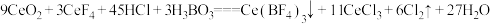 。
。
请回答下列问题:
(1)①焙烧氟碳铈矿的目的是____________ 。
②焙烧后产生的CeO2是汽车尾气净化催化剂的关键成分,它能在还原气氛中供氧,在氧化气氛中耗氧。在尾气消除过程中发生反应CeO2 CeO2(1-x)+xO2↑(0≤x≤0.25)。写出CeO2消除CO尾气的化学方程式:
CeO2(1-x)+xO2↑(0≤x≤0.25)。写出CeO2消除CO尾气的化学方程式:______________ 。
(2)在酸浸Ⅰ中用盐酸浸出时,有少量铈进入滤液,且产生黄绿色气体,该反应的离子方程式是______ 。
(3)操作Ⅰ的名称为________ ,在实验室中进行操作Ⅱ时所需要的玻璃仪器有__________ 。
(4)操作Ⅰ后,向溶液中加入 溶液来调节溶液的pH,以获得
溶液来调节溶液的pH,以获得 沉淀,常温下加入
沉淀,常温下加入 溶液调节溶液的
溶液调节溶液的
________ 即可认为 已完全沉淀。(已知:常温下,
已完全沉淀。(已知:常温下,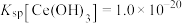 )
)
(5)取上述流程中得到的 产品
产品 ,加酸溶解后,向其中加入含
,加酸溶解后,向其中加入含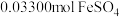 的
的 溶液使
溶液使 全部被还原成
全部被还原成 ,再用
,再用 的酸性
的酸性 标准溶液滴定至终点时,消耗
标准溶液滴定至终点时,消耗 标准溶液。则该产品中
标准溶液。则该产品中 的质量分数为
的质量分数为______ [已知氧化性: ;
; 的相对分子质量为208]。
的相对分子质量为208]。
 ,它是提取铈(
,它是提取铈( )等稀土元素的重要矿物原料。常温下,氟碳铈矿的冶炼工艺流程如下:
)等稀土元素的重要矿物原料。常温下,氟碳铈矿的冶炼工艺流程如下:
已知:ⅰ.
 元素的常见化合价为
元素的常见化合价为 、
、 。焙烧后
。焙烧后 元素转化成
元素转化成 和
和 。
。 价的
价的 元素不易进入溶液,而
元素不易进入溶液,而 价稀土元素易进入溶液。
价稀土元素易进入溶液。ⅱ.酸浸Ⅱ中发生反应:
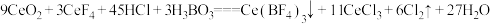 。
。请回答下列问题:
(1)①焙烧氟碳铈矿的目的是
②焙烧后产生的CeO2是汽车尾气净化催化剂的关键成分,它能在还原气氛中供氧,在氧化气氛中耗氧。在尾气消除过程中发生反应CeO2
 CeO2(1-x)+xO2↑(0≤x≤0.25)。写出CeO2消除CO尾气的化学方程式:
CeO2(1-x)+xO2↑(0≤x≤0.25)。写出CeO2消除CO尾气的化学方程式:(2)在酸浸Ⅰ中用盐酸浸出时,有少量铈进入滤液,且产生黄绿色气体,该反应的离子方程式是
(3)操作Ⅰ的名称为
(4)操作Ⅰ后,向溶液中加入
 溶液来调节溶液的pH,以获得
溶液来调节溶液的pH,以获得 沉淀,常温下加入
沉淀,常温下加入 溶液调节溶液的
溶液调节溶液的
 已完全沉淀。(已知:常温下,
已完全沉淀。(已知:常温下,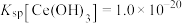 )
)(5)取上述流程中得到的
 产品
产品 ,加酸溶解后,向其中加入含
,加酸溶解后,向其中加入含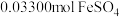 的
的 溶液使
溶液使 全部被还原成
全部被还原成 ,再用
,再用 的酸性
的酸性 标准溶液滴定至终点时,消耗
标准溶液滴定至终点时,消耗 标准溶液。则该产品中
标准溶液。则该产品中 的质量分数为
的质量分数为 ;
; 的相对分子质量为208]。
的相对分子质量为208]。
您最近一年使用:0次
2020-10-13更新
|
406次组卷
|
2卷引用:人教版(2019)高二化学选择性必修1第三章 水溶液中的离子反应与平衡 过模拟 2年模拟精编精练
8 . 下列关于实验室制取 的说法正确的是
的说法正确的是
 的说法正确的是
的说法正确的是
A.将混有 的 的 通过盛有饱和 通过盛有饱和 溶液的洗气瓶除去杂质 溶液的洗气瓶除去杂质 |
B.实验室制取 ,浓盐酸体现酸性和氧化性 ,浓盐酸体现酸性和氧化性 |
C.实验室用如图装置除去 中的少量 中的少量 |
D.实验室制备 可用排饱和食盐水集气法收集 可用排饱和食盐水集气法收集 |
您最近一年使用:0次
2020-09-01更新
|
382次组卷
|
6卷引用:苏教版(2020)高一必修第一册专题3第一单元课时1 氯气的发现与制备
苏教版(2020)高一必修第一册专题3第一单元课时1 氯气的发现与制备人教版(2019)高一必修第一册 第二章 第二节课时2 氯气的实验室制法及氯离子的检验鲁科版(2019)高一必修第一册第2章 元素与物质世界 第3节 氧化还原反应 课时2 氧化剂和还原剂 氧化还原反应的应用(已下线)2.2.1 氯气的性质(精练)-2020-2021学年上学期高一化学同步精品课堂(人教版必修第一册)(已下线)2.2.2 氯气的实验室制法 氯离子的检验(精练)-2020-2021学年上学期高一化学同步精品课堂(人教版必修第一册)江西省奉新县第一中学2021届高三上学期第一次月考化学试题
解题方法
9 . 海水是巨大的资源宝库,从海水中提取食盐和溴的过程如下:

(1)请列举食盐的两种用途:______________ 、________________ 。
(2)将NaCl溶液进行电解,写出该反应的离子方程式:_______________ 。
(3)步骤Ⅰ已获得 ,步骤Ⅱ又将
,步骤Ⅱ又将 还原为
还原为 ,其目的是
,其目的是____________ 。
(4)某化学学习小组为了解工业生产中溴的提纯方法,查阅了有关资料: 的沸点为59℃,微溶于水,有毒性和强腐蚀性。他们设计如图所示装置(省略加热和夹持装置)进行溴的提纯:请回答下列问题。
的沸点为59℃,微溶于水,有毒性和强腐蚀性。他们设计如图所示装置(省略加热和夹持装置)进行溴的提纯:请回答下列问题。

①图中仪器B的名称:__________________ 。
②整套实验装置中仪器的连接均不能用橡胶塞和橡胶管,其原因是__________________ 。
③实验装置气密性良好,要达到提纯溴的目的,操作中如何控制关键条件:_________________ 。
④C中产生的液体颜色为_________ 。为除去该产物中仍残留的少量 ,可向其中加入NaBr溶液,充分反应后,再进行的分离操作是
,可向其中加入NaBr溶液,充分反应后,再进行的分离操作是__________ 。

(1)请列举食盐的两种用途:
(2)将NaCl溶液进行电解,写出该反应的离子方程式:
(3)步骤Ⅰ已获得
 ,步骤Ⅱ又将
,步骤Ⅱ又将 还原为
还原为 ,其目的是
,其目的是(4)某化学学习小组为了解工业生产中溴的提纯方法,查阅了有关资料:
 的沸点为59℃,微溶于水,有毒性和强腐蚀性。他们设计如图所示装置(省略加热和夹持装置)进行溴的提纯:请回答下列问题。
的沸点为59℃,微溶于水,有毒性和强腐蚀性。他们设计如图所示装置(省略加热和夹持装置)进行溴的提纯:请回答下列问题。
①图中仪器B的名称:
②整套实验装置中仪器的连接均不能用橡胶塞和橡胶管,其原因是
③实验装置气密性良好,要达到提纯溴的目的,操作中如何控制关键条件:
④C中产生的液体颜色为
 ,可向其中加入NaBr溶液,充分反应后,再进行的分离操作是
,可向其中加入NaBr溶液,充分反应后,再进行的分离操作是
您最近一年使用:0次
10 . 海水是巨大的资源宝库,从海水中提取食盐和溴的过程如图:

(1)为除去粗盐中的杂质( 、
、 、
、 ),加入的试剂顺序正确的是
),加入的试剂顺序正确的是______ (填序号)。
A.NaOH溶液→ 溶液→
溶液→ 溶液→过滤后加盐酸
溶液→过滤后加盐酸
B. 溶液→NaOH溶液→
溶液→NaOH溶液→ 溶液→过滤后加盐酸
溶液→过滤后加盐酸
C.NaOH溶液→ 溶液→
溶液→ 溶液→过滤后加盐酸
溶液→过滤后加盐酸
D. 溶液→NaOH溶液→
溶液→NaOH溶液→ 溶液→过滤后加盐酸
溶液→过滤后加盐酸
(2)制备钠单质的方法之一是电解熔融NaCl,写出电解的化学方程式:_________ 。
(3)某化学兴趣小组的同学为了了解从工业溴中提纯溴的方法,查阅了有关资料; 的沸点为59℃,微溶于水,有毒性和强腐蚀性。他们参观生产过程后,设计了如图实验装置:
的沸点为59℃,微溶于水,有毒性和强腐蚀性。他们参观生产过程后,设计了如图实验装置:
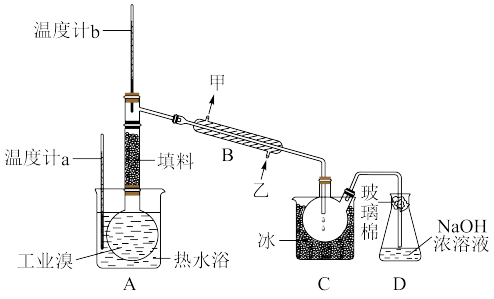
①图中仪器B的名称是_______ ,冷却水的出口为________ (填“甲”或“乙”)。
②C中液体的颜色为________ 。
③D装置的作用是_________ 。
(4)已知某溶液中 、
、 、
、 的物质的量之比为2:3:4,现欲使溶液中的
的物质的量之比为2:3:4,现欲使溶液中的 、
、 、
、 的物质的量之比变成4:3:2,那么需要通入
的物质的量之比变成4:3:2,那么需要通入 的物质的量是原溶液中
的物质的量是原溶液中 的物质的量的
的物质的量的______ (填序号)。
A. B.
B. C.
C. D.
D.

(1)为除去粗盐中的杂质(
 、
、 、
、 ),加入的试剂顺序正确的是
),加入的试剂顺序正确的是A.NaOH溶液→
 溶液→
溶液→ 溶液→过滤后加盐酸
溶液→过滤后加盐酸B.
 溶液→NaOH溶液→
溶液→NaOH溶液→ 溶液→过滤后加盐酸
溶液→过滤后加盐酸C.NaOH溶液→
 溶液→
溶液→ 溶液→过滤后加盐酸
溶液→过滤后加盐酸D.
 溶液→NaOH溶液→
溶液→NaOH溶液→ 溶液→过滤后加盐酸
溶液→过滤后加盐酸(2)制备钠单质的方法之一是电解熔融NaCl,写出电解的化学方程式:
(3)某化学兴趣小组的同学为了了解从工业溴中提纯溴的方法,查阅了有关资料;
 的沸点为59℃,微溶于水,有毒性和强腐蚀性。他们参观生产过程后,设计了如图实验装置:
的沸点为59℃,微溶于水,有毒性和强腐蚀性。他们参观生产过程后,设计了如图实验装置:
①图中仪器B的名称是
②C中液体的颜色为
③D装置的作用是
(4)已知某溶液中
 、
、 、
、 的物质的量之比为2:3:4,现欲使溶液中的
的物质的量之比为2:3:4,现欲使溶液中的 、
、 、
、 的物质的量之比变成4:3:2,那么需要通入
的物质的量之比变成4:3:2,那么需要通入 的物质的量是原溶液中
的物质的量是原溶液中 的物质的量的
的物质的量的A.
 B.
B. C.
C. D.
D.
您最近一年使用:0次
2020-09-25更新
|
452次组卷
|
2卷引用:高一必修第二册(人教2019版)第八章 化学与可持续发展 素养检测



