稀土是一种重要的战略资源。氟碳铈矿的主要化学成分为 ,它是提取铈(
,它是提取铈( )等稀土元素的重要矿物原料。常温下,氟碳铈矿的冶炼工艺流程如下:
)等稀土元素的重要矿物原料。常温下,氟碳铈矿的冶炼工艺流程如下:
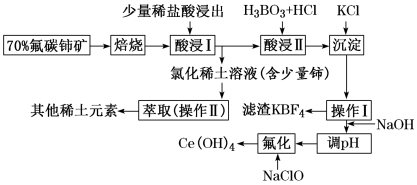
已知:ⅰ. 元素的常见化合价为
元素的常见化合价为 、
、 。焙烧后
。焙烧后 元素转化成
元素转化成 和
和 。
。 价的
价的 元素不易进入溶液,而
元素不易进入溶液,而 价稀土元素易进入溶液。
价稀土元素易进入溶液。
ⅱ.酸浸Ⅱ中发生反应: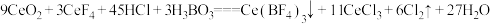 。
。
请回答下列问题:
(1)①焙烧氟碳铈矿的目的是____________ 。
②焙烧后产生的CeO2是汽车尾气净化催化剂的关键成分,它能在还原气氛中供氧,在氧化气氛中耗氧。在尾气消除过程中发生反应CeO2 CeO2(1-x)+xO2↑(0≤x≤0.25)。写出CeO2消除CO尾气的化学方程式:
CeO2(1-x)+xO2↑(0≤x≤0.25)。写出CeO2消除CO尾气的化学方程式:______________ 。
(2)在酸浸Ⅰ中用盐酸浸出时,有少量铈进入滤液,且产生黄绿色气体,该反应的离子方程式是______ 。
(3)操作Ⅰ的名称为________ ,在实验室中进行操作Ⅱ时所需要的玻璃仪器有__________ 。
(4)操作Ⅰ后,向溶液中加入 溶液来调节溶液的pH,以获得
溶液来调节溶液的pH,以获得 沉淀,常温下加入
沉淀,常温下加入 溶液调节溶液的
溶液调节溶液的
________ 即可认为 已完全沉淀。(已知:常温下,
已完全沉淀。(已知:常温下,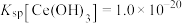 )
)
(5)取上述流程中得到的 产品
产品 ,加酸溶解后,向其中加入含
,加酸溶解后,向其中加入含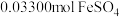 的
的 溶液使
溶液使 全部被还原成
全部被还原成 ,再用
,再用 的酸性
的酸性 标准溶液滴定至终点时,消耗
标准溶液滴定至终点时,消耗 标准溶液。则该产品中
标准溶液。则该产品中 的质量分数为
的质量分数为______ [已知氧化性: ;
; 的相对分子质量为208]。
的相对分子质量为208]。
 ,它是提取铈(
,它是提取铈( )等稀土元素的重要矿物原料。常温下,氟碳铈矿的冶炼工艺流程如下:
)等稀土元素的重要矿物原料。常温下,氟碳铈矿的冶炼工艺流程如下:
已知:ⅰ.
 元素的常见化合价为
元素的常见化合价为 、
、 。焙烧后
。焙烧后 元素转化成
元素转化成 和
和 。
。 价的
价的 元素不易进入溶液,而
元素不易进入溶液,而 价稀土元素易进入溶液。
价稀土元素易进入溶液。ⅱ.酸浸Ⅱ中发生反应:
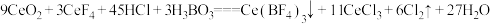 。
。请回答下列问题:
(1)①焙烧氟碳铈矿的目的是
②焙烧后产生的CeO2是汽车尾气净化催化剂的关键成分,它能在还原气氛中供氧,在氧化气氛中耗氧。在尾气消除过程中发生反应CeO2
 CeO2(1-x)+xO2↑(0≤x≤0.25)。写出CeO2消除CO尾气的化学方程式:
CeO2(1-x)+xO2↑(0≤x≤0.25)。写出CeO2消除CO尾气的化学方程式:(2)在酸浸Ⅰ中用盐酸浸出时,有少量铈进入滤液,且产生黄绿色气体,该反应的离子方程式是
(3)操作Ⅰ的名称为
(4)操作Ⅰ后,向溶液中加入
 溶液来调节溶液的pH,以获得
溶液来调节溶液的pH,以获得 沉淀,常温下加入
沉淀,常温下加入 溶液调节溶液的
溶液调节溶液的
 已完全沉淀。(已知:常温下,
已完全沉淀。(已知:常温下,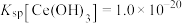 )
)(5)取上述流程中得到的
 产品
产品 ,加酸溶解后,向其中加入含
,加酸溶解后,向其中加入含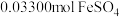 的
的 溶液使
溶液使 全部被还原成
全部被还原成 ,再用
,再用 的酸性
的酸性 标准溶液滴定至终点时,消耗
标准溶液滴定至终点时,消耗 标准溶液。则该产品中
标准溶液。则该产品中 的质量分数为
的质量分数为 ;
; 的相对分子质量为208]。
的相对分子质量为208]。
更新时间:2020-10-13 19:30:34
|
相似题推荐
【推荐1】富硼渣中含有镁硼酸盐(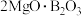 )、镁硅酸盐(
)、镁硅酸盐(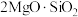 )及少量
)及少量 、FeO等杂质。由富硼渣湿法制备硫酸镁晶体和硼酸(
、FeO等杂质。由富硼渣湿法制备硫酸镁晶体和硼酸( )晶体的一种工艺流程如下:
)晶体的一种工艺流程如下:
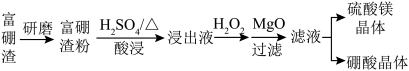
已知:生成氢氧化物沉淀的pH(金属离子的起始浓度为0.1 )
)
(1)酸浸时发生反应:
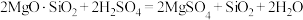 ,
,
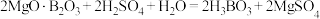 。
。
①上述反应体现出酸的强弱:
________________  (填“>”或“<”)。
(填“>”或“<”)。
②已知硼酸与过量NaOH溶液发生的中和反应为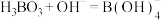 。下列关于硼酸的说法正确的是
。下列关于硼酸的说法正确的是________________ (填字母)。
A.硼酸是一元酸
B.向 固体中滴加饱和硼酸溶液,有气泡产生
固体中滴加饱和硼酸溶液,有气泡产生
C.硼酸的电离方程式可表示为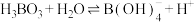
(2)用离子方程式解释 的作用
的作用________________ 。
(3)除去浸出液中的杂质离子:用MgO调节溶液的pH至___________ ,使杂质离子转化为____________ (填化学式)沉淀,过滤。
(4)写出 (s)与
(s)与 (aq)反应的离子方程式
(aq)反应的离子方程式___ ,该反应的平衡常数K=___ (计算出具体数值)。
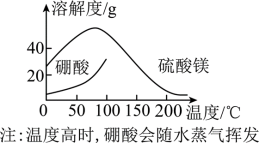
(5)获取晶体:
ⅰ.浓缩滤液,使 和
和 接近饱和;
接近饱和;
ⅱ.控制温度使两种晶体分别从溶液中结晶。结合如图溶解度曲线,简述ⅱ的方法:将浓缩液加入到高压釜中,升温结晶得到_____________ 晶体,分离后,再将母液降温结晶,分离得到_____________ 晶体。
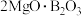 )、镁硅酸盐(
)、镁硅酸盐(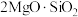 )及少量
)及少量 、FeO等杂质。由富硼渣湿法制备硫酸镁晶体和硼酸(
、FeO等杂质。由富硼渣湿法制备硫酸镁晶体和硼酸( )晶体的一种工艺流程如下:
)晶体的一种工艺流程如下: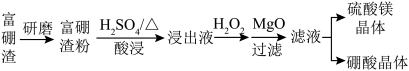
已知:生成氢氧化物沉淀的pH(金属离子的起始浓度为0.1
 )
)
|
|
|
| |
开始沉淀时 | 1.9 | 3.4 | 7.0 | 9.1 |
完全沉淀时 | 3.2 | 4.7 | 9.0 | 11.1 |
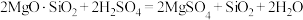 ,
,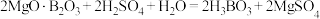 。
。①上述反应体现出酸的强弱:

 (填“>”或“<”)。
(填“>”或“<”)。②已知硼酸与过量NaOH溶液发生的中和反应为
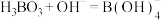 。下列关于硼酸的说法正确的是
。下列关于硼酸的说法正确的是A.硼酸是一元酸
B.向
 固体中滴加饱和硼酸溶液,有气泡产生
固体中滴加饱和硼酸溶液,有气泡产生C.硼酸的电离方程式可表示为
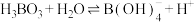
(2)用离子方程式解释
 的作用
的作用(3)除去浸出液中的杂质离子:用MgO调节溶液的pH至
(4)写出
 (s)与
(s)与 (aq)反应的离子方程式
(aq)反应的离子方程式(5)获取晶体:
ⅰ.浓缩滤液,使
 和
和 接近饱和;
接近饱和;ⅱ.控制温度使两种晶体分别从溶液中结晶。结合如图溶解度曲线,简述ⅱ的方法:将浓缩液加入到高压釜中,升温结晶得到

您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐2】稀土是一种重要的战略资源。氟碳铈矿主要化学成分为CeFCO3,它是提取铈等稀土元素的重要矿物原料。氟碳铈矿的冶炼工艺流程如下:
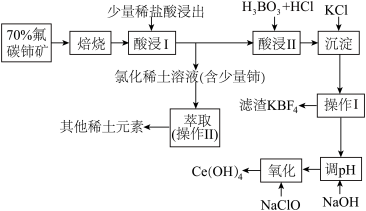
已知:铈的常见化合价为+3、+4。焙烧后铈元素转化成CeO2和CeF4。四价铈不易进入溶液,而三价稀土元素易进入溶液;
酸浸II中发生反应:
9CeO2+3CeF4+45HCl+3H3BO3=Ce(BF4)3↓+11CeCl3+6Cl2↑+27H2O;c(Ce3+)≤10-5 mol/L 时,完全沉淀。
请回答下列问题:
(1)①焙烧时先要将氟碳C矿粉碎,目的是___________ 。
②焙烧后产生的CeO2是汽车尾气净化催化剂的关键成分,它能在还原气氛中供氧,在氧化气氛中耗氧。在尾气消除过程中发生着CeO2 CeO2(1-x)+xO2↑的循环。写出CeO2消除CO尾气的化学方程式:
CeO2(1-x)+xO2↑的循环。写出CeO2消除CO尾气的化学方程式:________ 。
(2)在酸浸I中用盐酸浸出时,有少量铈进入滤液,且产生黄绿色气体。 少量铈由CeO2进入稀土溶液发生反应的离子方程式是_______ 。
(3)向Ce(BF4)3中加入KCl溶液的目的是_________ 。
(4)操作I的名称为_________ ,在实验室中进行操作II时所需要的硅酸盐仪器有_______ 。
(5)“操作I”后,向溶液中加入NaOH溶液来调节溶液的pH,以获得Ce(OH)3沉淀,常温下加入NaOH调节溶液的 pH应大于______ 即可认为Ce3+已完全沉淀。{已知:Ksp[Ce(OH)3]=1.0 ×10-20}
(6)取上述流程中得到的Ce(OH)4产品5.00g,加酸溶解后,向其中加入含0.033 00 mol FeSO4的FeSO4溶液使Ce4+全部被还原成Ce3+,再用0.100 0mol/L的酸性KMnO4标准溶液滴定至终点时,平均消耗20.00 mL标准溶液。则该产品中Ce(OH)4的质量分数为______ (保留2位小数,已知氧化性:Ce4+ >KMnO4;Ce(OH)4的相对分子质量为208)

已知:铈的常见化合价为+3、+4。焙烧后铈元素转化成CeO2和CeF4。四价铈不易进入溶液,而三价稀土元素易进入溶液;
酸浸II中发生反应:
9CeO2+3CeF4+45HCl+3H3BO3=Ce(BF4)3↓+11CeCl3+6Cl2↑+27H2O;c(Ce3+)≤10-5 mol/L 时,完全沉淀。
请回答下列问题:
(1)①焙烧时先要将氟碳C矿粉碎,目的是
②焙烧后产生的CeO2是汽车尾气净化催化剂的关键成分,它能在还原气氛中供氧,在氧化气氛中耗氧。在尾气消除过程中发生着CeO2
 CeO2(1-x)+xO2↑的循环。写出CeO2消除CO尾气的化学方程式:
CeO2(1-x)+xO2↑的循环。写出CeO2消除CO尾气的化学方程式:(2)在酸浸I中用盐酸浸出时,有少量铈进入滤液,且产生黄绿色气体。 少量铈由CeO2进入稀土溶液发生反应的离子方程式是
(3)向Ce(BF4)3中加入KCl溶液的目的是
(4)操作I的名称为
(5)“操作I”后,向溶液中加入NaOH溶液来调节溶液的pH,以获得Ce(OH)3沉淀,常温下加入NaOH调节溶液的 pH应大于
(6)取上述流程中得到的Ce(OH)4产品5.00g,加酸溶解后,向其中加入含0.033 00 mol FeSO4的FeSO4溶液使Ce4+全部被还原成Ce3+,再用0.100 0mol/L的酸性KMnO4标准溶液滴定至终点时,平均消耗20.00 mL标准溶液。则该产品中Ce(OH)4的质量分数为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐3】氯化亚铜(CuCl)难溶于水,在潮湿空气中可被迅速氧化,是电镀行业的原料。实验室中利用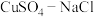 混合液与
混合液与 溶液反应制取CuCl。装置及相关数据如下:
溶液反应制取CuCl。装置及相关数据如下:
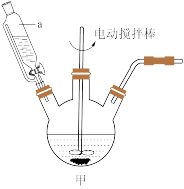
回答下列问题:
(1)仪器a的名称是_______ ;制备过程中 过量会发生副反应生成
过量会发生副反应生成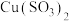 ,为提高产率,仪器a中所加试剂应为
,为提高产率,仪器a中所加试剂应为_______ 。
(2)图乙是体系pH随时间变化关系图,写出制备CuCl反应的离子方程式_______ 。图丙是产率随pH变化关系图,实验过程中往往用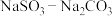 混合溶液代替
混合溶液代替 溶液,其中Na2CO3的作用是
溶液,其中Na2CO3的作用是_______ 。并维持pH在_______ 左右以保证较高产率。
(3)反应完成后经抽滤、洗涤、干燥获得产品。洗涤时,用“去氧水”作洗涤剂洗涤产品,作用是_______ 。
(4)实验室中也可以采用热分解法制备CuCl,装置如图所示:
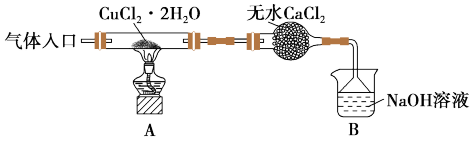
实验过程中,可将 加热至140℃生成无水
加热至140℃生成无水 ;再迅速加热至300℃以上分解获得CuCl。实验操作的先后顺序是a→
;再迅速加热至300℃以上分解获得CuCl。实验操作的先后顺序是a→_______ (填标号);通入 的目的是
的目的是_______ 。
a.检查装置的气密性后加入药品 b.点燃酒精灯,加热
c.熄灭酒精灯,冷却 d.在气体入口处通入干燥HCl
e.停止通入HCl,然后通入
 混合液与
混合液与 溶液反应制取CuCl。装置及相关数据如下:
溶液反应制取CuCl。装置及相关数据如下:
回答下列问题:
(1)仪器a的名称是
 过量会发生副反应生成
过量会发生副反应生成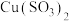 ,为提高产率,仪器a中所加试剂应为
,为提高产率,仪器a中所加试剂应为(2)图乙是体系pH随时间变化关系图,写出制备CuCl反应的离子方程式
 混合溶液代替
混合溶液代替 溶液,其中Na2CO3的作用是
溶液,其中Na2CO3的作用是
(3)反应完成后经抽滤、洗涤、干燥获得产品。洗涤时,用“去氧水”作洗涤剂洗涤产品,作用是
(4)实验室中也可以采用热分解法制备CuCl,装置如图所示:

实验过程中,可将
 加热至140℃生成无水
加热至140℃生成无水 ;再迅速加热至300℃以上分解获得CuCl。实验操作的先后顺序是a→
;再迅速加热至300℃以上分解获得CuCl。实验操作的先后顺序是a→ 的目的是
的目的是a.检查装置的气密性后加入药品 b.点燃酒精灯,加热
c.熄灭酒精灯,冷却 d.在气体入口处通入干燥HCl
e.停止通入HCl,然后通入

您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
【推荐1】重晶石(BaSO4)是重要的化工原料,用重晶石制备氢氧化钡晶体[Ba(OH)2·8H2O]的流程如下:
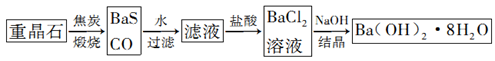
已知: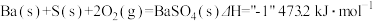
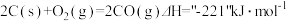
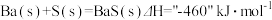
(1)写出煅烧时发生反应的热化学方程式:_______________ 。
(2)写出氢氧化钡晶体与氯化铵混合反应的化学方程式:__________________ 。
(3)为检测煅烧时产生的CO,可将煅烧产生的气体通入PbCl2溶液中,出现黑色沉淀并产生一种无色无味能使澄清石灰水变浑浊的气体,试写出该反应的化学方程式:__________________ 。
(4)向BaSO4沉淀中加入饱和Na2CO3溶液,充分搅拌,弃去上层清液,如此处理多次,可使BaSO4全部转化为BaCO3。发生的反应可表示为BaSO4(s)+ CO32-(aq) BaCO3(s)+ SO42- (aq)。现有0.20 mol BaSO4,加入1.0 L 2.0 mol·L-1饱和Na2CO3溶液处理,假设c(SO42-)起始≈0,平衡时,平衡常数K=4.0×10-2,求反应达到平衡时发生转化的BaSO4的物质的量。(不考虑溶液体积变化与离子水解,写出计算过程,结果保留2位有效数字)
BaCO3(s)+ SO42- (aq)。现有0.20 mol BaSO4,加入1.0 L 2.0 mol·L-1饱和Na2CO3溶液处理,假设c(SO42-)起始≈0,平衡时,平衡常数K=4.0×10-2,求反应达到平衡时发生转化的BaSO4的物质的量。(不考虑溶液体积变化与离子水解,写出计算过程,结果保留2位有效数字)
__________________
(5)试从平衡的角度解释BaSO4可转化为BaCO3的原因:_______________ 。

已知:
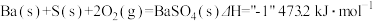
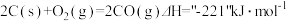
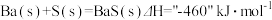
(1)写出煅烧时发生反应的热化学方程式:
(2)写出氢氧化钡晶体与氯化铵混合反应的化学方程式:
(3)为检测煅烧时产生的CO,可将煅烧产生的气体通入PbCl2溶液中,出现黑色沉淀并产生一种无色无味能使澄清石灰水变浑浊的气体,试写出该反应的化学方程式:
(4)向BaSO4沉淀中加入饱和Na2CO3溶液,充分搅拌,弃去上层清液,如此处理多次,可使BaSO4全部转化为BaCO3。发生的反应可表示为BaSO4(s)+ CO32-(aq)
 BaCO3(s)+ SO42- (aq)。现有0.20 mol BaSO4,加入1.0 L 2.0 mol·L-1饱和Na2CO3溶液处理,假设c(SO42-)起始≈0,平衡时,平衡常数K=4.0×10-2,求反应达到平衡时发生转化的BaSO4的物质的量。(不考虑溶液体积变化与离子水解,写出计算过程,结果保留2位有效数字)
BaCO3(s)+ SO42- (aq)。现有0.20 mol BaSO4,加入1.0 L 2.0 mol·L-1饱和Na2CO3溶液处理,假设c(SO42-)起始≈0,平衡时,平衡常数K=4.0×10-2,求反应达到平衡时发生转化的BaSO4的物质的量。(不考虑溶液体积变化与离子水解,写出计算过程,结果保留2位有效数字)(5)试从平衡的角度解释BaSO4可转化为BaCO3的原因:
您最近一年使用:0次
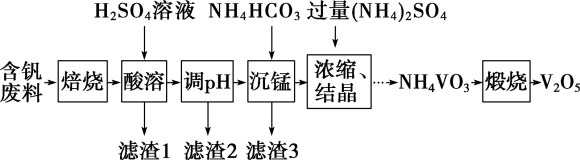
【推荐2】五氧化二钒(V2O5)为强氧化剂,易被还原成各种低价氧化物,在工业生产中常用作催化剂,即触媒。实验室以含钒废料(含V2O3、CuO、MnO、SiO2、Al2O3、有机物)为原料制备V2O5的一种流程如图:
已知Ⅰ.25℃时,难溶电解质的溶度积常数如表所示:
Ⅱ.NH4VO3在水中的溶解度:20℃、4.8 ;60℃、24.2
;60℃、24.2 。
。
回答下列问题:
(1)“焙烧”的目的是___________ 。
(2)“滤渣1”的用途为___________ (写出一种即可)。
(3)滤渣2成分为___________ 。通过列式计算说明,常温下,若“调pH”为6,Cu2+是否沉淀完全___________ 。(溶液中离子浓度小于
 时,认为该离子沉淀完全)
时,认为该离子沉淀完全)
(4)“沉锰”需将温度控制在70℃左右,温度不能过高或过低的原因为___________ 。
(5)滤渣3成分为MnCO3,请写出“沉锰”的离子方程式___________ 。
(6) V2O5最重要的应用是在接触法制硫酸时,作SO2氧化为SO3的催化剂。该催化反应中VO2为中间产物,请用化学方程式表示该催化过程:___________ 、___________ 。

已知Ⅰ.25℃时,难溶电解质的溶度积常数如表所示:
| 难溶电解质 |  |  |  |
| Ksp | 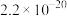 | 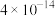 |  |
 ;60℃、24.2
;60℃、24.2 。
。回答下列问题:
(1)“焙烧”的目的是
(2)“滤渣1”的用途为
(3)滤渣2成分为

 时,认为该离子沉淀完全)
时,认为该离子沉淀完全)(4)“沉锰”需将温度控制在70℃左右,温度不能过高或过低的原因为
(5)滤渣3成分为MnCO3,请写出“沉锰”的离子方程式
(6) V2O5最重要的应用是在接触法制硫酸时,作SO2氧化为SO3的催化剂。该催化反应中VO2为中间产物,请用化学方程式表示该催化过程:
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐3】磷酸二氢钾(KH2PO4)是一种大型非线性光学晶体。以氯磷灰石(主要成分为Ca5(PO4)3Cl,还含有少量Al2O3、Fe2O3等杂质)为原料制备KH2PO4的一种工艺流程如图所示:

已知:①Ksp[Fe(OH)3]=1.0×10-38
②Ca3(PO4)2与CaHPO4均难溶于水,Ca(H2PO4)2易溶于水。
(1)“酸浸”时发生的化学反应为Ca5(PO4)3Cl+5H2SO4(浓)=5CaSO4+3H3PO4+HCl↑,该反应体现了浓硫酸的___________ 性和___________ 性。可提高酸浸反应速率的措施有___________ 。(写其中一条即可)
(2)滤渣的成分为___________ 和CaSO4,若c(离子)<1.0×10-5mol∙L-1时表明沉淀完全,计算Fe3+完全沉淀时的pH>___________ 。
(3)常温下磷酸的电离平衡常数Ka1=7.1×10-3、Ka2=6.3×10-8、Ka3=4.4×10-13,H2CO3的电离常数Ka1=4.3×10-7、Ka2=4.7×10-11,则常温下KH2PO4水溶液显___________ (填“酸性”“碱性”或“中性”),若将磷酸滴入碳酸钠溶液中,反应的离子方程式有错误的是___________ 。
A.H3PO4+ =
= +
+ B.2H3PO4+
B.2H3PO4+ =CO2↑+2
=CO2↑+2 +H2O
+H2O
C.H3PO4+2 =2
=2 +
+ D.H3PO4+3
D.H3PO4+3 =3
=3 +
+
(4)以熔融碳酸钠燃料电池(图1)为电源,KH2PO4可通过图2装置电解制备:


①燃料电池(图1)中电极A上H2参与的电极反应式为___________ 。
②电解池中若通电前a、b两室溶液的质量相等,若有2NA个K+通过交换膜,则两室溶液的质量差为___________ g。

已知:①Ksp[Fe(OH)3]=1.0×10-38
②Ca3(PO4)2与CaHPO4均难溶于水,Ca(H2PO4)2易溶于水。
(1)“酸浸”时发生的化学反应为Ca5(PO4)3Cl+5H2SO4(浓)=5CaSO4+3H3PO4+HCl↑,该反应体现了浓硫酸的
(2)滤渣的成分为
(3)常温下磷酸的电离平衡常数Ka1=7.1×10-3、Ka2=6.3×10-8、Ka3=4.4×10-13,H2CO3的电离常数Ka1=4.3×10-7、Ka2=4.7×10-11,则常温下KH2PO4水溶液显
A.H3PO4+
 =
= +
+ B.2H3PO4+
B.2H3PO4+ =CO2↑+2
=CO2↑+2 +H2O
+H2OC.H3PO4+2
 =2
=2 +
+ D.H3PO4+3
D.H3PO4+3 =3
=3 +
+
(4)以熔融碳酸钠燃料电池(图1)为电源,KH2PO4可通过图2装置电解制备:


①燃料电池(图1)中电极A上H2参与的电极反应式为
②电解池中若通电前a、b两室溶液的质量相等,若有2NA个K+通过交换膜,则两室溶液的质量差为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐1】2-噻吩乙醇(Mr=128)是抗血栓药物氯吡格雷的重要中间体,其制备方法如下:
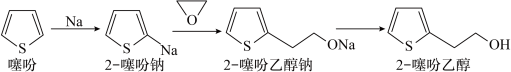
I.制钠砂。向烧瓶中加入300mL液体A和4.60g金属钠,加热至钠熔化后,盖紧塞子,振荡至大量微小钠珠出现。
Ⅱ.制噻吩钠。降温至10℃,加入25mL(ρ=1.07g/cm3)噻吩,反应至钠砂消失。
Ⅲ.制噻吩乙醇钠。降温至-10℃,加入稍过量的环氧乙烷的四氢呋喃溶液,反应30min。
Ⅳ.水解。恢复室温,加入70mL水,搅拌30min;加盐酸调pH至4~6,继续反应2h,分液;用水洗涤有机相,二次分液。
Ⅴ.分离。向有机相中加入无水MgSO4,静置,过滤,对滤液进行操作X,得到四氢呋喃、噻吩、液体A和15.36g产品。
回答下列问题:
(1)步骤I中液体A可以选择_______ 。
a.苯 b.水 c.乙醇 d.CCl4
(2)步骤Ⅱ的反应类型为_______ 。
(3)步骤Ⅲ中反应,加入的环氧乙烷稍过量的目的是_______ ;环氧乙烷溶于四氢呋喃的原理是_______ 。
(4)步骤Ⅳ中加入70mL水,搅拌30min此时水解的化学方程式是_______ 。
(5)在步骤Ⅴ中操作X是_______ ;需要用到的玻璃仪器有酒精灯、蒸馏烧瓶、_______ 、_______ 牛角管和锥形瓶
(6)产品的产率为_______ 。

I.制钠砂。向烧瓶中加入300mL液体A和4.60g金属钠,加热至钠熔化后,盖紧塞子,振荡至大量微小钠珠出现。
Ⅱ.制噻吩钠。降温至10℃,加入25mL(ρ=1.07g/cm3)噻吩,反应至钠砂消失。
Ⅲ.制噻吩乙醇钠。降温至-10℃,加入稍过量的环氧乙烷的四氢呋喃溶液,反应30min。
Ⅳ.水解。恢复室温,加入70mL水,搅拌30min;加盐酸调pH至4~6,继续反应2h,分液;用水洗涤有机相,二次分液。
Ⅴ.分离。向有机相中加入无水MgSO4,静置,过滤,对滤液进行操作X,得到四氢呋喃、噻吩、液体A和15.36g产品。
回答下列问题:
(1)步骤I中液体A可以选择
a.苯 b.水 c.乙醇 d.CCl4
(2)步骤Ⅱ的反应类型为
(3)步骤Ⅲ中反应,加入的环氧乙烷稍过量的目的是
(4)步骤Ⅳ中加入70mL水,搅拌30min此时水解的化学方程式是
(5)在步骤Ⅴ中操作X是
(6)产品的产率为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
【推荐2】NaClO2是一种重要的杀菌消毒剂,也常用来漂白织物等,其一种生产工艺如图:
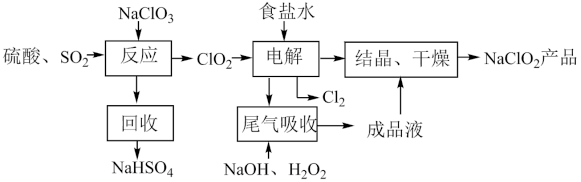
回答下列问题:
(1)NaClO2中Cl的化合价为___ ;电解产生的Cl2是___ 色,实验室制备氯气的化学方程式为:____ 。
(2)写出“反应”步骤中生成ClO2的化学方程式:___ 。
(3)“电解”所用食盐水由粗盐水精制而成,精制时,为除去Mg2+和Ca2+,要加入的试剂分别为___ 、___ 。

回答下列问题:
(1)NaClO2中Cl的化合价为
(2)写出“反应”步骤中生成ClO2的化学方程式:
(3)“电解”所用食盐水由粗盐水精制而成,精制时,为除去Mg2+和Ca2+,要加入的试剂分别为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐3】央视报道《王者归“铼”》:我国利用新技术发现并提纯了超级金属“铼”,其熔点高、耐磨、耐腐蚀,可用来制造航空发动机核心部件,有望打破美国垄断。工业上用富铼渣(含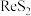 )制得铼粉,其工艺流程如下图所示:
)制得铼粉,其工艺流程如下图所示:
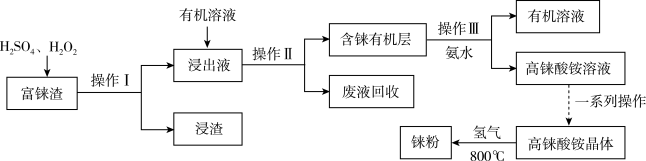
回答下列问题:
(1)操作Ⅰ的名称是_________ ,操作Ⅱ用到的玻璃仪器有烧杯、_________ 。
(2)铼不溶于盐酸,可溶于稀硝酸生成强酸高铼酸(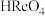 ),请写出反应的离子方程式
),请写出反应的离子方程式_________ 。
(3)高铼酸铵和氢气制取单质铼的化学方程式为_________ ;此反应过程中,实际消耗 的量大于理论值,其原因是
的量大于理论值,其原因是_________ 。
(4)由高铼酸铵溶液获得高铼酸铵晶体的一系列操作为_________ 、洗涤、干燥。
(5)整个工艺流程中除有机溶液可循环利用外,还有_________ 。
 )制得铼粉,其工艺流程如下图所示:
)制得铼粉,其工艺流程如下图所示:
回答下列问题:
(1)操作Ⅰ的名称是
(2)铼不溶于盐酸,可溶于稀硝酸生成强酸高铼酸(
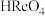 ),请写出反应的离子方程式
),请写出反应的离子方程式(3)高铼酸铵和氢气制取单质铼的化学方程式为
 的量大于理论值,其原因是
的量大于理论值,其原因是(4)由高铼酸铵溶液获得高铼酸铵晶体的一系列操作为
(5)整个工艺流程中除有机溶液可循环利用外,还有
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐1】某学生用已知物质的量浓度的硫酸来测定未知物质的量浓度的 溶液时,选择用酚酞作指示剂。请填空:
溶液时,选择用酚酞作指示剂。请填空:
(1)用标准的硫酸滴定待测的 溶液时,左手握酸式滴定管的活塞,右手摇动锥形瓶,眼睛
溶液时,左手握酸式滴定管的活塞,右手摇动锥形瓶,眼睛_______ 。
(2)某学生3次实验有关数据记录如表:
根据表中数据该 溶液的物质的量浓度为
溶液的物质的量浓度为_______  (保留四位有效数字)
(保留四位有效数字)
(3)该滴定终点实验现象为_______ 。
(4)以下操作会导致测得的 溶液浓度偏高的是_______
溶液浓度偏高的是_______
(5)氧化还原滴定实验的原理与中和滴定相似。水合肼( )作为一种化工原料,可合成发泡剂,现以
)作为一种化工原料,可合成发泡剂,现以 、
、 混合溶液制备水合肼,并测定其含量。
混合溶液制备水合肼,并测定其含量。
称取反应后的粗产品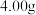 ,加水配成
,加水配成 溶液,取出
溶液,取出 ,用
,用 的
的 溶液滴定,发生反应的化学方程式为:
溶液滴定,发生反应的化学方程式为: ,实验测得消耗
,实验测得消耗 溶液的平均值为
溶液的平均值为 ,产品中水合肼的质量分数为
,产品中水合肼的质量分数为_______ 。(保留小数点后一位)
 溶液时,选择用酚酞作指示剂。请填空:
溶液时,选择用酚酞作指示剂。请填空:(1)用标准的硫酸滴定待测的
 溶液时,左手握酸式滴定管的活塞,右手摇动锥形瓶,眼睛
溶液时,左手握酸式滴定管的活塞,右手摇动锥形瓶,眼睛(2)某学生3次实验有关数据记录如表:
| 测定次数 | 待测 溶液的体积 溶液的体积 |  硫酸的体积 硫酸的体积 | |
| 滴定前刻度 | 滴定后刻度 | ||
| 第一次 | 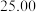 |  | 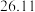 |
| 第二次 | 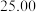 |  | 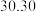 |
| 第三次 | 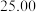 | 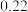 | 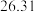 |
 溶液的物质的量浓度为
溶液的物质的量浓度为 (保留四位有效数字)
(保留四位有效数字)(3)该滴定终点实验现象为
(4)以下操作会导致测得的
 溶液浓度偏高的是_______
溶液浓度偏高的是_______| A.酸式滴定管未用标准液润洗 |
B.滴定前盛放 溶液的锥形瓶用蒸馏水洗净后没有干燥 溶液的锥形瓶用蒸馏水洗净后没有干燥 |
| C.量取碱液的碱式滴定管开始俯视读数,后来仰视读数 |
| D.碱式滴定管在取液前有气泡,之后气泡消失 |
 )作为一种化工原料,可合成发泡剂,现以
)作为一种化工原料,可合成发泡剂,现以 、
、 混合溶液制备水合肼,并测定其含量。
混合溶液制备水合肼,并测定其含量。称取反应后的粗产品
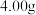 ,加水配成
,加水配成 溶液,取出
溶液,取出 ,用
,用 的
的 溶液滴定,发生反应的化学方程式为:
溶液滴定,发生反应的化学方程式为: ,实验测得消耗
,实验测得消耗 溶液的平均值为
溶液的平均值为 ,产品中水合肼的质量分数为
,产品中水合肼的质量分数为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐2】优氯净(二氯异氰尿酸钠)是一种适用范围广,高效的杀菌消毒剂。常温下为白色固体,难落于冷水。实验室常用高浓度的 溶液和
溶液和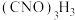 固体,在10℃时反应制备二氧异氰尿酸钠,实验装置如图所示(部分夹持装置略)。
固体,在10℃时反应制备二氧异氰尿酸钠,实验装置如图所示(部分夹持装置略)。
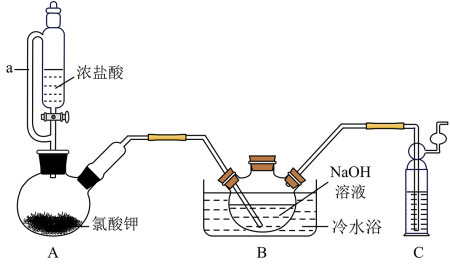
已知: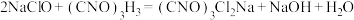
回答下列问题:
(1)装置A中发生的离子反应方程式为_______ 。
(2)待装置B中出现液面上方有黄绿色气体现象时,可由三颈烧瓶上口加入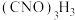 固体;反应过程中仍需不断通入
固体;反应过程中仍需不断通入 的理由是
的理由是_______ 。
(3)反应结束后,装置B中的浊液经_______ 、_______ 、干燥得粗产品。上述装置存在一处缺陷会导致装置B中NaOH利用率降低,改进的方法是_______ 。
(4)有效氯含量是判断产品质量的标准。实验检通过下列方法测定有效氯含量。原理为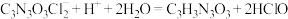 、
、 、
、 。准确称取1.1200g样品,配成250.0mL溶液;取25.00mL上述溶液于碘量瓶中,加入适量稀硫酸和过量KI溶液,密封在暗处静置5min;用
。准确称取1.1200g样品,配成250.0mL溶液;取25.00mL上述溶液于碘量瓶中,加入适量稀硫酸和过量KI溶液,密封在暗处静置5min;用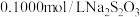 标准溶液滴定至溶液呈微黄色,加入淀粉指示剂继续滴定至终点,消耗
标准溶液滴定至溶液呈微黄色,加入淀粉指示剂继续滴定至终点,消耗 溶液20.00mL。
溶液20.00mL。
①该样品的有效氯为_______ (有效氯=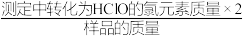 ×100%。(保留三位有效数字)
×100%。(保留三位有效数字)
②若在检测中加入稀硫酸的过少,将导致样品的有效氯测定值_______ (填“偏高”或“偏低”)。
 溶液和
溶液和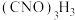 固体,在10℃时反应制备二氧异氰尿酸钠,实验装置如图所示(部分夹持装置略)。
固体,在10℃时反应制备二氧异氰尿酸钠,实验装置如图所示(部分夹持装置略)。
已知:
回答下列问题:
(1)装置A中发生的离子反应方程式为
(2)待装置B中出现液面上方有黄绿色气体现象时,可由三颈烧瓶上口加入
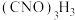 固体;反应过程中仍需不断通入
固体;反应过程中仍需不断通入 的理由是
的理由是(3)反应结束后,装置B中的浊液经
(4)有效氯含量是判断产品质量的标准。实验检通过下列方法测定有效氯含量。原理为
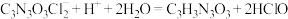 、
、 、
、 。准确称取1.1200g样品,配成250.0mL溶液;取25.00mL上述溶液于碘量瓶中,加入适量稀硫酸和过量KI溶液,密封在暗处静置5min;用
。准确称取1.1200g样品,配成250.0mL溶液;取25.00mL上述溶液于碘量瓶中,加入适量稀硫酸和过量KI溶液,密封在暗处静置5min;用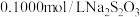 标准溶液滴定至溶液呈微黄色,加入淀粉指示剂继续滴定至终点,消耗
标准溶液滴定至溶液呈微黄色,加入淀粉指示剂继续滴定至终点,消耗 溶液20.00mL。
溶液20.00mL。①该样品的有效氯为
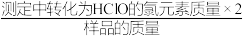 ×100%。(保留三位有效数字)
×100%。(保留三位有效数字)②若在检测中加入稀硫酸的过少,将导致样品的有效氯测定值
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐3】为测定草酸钴晶体(CoC2O4·2H2O)样品的纯度,某实验小组进行如下实验:
Ⅰ.取草酸钴晶体样品3.000 g,加稀H2SO4溶解,再加入100.00 mL 0.1000 mol/L酸性KMnO4溶液,充分反应至不再有CO2气体产生(常温下,草酸钴晶体难溶于水,该条件下Co2+不被氧化,杂质也不参与反应)。
Ⅱ.将溶液冷却,加水稀释定容至250 mL。
Ⅲ.取25.00 mL溶液,用0.1000 mol/L FeSO4标准溶液滴定。
Ⅳ.再重复步骤Ⅲ中的实验过程两次,三次的实验数据如表:
(1)步骤Ⅰ中加酸性KMnO4溶液时发生反应的离子方程式为______________ 。
(2)实验室使用的酸性KMnO4溶液一般是用________ 酸化(填酸的化学式)。
(3)步骤Ⅱ中,不会用到下列仪器中的_______ (填标号)。_______ (填“酸式”或“碱式”)滴定管;某次滴定中,开始时滴定管读数正确,结束时仰视,则所测草酸钴晶体样品的纯度会_______ (填“偏大”“偏小”或“不变”)﹔某次实验中所有实验操作和读数均无误,所测草酸钴晶体样品的纯度的误差却偏小,则可能的原因是___________ 。
(5)草酸钴晶体样品的纯度为______ %。
Ⅰ.取草酸钴晶体样品3.000 g,加稀H2SO4溶解,再加入100.00 mL 0.1000 mol/L酸性KMnO4溶液,充分反应至不再有CO2气体产生(常温下,草酸钴晶体难溶于水,该条件下Co2+不被氧化,杂质也不参与反应)。
Ⅱ.将溶液冷却,加水稀释定容至250 mL。
Ⅲ.取25.00 mL溶液,用0.1000 mol/L FeSO4标准溶液滴定。
Ⅳ.再重复步骤Ⅲ中的实验过程两次,三次的实验数据如表:
| 实验次数 | 第一次 | 第二次 | 第三次 |
| 消耗FeSO4溶液标准的体积/mL | 18.96 | 18.03 | 17.97 |
(1)步骤Ⅰ中加酸性KMnO4溶液时发生反应的离子方程式为
(2)实验室使用的酸性KMnO4溶液一般是用
(3)步骤Ⅱ中,不会用到下列仪器中的
a.  b.
b. 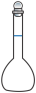 c.
c. 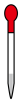 d.
d.
(5)草酸钴晶体样品的纯度为
您最近一年使用:0次






