名校
1 . 某种胃药的有效成分为碳酸钙,测定其中碳酸钙含量的操作如下(设该药片中的其他成分不与盐酸或氢氧化钠溶液反应):
①向一粒研碎后的药片(0.50g)中加入20.00mL蒸馏水;
②配制0.50mol/L的稀盐酸250mL和0.50mol/L的NaOH溶液250mL;
③用0.50mol/L的NaOH溶液中和过量的稀盐酸,记录所消耗的NaOH溶液的体积;
④加入25.00mL、0.50mol/L的稀盐酸。
请按要求回答下列问题:
(1)正确的操作顺序是___________ (填序号)。
(2)测定过程中发生反应的离子方程式为:___________ 、___________ 。
(3)该测定实验共进行了4次。4次测定所消耗的NaOH溶液的体积如下表:
①配制上述的稀盐酸时,需要选取的主要玻璃仪器有酸式滴定管(可量取液体体积精确到0.01mL的仪器)、烧杯、玻璃棒、___________ 。
②配制上述的NaOH溶液时,需要用托盘天平称取NaOH固体的质量是___________ 。
③下列操作会导致配制的盐酸浓度偏低的是___________ 。
A.未洗涤玻璃棒和烧杯
B.定容时俯视刻度线
C.洗涤后的容量瓶有残留的蒸馏水
D.摇匀后发现液面低于刻度线,再滴加水至刻度线
④根据相关实验数据,计算这种药片中碳酸钙的质量分数为___________ 。
①向一粒研碎后的药片(0.50g)中加入20.00mL蒸馏水;
②配制0.50mol/L的稀盐酸250mL和0.50mol/L的NaOH溶液250mL;
③用0.50mol/L的NaOH溶液中和过量的稀盐酸,记录所消耗的NaOH溶液的体积;
④加入25.00mL、0.50mol/L的稀盐酸。
请按要求回答下列问题:
(1)正确的操作顺序是
(2)测定过程中发生反应的离子方程式为:
(3)该测定实验共进行了4次。4次测定所消耗的NaOH溶液的体积如下表:
| 测定次数 | 第1次 | 第2次 | 第3次 | 第4次 |
| V[NaOH(aq)]/mL | 13.02 | 13.22 | 12.98 | 13.00 |
②配制上述的NaOH溶液时,需要用托盘天平称取NaOH固体的质量是
③下列操作会导致配制的盐酸浓度偏低的是
A.未洗涤玻璃棒和烧杯
B.定容时俯视刻度线
C.洗涤后的容量瓶有残留的蒸馏水
D.摇匀后发现液面低于刻度线,再滴加水至刻度线
④根据相关实验数据,计算这种药片中碳酸钙的质量分数为
您最近一年使用:0次
2 . “化肥也能爆炸”。阅读下面信息材料,回答相关问题。
硝酸铵可用作肥料;一定条件下会剧烈分解生成 、
、 和
和 ,从而发生爆炸因此也可用作军用炸药;易溶于水,且有明显吸热现象,又可作冷冻剂。工业上用
,从而发生爆炸因此也可用作军用炸药;易溶于水,且有明显吸热现象,又可作冷冻剂。工业上用 和
和 在中和器中完成硝酸铵的制备。
在中和器中完成硝酸铵的制备。
(1)上述材料涉及多种含氮的物质,其中有2种属于电解质的是___________ (填化学式)。
(2)根据上述材料写出工业制备硝酸铵的化学方程式___________ ,该反应___________ (填“是”或“否”)属于氧化还原反应。
(3)上述硝酸铵爆炸发生的反应为 ,该反应中被氧化和被还原的N原子数之比为
,该反应中被氧化和被还原的N原子数之比为___________ ,氧化产物为___________ 。
(4)某化学小组需要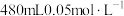 的
的 溶液作为盆栽植物营养液。
溶液作为盆栽植物营养液。
①配制溶液时,现有天平、药匙、烧杯、量筒、玻璃棒,还需要的仪器有___________ 和___________ 。
②根据计算需用天平称取___________ g硝酸铵固体。
③若溶解硝酸铵固体时未待溶液恢复室温就立刻转移到容量瓶进行定容,会导致配制 溶液的浓度
溶液的浓度___________ (填“偏低”、“偏高”或“无影响”)。
硝酸铵可用作肥料;一定条件下会剧烈分解生成
 、
、 和
和 ,从而发生爆炸因此也可用作军用炸药;易溶于水,且有明显吸热现象,又可作冷冻剂。工业上用
,从而发生爆炸因此也可用作军用炸药;易溶于水,且有明显吸热现象,又可作冷冻剂。工业上用 和
和 在中和器中完成硝酸铵的制备。
在中和器中完成硝酸铵的制备。(1)上述材料涉及多种含氮的物质,其中有2种属于电解质的是
(2)根据上述材料写出工业制备硝酸铵的化学方程式
(3)上述硝酸铵爆炸发生的反应为
 ,该反应中被氧化和被还原的N原子数之比为
,该反应中被氧化和被还原的N原子数之比为(4)某化学小组需要
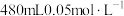 的
的 溶液作为盆栽植物营养液。
溶液作为盆栽植物营养液。①配制溶液时,现有天平、药匙、烧杯、量筒、玻璃棒,还需要的仪器有
②根据计算需用天平称取
③若溶解硝酸铵固体时未待溶液恢复室温就立刻转移到容量瓶进行定容,会导致配制
 溶液的浓度
溶液的浓度
您最近一年使用:0次
名校
3 . 某实验需要用1.0 mol·L-1 NaOH溶液450 mL。
(1)配制该溶液的实验操作步骤有:
a.在托盘天平上称量___________ g NaOH固体放入烧杯中,加适量蒸馏水溶解,冷却至室温。
b.把烧杯中的溶液小心地注入___________ 中。
c.将蒸馏水注入容量瓶,液面离容量瓶颈刻度线下1~2 cm处,改用___________ 加蒸馏水至液面与刻度线相切。
d.用少量蒸馏水洗涤烧杯内壁和玻璃棒2~3次,并将洗涤液转入容量瓶中。轻轻摇动容量瓶,使溶液混合均匀。
e.将瓶塞塞紧,充分摇匀。
(2)操作步骤的正确顺序为___________ 。
(3)该配制过程中两次用到玻璃棒,其作用分别是___________ 、___________ 。
(4)在进行b步操作时,不慎有液体溅出,下列处理措施正确的是___________(填序号)。
(5)现有硫酸和硫酸钠溶液200 mL,其中硫酸的浓度是1 mol·L-1,硫酸钠的浓度是0.5 mol·L-1.要使硫酸和硫酸钠的浓度分别为2 mol·L-1和0.2 mol·L-1,应加入98%的硫酸(密度为1.84 g·cm-3)的体积是___________ ,再加入水配制后溶液的体积是___________ 。
(1)配制该溶液的实验操作步骤有:
a.在托盘天平上称量
b.把烧杯中的溶液小心地注入
c.将蒸馏水注入容量瓶,液面离容量瓶颈刻度线下1~2 cm处,改用
d.用少量蒸馏水洗涤烧杯内壁和玻璃棒2~3次,并将洗涤液转入容量瓶中。轻轻摇动容量瓶,使溶液混合均匀。
e.将瓶塞塞紧,充分摇匀。
(2)操作步骤的正确顺序为
(3)该配制过程中两次用到玻璃棒,其作用分别是
(4)在进行b步操作时,不慎有液体溅出,下列处理措施正确的是___________(填序号)。
| A.继续进行实验 |
| B.添加部分NaOH溶液 |
| C.倒掉溶液,重新配制 |
| D.倒掉溶液,洗净容量瓶后重新配制 |
您最近一年使用:0次
22-23高二上·河南鹤壁·期末
解题方法
4 . 某实验小组用0.50 NaOH溶液和0.50
NaOH溶液和0.50 硫酸溶液进行中和热的测定。
硫酸溶液进行中和热的测定。
(一)配制0.50 NaOH溶液。
NaOH溶液。
(1)若实验中大约要使用245mLNaOH溶液,至少需要称量NaOH固体_______ g。
(2)从下图中选择称量NaOH固体所需要的仪器_______ (填字母)。
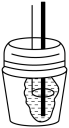
(二)测定稀硫酸和稀氢氧化钠反应的中和热的实验装置如图所示。
(3)写出该反应的热化学方程式(中和热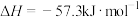 ):
):_______ 。
(4)取50mLNaOH溶液和30mL硫酸溶液进行实验,实验数据如下表。
①请填写表中的空白:
②近似认为0.50 NaOH溶液和0.50
NaOH溶液和0.50 硫酸溶液的密度都是1
硫酸溶液的密度都是1 ,中和后生成溶液的比热容
,中和后生成溶液的比热容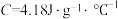 。则测得中和热
。则测得中和热 =
=_______  (取小数点后一位)。
(取小数点后一位)。
③上述实验数值结果与57.3 有偏差,产生偏差的原因可能是
有偏差,产生偏差的原因可能是_______ (填字母)。
A.实验装置保温、隔热效果差
B.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
C.用温度计测定NaOH溶液起始温度后直接测定 溶液的温度
溶液的温度
 NaOH溶液和0.50
NaOH溶液和0.50 硫酸溶液进行中和热的测定。
硫酸溶液进行中和热的测定。(一)配制0.50
 NaOH溶液。
NaOH溶液。(1)若实验中大约要使用245mLNaOH溶液,至少需要称量NaOH固体
(2)从下图中选择称量NaOH固体所需要的仪器
| 序号 | a | b | c | d | e | f |
| 仪器 | 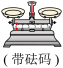 |  |  |  |  |  |
(二)测定稀硫酸和稀氢氧化钠反应的中和热的实验装置如图所示。

(3)写出该反应的热化学方程式(中和热
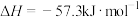 ):
):(4)取50mLNaOH溶液和30mL硫酸溶液进行实验,实验数据如下表。
①请填写表中的空白:
| 实验次数 | 起始温度 /℃ /℃ | 终止温度 /℃ /℃ | 温度差平均值 (  - - )/℃ )/℃ | ||
 | NaOH | 平均值 | |||
| 1 | 26.2 | 26.0 | 26.1 | 30.1 | |
| 2 | 27.0 | 27.4 | 27.2 | 33.3 | |
| 3 | 25.9 | 25.9 | 25.9 | 29.8 | |
| 4 | 26.4 | 26.2 | 26.3 | 30.4 | |
 NaOH溶液和0.50
NaOH溶液和0.50 硫酸溶液的密度都是1
硫酸溶液的密度都是1 ,中和后生成溶液的比热容
,中和后生成溶液的比热容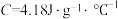 。则测得中和热
。则测得中和热 =
= (取小数点后一位)。
(取小数点后一位)。③上述实验数值结果与57.3
 有偏差,产生偏差的原因可能是
有偏差,产生偏差的原因可能是A.实验装置保温、隔热效果差
B.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
C.用温度计测定NaOH溶液起始温度后直接测定
 溶液的温度
溶液的温度
您最近一年使用:0次
2022-12-31更新
|
209次组卷
|
3卷引用:2023年广东卷高考真题变式题(实验题)
解题方法
5 . 碘化钾常用作合成有机化合物的原料。某实验小组设计实验探究KI的还原性。
I.配制KI溶液
(1)配制500mL 的KI溶液,需要称取KI的质量为
的KI溶液,需要称取KI的质量为___________ g。
(2)下列关于配制KI溶液的操作错误的是___________(填序号)。
II.探究不同条件下空气中氧气氧化KI的速率。
(3)酸性条件下KI能被空气中氧气氧化,发生反应的离子方程式为___________ 。
(4)通过实验组别1和组别2探究温度对氧化速率的影响。其中a=___________ ,b=___________ 。
(5)设计实验组别3的目的是___________ 。
III.探究反应“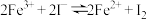 ”为可逆反应。
”为可逆反应。
试剂: KI溶液,
KI溶液,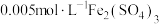 溶液,淀粉溶液,
溶液,淀粉溶液,
 溶液,KSCN溶液。实验如下:
溶液,KSCN溶液。实验如下:
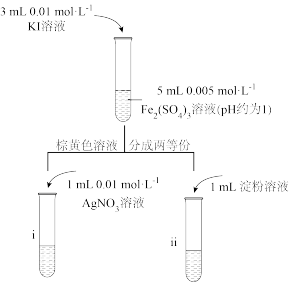
(6)甲同学通过试管i和试管ii中现象结合可证明该反应为可逆反应,则试管i中现象为___________ ;乙同学认为该现象无法证明该反应为可逆反应,原因为___________ 。
(7)请选择上述试剂重新设计实验,证明该反应为可逆反应:___________ 。
I.配制KI溶液
(1)配制500mL
 的KI溶液,需要称取KI的质量为
的KI溶液,需要称取KI的质量为(2)下列关于配制KI溶液的操作错误的是___________(填序号)。
A. | B. | C. | D. |
II.探究不同条件下空气中氧气氧化KI的速率。
| 组别 | 温度 | KI溶液 |  溶液 溶液 | 蒸馏水 | 淀粉溶液 | ||
| c(KI) | V | 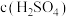 | V | ||||
| 1 | 298K |  | 5mL |  | 5mL | 10mL | 3滴 |
| 2 | 313K |  |  mL mL | 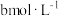 | 5mL | 10mL | 3滴 |
| 3 | 298K |  | 10mL |  | 5mL | 5mL | 3滴 |
(4)通过实验组别1和组别2探究温度对氧化速率的影响。其中a=
(5)设计实验组别3的目的是
III.探究反应“
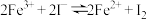 ”为可逆反应。
”为可逆反应。试剂:
 KI溶液,
KI溶液,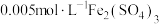 溶液,淀粉溶液,
溶液,淀粉溶液,
 溶液,KSCN溶液。实验如下:
溶液,KSCN溶液。实验如下:
(6)甲同学通过试管i和试管ii中现象结合可证明该反应为可逆反应,则试管i中现象为
(7)请选择上述试剂重新设计实验,证明该反应为可逆反应:
您最近一年使用:0次
2022-08-28更新
|
1042次组卷
|
3卷引用:广东省深圳市光明区2023届高三上学期第一次模拟考试化学试题
广东省深圳市光明区2023届高三上学期第一次模拟考试化学试题(已下线)回归教材重难点11 熟记“五气体”制备实验、“两定量”测定实验-【查漏补缺】2023年高考化学三轮冲刺过关(新高考专用)陕西省西安市周至县第六中学2023-2024学年高三上学期11月期中化学试题
名校
解题方法
6 . 硫铁矿(主要成分为FeS2)是重要的矿产资源,以硫铁矿为原料制备氯化铁晶体(FeCl3∙6H2O)和亚硫酸钠和亚硫酸氢钠的工艺流程如下:
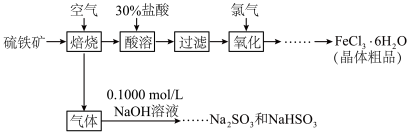
(1)已知: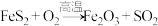 ,请写出配平的反应方程式
,请写出配平的反应方程式____
(2)通氯气氧化的目的是____ ;
(3)气体的主要成分是 ,实验室中可用
,实验室中可用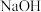 溶液回收将
溶液回收将 气体通入到
气体通入到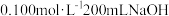 溶液中,溶液中含硫元素的离子的物质的量与
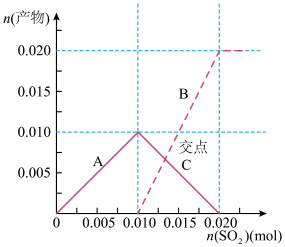
溶液中,溶液中含硫元素的离子的物质的量与 的通入量的关系如图:实线A是
的通入量的关系如图:实线A是__ 的变化曲线,虚线B是___ 的变化曲线(填离子符号)交点C处发生反应的离子方程式为___ 。
(4)实验室用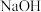 固体配制240mL0.100mol∙L-1的
固体配制240mL0.100mol∙L-1的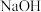 溶液,需要的仪器有
溶液,需要的仪器有___ 、烧杯、玻璃棒、天平。
(5)下列配制的溶液浓度偏高的是___ ;
A.称量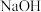 时,称量时间较长
时,称量时间较长
B.配制前,容量瓶中有少量蒸馏水
C.配制时,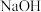 未冷却直接定容
未冷却直接定容
D.向容量瓶中转移溶液时不慎有液滴洒在容量瓶外面
E.定容时俯视刻度线F.加蒸馏水时不慎相过了刻度线

(1)已知:
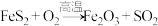 ,请写出配平的反应方程式
,请写出配平的反应方程式(2)通氯气氧化的目的是
(3)气体的主要成分是
 ,实验室中可用
,实验室中可用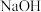 溶液回收将
溶液回收将 气体通入到
气体通入到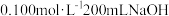 溶液中,溶液中含硫元素的离子的物质的量与
溶液中,溶液中含硫元素的离子的物质的量与 的通入量的关系如图:实线A是
的通入量的关系如图:实线A是
(4)实验室用
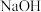 固体配制240mL0.100mol∙L-1的
固体配制240mL0.100mol∙L-1的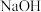 溶液,需要的仪器有
溶液,需要的仪器有(5)下列配制的溶液浓度偏高的是
A.称量
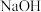 时,称量时间较长
时,称量时间较长B.配制前,容量瓶中有少量蒸馏水
C.配制时,
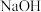 未冷却直接定容
未冷却直接定容D.向容量瓶中转移溶液时不慎有液滴洒在容量瓶外面
E.定容时俯视刻度线F.加蒸馏水时不慎相过了刻度线
您最近一年使用:0次
2021-03-26更新
|
312次组卷
|
2卷引用:广东省清远市凤霞中学2020-2021学年高一下学期期中质量检测化学试题



