名校
1 . 某种胃药的有效成分为碳酸钙,测定其中碳酸钙含量的操作如下(设该药片中的其他成分不与盐酸或氢氧化钠溶液反应):
①向一粒研碎后的药片(0.50g)中加入20.00mL蒸馏水;
②配制0.50mol/L的稀盐酸250mL和0.50mol/L的NaOH溶液250mL;
③用0.50mol/L的NaOH溶液中和过量的稀盐酸,记录所消耗的NaOH溶液的体积;
④加入25.00mL、0.50mol/L的稀盐酸。
请按要求回答下列问题:
(1)正确的操作顺序是___________ (填序号)。
(2)测定过程中发生反应的离子方程式为:___________ 、___________ 。
(3)该测定实验共进行了4次。4次测定所消耗的NaOH溶液的体积如下表:
①配制上述的稀盐酸时,需要选取的主要玻璃仪器有酸式滴定管(可量取液体体积精确到0.01mL的仪器)、烧杯、玻璃棒、___________ 。
②配制上述的NaOH溶液时,需要用托盘天平称取NaOH固体的质量是___________ 。
③下列操作会导致配制的盐酸浓度偏低的是___________ 。
A.未洗涤玻璃棒和烧杯
B.定容时俯视刻度线
C.洗涤后的容量瓶有残留的蒸馏水
D.摇匀后发现液面低于刻度线,再滴加水至刻度线
④根据相关实验数据,计算这种药片中碳酸钙的质量分数为___________ 。
①向一粒研碎后的药片(0.50g)中加入20.00mL蒸馏水;
②配制0.50mol/L的稀盐酸250mL和0.50mol/L的NaOH溶液250mL;
③用0.50mol/L的NaOH溶液中和过量的稀盐酸,记录所消耗的NaOH溶液的体积;
④加入25.00mL、0.50mol/L的稀盐酸。
请按要求回答下列问题:
(1)正确的操作顺序是
(2)测定过程中发生反应的离子方程式为:
(3)该测定实验共进行了4次。4次测定所消耗的NaOH溶液的体积如下表:
| 测定次数 | 第1次 | 第2次 | 第3次 | 第4次 |
| V[NaOH(aq)]/mL | 13.02 | 13.22 | 12.98 | 13.00 |
②配制上述的NaOH溶液时,需要用托盘天平称取NaOH固体的质量是
③下列操作会导致配制的盐酸浓度偏低的是
A.未洗涤玻璃棒和烧杯
B.定容时俯视刻度线
C.洗涤后的容量瓶有残留的蒸馏水
D.摇匀后发现液面低于刻度线,再滴加水至刻度线
④根据相关实验数据,计算这种药片中碳酸钙的质量分数为
您最近一年使用:0次
名校
2 . 某家用防疫用品“84”消毒液的包装说明如下:
该小组同学进行了如下实验,回答下列问题:
(1)用“84消毒液”原液配制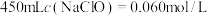 的溶液。
的溶液。
①配置过程中,需要用到的玻璃仪器有烧杯、玻璃棒、胶头滴管、量筒、___________ 。
②稀释时,需要取用___________ mL“84消毒液”原液。
③配制过程中的正确操作顺序是:b、d、___________ 、e(填“字母”)。
a.用少量蒸馏水洗涤烧杯和玻璃棒2~3次,洗涤液均注入容量瓶。
b.用量筒量取所需体积的“84消毒液”原液注入盛有约50mL蒸馏水的烧杯。
c.用胶头滴管滴加蒸馏水,至溶液的凹液面与刻度线相切。
d.用玻璃棒慢慢搅动,混合均匀。
e.盖好容量瓶瓶塞,反复上下颠倒,摇匀。
f.将稀释后的“84消毒液”沿玻璃棒注入一定容积的容量瓶。
g。往容量瓶中加入蒸馏水,直到液面在容量瓶刻度线下1~2cm处。
④下列操作会使溶液中NaClO浓度偏高的是___________ 。
A.取用的“84消毒液”原液是久置的
B.量取“84消毒液”原液时,仰视读数
C.定容操作时,俯视刻度线
D.定容后摇匀后,液面低于刻度线,再加水至刻度线
(2)利用如图装置探究“84消毒液”(主要成分是NaClO)与“洁厕灵”(主要成分是稀盐酸)的反应,当注射器中的洁厕灵注入试管中时,可观察到湿润淀粉KI试纸变蓝,则湿润pH试纸的现象是___________ ,棉花团(蘸有某溶液)的其作用是___________ 。

(3)一段时间后,有同学观察到湿润淀粉KI上的蓝色褪去,可能的原因是___________ 。
(4)资料查得:“84消毒液”(主要成分是NaClO)与双氧水混合会反应产生一种常见的无色无味气体,且消毒能力大大降低,写出该反应的离子方程式___________ 。
| 【产品名称】84消毒液 【有效成分】NaClO 【规格】1000mL 【浓度】 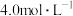 注意:①按一定比例稀释后作用 ②不得与酸性产品(如洁厕灵)同时使用 |
(1)用“84消毒液”原液配制
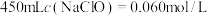 的溶液。
的溶液。①配置过程中,需要用到的玻璃仪器有烧杯、玻璃棒、胶头滴管、量筒、
②稀释时,需要取用
③配制过程中的正确操作顺序是:b、d、
a.用少量蒸馏水洗涤烧杯和玻璃棒2~3次,洗涤液均注入容量瓶。
b.用量筒量取所需体积的“84消毒液”原液注入盛有约50mL蒸馏水的烧杯。
c.用胶头滴管滴加蒸馏水,至溶液的凹液面与刻度线相切。
d.用玻璃棒慢慢搅动,混合均匀。
e.盖好容量瓶瓶塞,反复上下颠倒,摇匀。
f.将稀释后的“84消毒液”沿玻璃棒注入一定容积的容量瓶。
g。往容量瓶中加入蒸馏水,直到液面在容量瓶刻度线下1~2cm处。
④下列操作会使溶液中NaClO浓度偏高的是
A.取用的“84消毒液”原液是久置的
B.量取“84消毒液”原液时,仰视读数
C.定容操作时,俯视刻度线
D.定容后摇匀后,液面低于刻度线,再加水至刻度线
(2)利用如图装置探究“84消毒液”(主要成分是NaClO)与“洁厕灵”(主要成分是稀盐酸)的反应,当注射器中的洁厕灵注入试管中时,可观察到湿润淀粉KI试纸变蓝,则湿润pH试纸的现象是

(3)一段时间后,有同学观察到湿润淀粉KI上的蓝色褪去,可能的原因是
(4)资料查得:“84消毒液”(主要成分是NaClO)与双氧水混合会反应产生一种常见的无色无味气体,且消毒能力大大降低,写出该反应的离子方程式
您最近一年使用:0次
名校
3 . 某实验需要用1.0 mol·L-1 NaOH溶液450 mL。
(1)配制该溶液的实验操作步骤有:
a.在托盘天平上称量___________ g NaOH固体放入烧杯中,加适量蒸馏水溶解,冷却至室温。
b.把烧杯中的溶液小心地注入___________ 中。
c.将蒸馏水注入容量瓶,液面离容量瓶颈刻度线下1~2 cm处,改用___________ 加蒸馏水至液面与刻度线相切。
d.用少量蒸馏水洗涤烧杯内壁和玻璃棒2~3次,并将洗涤液转入容量瓶中。轻轻摇动容量瓶,使溶液混合均匀。
e.将瓶塞塞紧,充分摇匀。
(2)操作步骤的正确顺序为___________ 。
(3)该配制过程中两次用到玻璃棒,其作用分别是___________ 、___________ 。
(4)在进行b步操作时,不慎有液体溅出,下列处理措施正确的是___________(填序号)。
(5)现有硫酸和硫酸钠溶液200 mL,其中硫酸的浓度是1 mol·L-1,硫酸钠的浓度是0.5 mol·L-1.要使硫酸和硫酸钠的浓度分别为2 mol·L-1和0.2 mol·L-1,应加入98%的硫酸(密度为1.84 g·cm-3)的体积是___________ ,再加入水配制后溶液的体积是___________ 。
(1)配制该溶液的实验操作步骤有:
a.在托盘天平上称量
b.把烧杯中的溶液小心地注入
c.将蒸馏水注入容量瓶,液面离容量瓶颈刻度线下1~2 cm处,改用
d.用少量蒸馏水洗涤烧杯内壁和玻璃棒2~3次,并将洗涤液转入容量瓶中。轻轻摇动容量瓶,使溶液混合均匀。
e.将瓶塞塞紧,充分摇匀。
(2)操作步骤的正确顺序为
(3)该配制过程中两次用到玻璃棒,其作用分别是
(4)在进行b步操作时,不慎有液体溅出,下列处理措施正确的是___________(填序号)。
| A.继续进行实验 |
| B.添加部分NaOH溶液 |
| C.倒掉溶液,重新配制 |
| D.倒掉溶液,洗净容量瓶后重新配制 |
您最近一年使用:0次
名校
解题方法
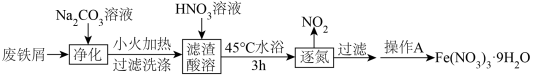
4 . 智能手机因其集成的高清摄像头和智能传感器而常被应用于化学实验。某实验小组利用实验室中的废铁屑(久置但未生锈)制备硝酸铁,并利用配制的硝酸铁标准溶液对“硫酸亚铁补铁剂”中铁元素的含量进行测定。
已知: 溶液有强氧化性,浓度越大,氧化性越强。
溶液有强氧化性,浓度越大,氧化性越强。
实验过程如下:
实验I: 的制备
的制备
(1)实验室中保存 溶液时,往往加入少许
溶液时,往往加入少许_______ ,目的是_______ 。请简述验证 溶液被部分氧化的实验过程和现象
溶液被部分氧化的实验过程和现象_______ 。
(2)经推测,逐氮过程中的 气体,是
气体,是 发生了分解,写出该反应的化学方程式:
发生了分解,写出该反应的化学方程式:_______ 。
(3)操作A包含的实验步骤有:_______ 、_______ 、过滤、洗涤、干燥。
实验Ⅱ:标准硝酸铁溶液的配制
准确称取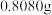 的
的 按如图步骤配成
按如图步骤配成 溶液。
溶液。
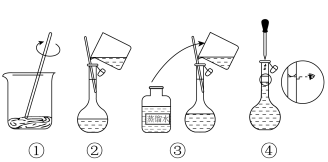
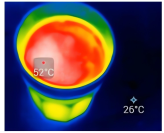
(4)智能手机连接热成像配件FLIROnePro可即时测定过程①中溶液温度。若将如图溶解所得溶液立即转移至容量瓶中并进行定容,则上述操作会导致配得溶液浓度_______ (填“偏高”、“偏低”或“无影响”)。
实验Ⅲ:绘制标准 溶液与灰度值的标准曲线
溶液与灰度值的标准曲线
①分别向7个 容量瓶中加入0、0.5、1.0、2.0、3.0、4.0、5.0
容量瓶中加入0、0.5、1.0、2.0、3.0、4.0、5.0 实验Ⅱ中标定的浓度为
实验Ⅱ中标定的浓度为 的
的 标准溶液,然后分别加入
标准溶液,然后分别加入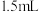 某浓度
某浓度 溶液,用蒸馏水定容。
溶液,用蒸馏水定容。
②将配好的溶液加入到 比色皿中,如图进行放置,在相同条件下用智能手机进行拍照,后用软件确定照片中各溶液相同位置的灰度数值,所得数据如下表所示:
比色皿中,如图进行放置,在相同条件下用智能手机进行拍照,后用软件确定照片中各溶液相同位置的灰度数值,所得数据如下表所示:

(5)上述实验中,根据合理数据处理得
_______ (保留1位有效数字)。
实验V:“硫酸亚铁补铁剂中铁元素含量的测定
①取补铁剂样品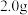 ,加入
,加入 蒸馏水完全溶解,再加入足量
蒸馏水完全溶解,再加入足量 溶液,充分反应后配成
溶液,充分反应后配成 溶液。
溶液。
②取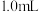 ①中所配溶液于
①中所配溶液于 容量瓶中,加入
容量瓶中,加入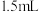 某浓度
某浓度 溶液,用蒸馏水定容。
溶液,用蒸馏水定容。
将最终配好的溶液加入到 比色皿中,在与实验Ⅲ步骤②冲相同条件下拍照,软件处理获得溶液图片的灰度值为97.32。
比色皿中,在与实验Ⅲ步骤②冲相同条件下拍照,软件处理获得溶液图片的灰度值为97.32。
(6)“硫酸亚铁补铁剂”中铁元素的质量分数为_______  (保留2位有效数字)。
(保留2位有效数字)。
(7)下列操作中有利于更准确测得“硫酸亚铁补铁剂中的铁元素含量的有_______。
已知:
 溶液有强氧化性,浓度越大,氧化性越强。
溶液有强氧化性,浓度越大,氧化性越强。实验过程如下:
实验I:
 的制备
的制备
(1)实验室中保存
 溶液时,往往加入少许
溶液时,往往加入少许 溶液被部分氧化的实验过程和现象
溶液被部分氧化的实验过程和现象(2)经推测,逐氮过程中的
 气体,是
气体,是 发生了分解,写出该反应的化学方程式:
发生了分解,写出该反应的化学方程式:(3)操作A包含的实验步骤有:
实验Ⅱ:标准硝酸铁溶液的配制
准确称取
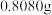 的
的 按如图步骤配成
按如图步骤配成 溶液。
溶液。
(4)智能手机连接热成像配件FLIROnePro可即时测定过程①中溶液温度。若将如图溶解所得溶液立即转移至容量瓶中并进行定容,则上述操作会导致配得溶液浓度

实验Ⅲ:绘制标准
 溶液与灰度值的标准曲线
溶液与灰度值的标准曲线①分别向7个
 容量瓶中加入0、0.5、1.0、2.0、3.0、4.0、5.0
容量瓶中加入0、0.5、1.0、2.0、3.0、4.0、5.0 实验Ⅱ中标定的浓度为
实验Ⅱ中标定的浓度为 的
的 标准溶液,然后分别加入
标准溶液,然后分别加入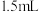 某浓度
某浓度 溶液,用蒸馏水定容。
溶液,用蒸馏水定容。②将配好的溶液加入到
 比色皿中,如图进行放置,在相同条件下用智能手机进行拍照,后用软件确定照片中各溶液相同位置的灰度数值,所得数据如下表所示:
比色皿中,如图进行放置,在相同条件下用智能手机进行拍照,后用软件确定照片中各溶液相同位置的灰度数值,所得数据如下表所示:| 比色管编号 | S0 | S1 | S2 | S3 | S4 | S5 | S6 |
 溶液( 溶液( ) ) | 0 | 0.5 | 1.0 | 2.0 | 3.0 | 4.0 | 5.0 |
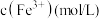 | 0 | 0.0001 | 0.0002 | 0.0004 | 0.0006 | 0.0008 | 0.001 |
| 灰度值 | 127.3 | 119.4 | 107.1 | 87.3 | 65.3 | 47.2 | 29.2 |

(5)上述实验中,根据合理数据处理得

实验V:“硫酸亚铁补铁剂中铁元素含量的测定
①取补铁剂样品
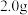 ,加入
,加入 蒸馏水完全溶解,再加入足量
蒸馏水完全溶解,再加入足量 溶液,充分反应后配成
溶液,充分反应后配成 溶液。
溶液。②取
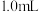 ①中所配溶液于
①中所配溶液于 容量瓶中,加入
容量瓶中,加入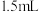 某浓度
某浓度 溶液,用蒸馏水定容。
溶液,用蒸馏水定容。将最终配好的溶液加入到
 比色皿中,在与实验Ⅲ步骤②冲相同条件下拍照,软件处理获得溶液图片的灰度值为97.32。
比色皿中,在与实验Ⅲ步骤②冲相同条件下拍照,软件处理获得溶液图片的灰度值为97.32。(6)“硫酸亚铁补铁剂”中铁元素的质量分数为
 (保留2位有效数字)。
(保留2位有效数字)。(7)下列操作中有利于更准确测得“硫酸亚铁补铁剂中的铁元素含量的有_______。
A.提前除去实验I溶解铁屑所用硝酸中的 杂质 杂质 |
B.用浓硝酸溶液代替实验Ⅳ中所用的 溶液 溶液 |
C.整个实验中所用的 溶液均采用相同浓度的溶液 溶液均采用相同浓度的溶液 |
| D.将配制的样品溶液和7个标准溶液放在一起在相同条件下同时拍照,再统一进行数据处理 |
您最近一年使用:0次
5 . 电解质在人体内的作用是十分重要的,当电解质紊乱时人体就会出现一系列不适症状,甚至危及生命。 固体④漂白粉粉末 ⑤熔融的
固体④漂白粉粉末 ⑤熔融的 ⑥
⑥ 溶液
溶液
(1)上述物质中,属于电解质的是___________ (填序号,下同),能导电的是___________ 。
(2)16.8g由 和
和 组成的混合物与200g质量分数为7.3%的盐酸恰好反应,蒸干反应后的溶液,最终得到的固体质量为___________(填字母序号)。
组成的混合物与200g质量分数为7.3%的盐酸恰好反应,蒸干反应后的溶液,最终得到的固体质量为___________(填字母序号)。
(3)将①投入⑥的溶液中产生气泡,写出离子方程式___________ 。
Ⅱ.完成下列问题
(4)配制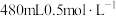 的
的 溶液。
溶液。
①配制时,用托盘天平称取 固体的质量为
固体的质量为___________ g
②其操作步骤如下图所示:___________ (填序号)操作之间。___________ (填字母序号)。
a.定容时俯视刻度线
b.溶解时,烧杯中有少量蒸馏水
c.加水时不慎超过了刻度线,立即用胶头滴管吸出
(5)从配制好的 溶液中取出10mL,加蒸馏水将其稀释至100mL,稀释后溶液中
溶液中取出10mL,加蒸馏水将其稀释至100mL,稀释后溶液中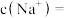
___________  。
。
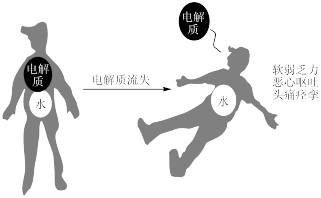
 固体④漂白粉粉末 ⑤熔融的
固体④漂白粉粉末 ⑤熔融的 ⑥
⑥ 溶液
溶液(1)上述物质中,属于电解质的是
(2)16.8g由
 和
和 组成的混合物与200g质量分数为7.3%的盐酸恰好反应,蒸干反应后的溶液,最终得到的固体质量为___________(填字母序号)。
组成的混合物与200g质量分数为7.3%的盐酸恰好反应,蒸干反应后的溶液,最终得到的固体质量为___________(填字母序号)。| A.8g | B.15.5g | C.11.7g | D.23.4g |
(3)将①投入⑥的溶液中产生气泡,写出离子方程式
Ⅱ.完成下列问题
(4)配制
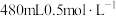 的
的 溶液。
溶液。①配制时,用托盘天平称取
 固体的质量为
固体的质量为②其操作步骤如下图所示:
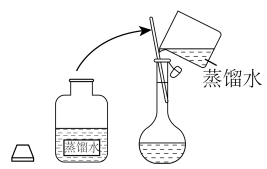
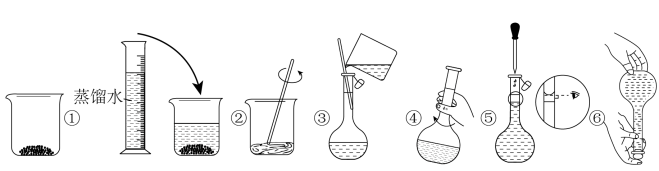
a.定容时俯视刻度线
b.溶解时,烧杯中有少量蒸馏水
c.加水时不慎超过了刻度线,立即用胶头滴管吸出
(5)从配制好的
 溶液中取出10mL,加蒸馏水将其稀释至100mL,稀释后溶液中
溶液中取出10mL,加蒸馏水将其稀释至100mL,稀释后溶液中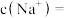
 。
。
您最近一年使用:0次
2023-12-24更新
|
74次组卷
|
2卷引用:江苏省“江南十校”2023-2024学年高一上学期分科诊断摸底联考化学试卷
解题方法
6 . Ⅰ.漂白液是一种常用的消毒剂,通常可将 通入
通入 溶液中制取,某化学兴趣小组想用下列装置制备漂白液并探究漂白液的化学性质。
溶液中制取,某化学兴趣小组想用下列装置制备漂白液并探究漂白液的化学性质。

(1)写出制取漂白液的化学反应方程式___________ ,为完成该制备实验请将上述装置的接口按照合理的顺序连接:___________ 。
(2)为了探究漂白液的性质,各取少量制备的漂白液于3支试管中,进行下列实验(已知淀粉遇碘变蓝),根据要求完善表格。
Ⅱ.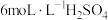 溶液的配制
溶液的配制
若实验室没有配制好的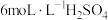 溶液,需要利用图片中的信息自行配制
溶液,需要利用图片中的信息自行配制
(3)该浓硫酸的物质的量浓度为___________ 。
(4)若本实验需要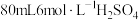 溶液溶液,配制步骤为:
溶液溶液,配制步骤为:
a:将容量瓶塞紧,充分摇匀;
b:待烧杯中的溶液冷却到室温后,转入___________;
c:用量筒量取___________mL浓硫酸慢慢注入盛有少量水的烧杯中,进行稀释;
d:用少量蒸馏水洗涤玻璃棒和烧杯2~3次,每次洗涤的溶液都转入容量瓶,并轻轻摇匀。
e:继续加蒸馏水至液面距刻度线1~2cm处,改用胶头滴管滴加蒸馏水至溶液凹液面与刻度线相切;回答下列问题:
①步骤c中用量筒量取___________ mL浓硫酸。
②实验步骤中使用的仪器b为___________ 。
③本实验正确的操作顺序为___________ (填序号)。
④下列操作会导致所配溶液浓度偏高的是___________ (填字母)。
a.定容时俯视刻度线
b.将烧杯中的溶液转移到容量瓶时不慎洒到容量瓶外
c.摇匀后发现液面低于容量瓶刻度线,再滴加蒸馏水至刻度线
d.转移洗涤液时洒到容量瓶外,继续用未清洗的该容量瓶重新配制
 通入
通入 溶液中制取,某化学兴趣小组想用下列装置制备漂白液并探究漂白液的化学性质。
溶液中制取,某化学兴趣小组想用下列装置制备漂白液并探究漂白液的化学性质。
(1)写出制取漂白液的化学反应方程式
(2)为了探究漂白液的性质,各取少量制备的漂白液于3支试管中,进行下列实验(已知淀粉遇碘变蓝),根据要求完善表格。
| 实验操作 | 试剂X | 实验现象 | 推论 |
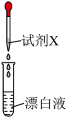 | 紫色石蕊试液 | 先变蓝,后褪色 | ①后褪色说明漂白液具有 |
| 含淀粉的碘化钾溶液 | ② | ③漂白液具有 | |
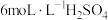 溶液 溶液 | 产生黄绿色气体 | ④溶液中发生反应的离子方程式为 |
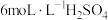 溶液的配制
溶液的配制若实验室没有配制好的
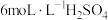 溶液,需要利用图片中的信息自行配制
溶液,需要利用图片中的信息自行配制浓H2SO4 相对分子质量:98 密度:1.84g/mL 质量分数:98% |
(4)若本实验需要
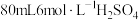 溶液溶液,配制步骤为:
溶液溶液,配制步骤为:a:将容量瓶塞紧,充分摇匀;
b:待烧杯中的溶液冷却到室温后,转入___________;
c:用量筒量取___________mL浓硫酸慢慢注入盛有少量水的烧杯中,进行稀释;
d:用少量蒸馏水洗涤玻璃棒和烧杯2~3次,每次洗涤的溶液都转入容量瓶,并轻轻摇匀。
e:继续加蒸馏水至液面距刻度线1~2cm处,改用胶头滴管滴加蒸馏水至溶液凹液面与刻度线相切;回答下列问题:
①步骤c中用量筒量取
②实验步骤中使用的仪器b为
③本实验正确的操作顺序为
④下列操作会导致所配溶液浓度偏高的是
a.定容时俯视刻度线
b.将烧杯中的溶液转移到容量瓶时不慎洒到容量瓶外
c.摇匀后发现液面低于容量瓶刻度线,再滴加蒸馏水至刻度线
d.转移洗涤液时洒到容量瓶外,继续用未清洗的该容量瓶重新配制
您最近一年使用:0次
解题方法
7 . 某实验小组用0.50 NaOH溶液和0.50
NaOH溶液和0.50 硫酸溶液进行中和热的测定。
硫酸溶液进行中和热的测定。
(一)配制0.50 NaOH溶液。
NaOH溶液。
(1)若实验中大约要使用245mLNaOH溶液,至少需要称量NaOH固体_______ g。
(2)从下图中选择称量NaOH固体所需要的仪器_______ (填字母)。
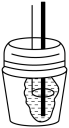
(二)测定稀硫酸和稀氢氧化钠反应的中和热的实验装置如图所示。
(3)写出该反应的热化学方程式(中和热 ):
):_______ 。
(4)取50mLNaOH溶液和30mL硫酸溶液进行实验,实验数据如下表。
①请填写表中的空白:
②近似认为0.50 NaOH溶液和0.50
NaOH溶液和0.50 硫酸溶液的密度都是1
硫酸溶液的密度都是1 ,中和后生成溶液的比热容
,中和后生成溶液的比热容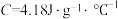 。则测得中和热
。则测得中和热 =
=_______  (取小数点后一位)。
(取小数点后一位)。
③上述实验数值结果与57.3 有偏差,产生偏差的原因可能是
有偏差,产生偏差的原因可能是_______ (填字母)。
A.实验装置保温、隔热效果差
B.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
C.用温度计测定NaOH溶液起始温度后直接测定 溶液的温度
溶液的温度
 NaOH溶液和0.50
NaOH溶液和0.50 硫酸溶液进行中和热的测定。
硫酸溶液进行中和热的测定。(一)配制0.50
 NaOH溶液。
NaOH溶液。(1)若实验中大约要使用245mLNaOH溶液,至少需要称量NaOH固体
(2)从下图中选择称量NaOH固体所需要的仪器
| 序号 | a | b | c | d | e | f |
| 仪器 |  |  |  |  |  |  |
(二)测定稀硫酸和稀氢氧化钠反应的中和热的实验装置如图所示。

(3)写出该反应的热化学方程式(中和热
 ):
):(4)取50mLNaOH溶液和30mL硫酸溶液进行实验,实验数据如下表。
①请填写表中的空白:
| 实验次数 | 起始温度 /℃ /℃ | 终止温度 /℃ /℃ | 温度差平均值 (  - - )/℃ )/℃ | ||
 | NaOH | 平均值 | |||
| 1 | 26.2 | 26.0 | 26.1 | 30.1 | |
| 2 | 27.0 | 27.4 | 27.2 | 33.3 | |
| 3 | 25.9 | 25.9 | 25.9 | 29.8 | |
| 4 | 26.4 | 26.2 | 26.3 | 30.4 | |
 NaOH溶液和0.50
NaOH溶液和0.50 硫酸溶液的密度都是1
硫酸溶液的密度都是1 ,中和后生成溶液的比热容
,中和后生成溶液的比热容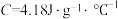 。则测得中和热
。则测得中和热 =
= (取小数点后一位)。
(取小数点后一位)。③上述实验数值结果与57.3
 有偏差,产生偏差的原因可能是
有偏差,产生偏差的原因可能是A.实验装置保温、隔热效果差
B.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
C.用温度计测定NaOH溶液起始温度后直接测定
 溶液的温度
溶液的温度
您最近一年使用:0次
2022-12-31更新
|
209次组卷
|
3卷引用:重庆缙云教育联盟2023-2024学年高二上学期9月月考化学试题



