名校
解题方法
1 . 葡萄糖酸钙是一种可促进骨骼生长的营养物质。葡萄糖酸钙可通过如下实验流程制得:
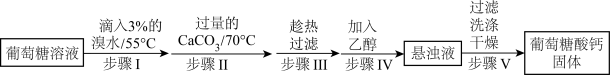
已知:a.反应原理: 。
。
b.相关物质的溶解性如下表:
c.相关物质的酸性:氢溴酸>葡萄糖酸>碳酸。
回答下列问题:
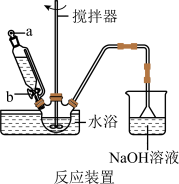
(1)步骤I中溴水氧化葡萄糖时采用了如图所示反应装置,你认为缺少的仪器是___________ ,恒压滴液漏斗使用时需要打开的活塞或玻璃塞是___________ (填“a”“b”或“a和b”)。烧杯中 溶液水浴的作用是
溶液水浴的作用是___________ 。
(2)制备葡萄糖酸钙的过程中,葡萄糖的氧化也可用其他试剂,下列物质中最适合的是___________(填序号)。
(3)步骤Ⅱ中加入过量的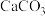 ,生成葡萄糖酸钙的化学方程式为
,生成葡萄糖酸钙的化学方程式为___________ 。加入过量的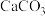 除了能提高葡萄糖酸的转化率,还有的作用是
除了能提高葡萄糖酸的转化率,还有的作用是___________ 。
(4)洗涤操作中最合适的洗涤剂是___________ (填序号),理由是___________ 。
A.冷水 B.热水 C.乙醇
(5)利用重结晶法可除去葡萄糖酸钙粗品中的杂质,提高产品的质量,选出葡萄糖酸钙重结晶过程中合理的操作并排序:___________ (填序号,操作步骤不可重复使用)。
①蒸发浓缩至溶液表面出现晶膜
②待晶体充分析出后,减压过滤
③将滤液冷却至室温,加入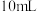 95%的乙醇溶液并搅拌,促进晶体析出
95%的乙醇溶液并搅拌,促进晶体析出
④趁热减压过滤,除去不溶物
⑤在50℃下用恒温干燥箱烘干,称重
⑥取烧杯加入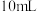 蒸馏水,加热至微沸,加入葡萄糖酸钙粗品,得到葡萄糖酸钙饱和溶液
蒸馏水,加热至微沸,加入葡萄糖酸钙粗品,得到葡萄糖酸钙饱和溶液

已知:a.反应原理:
 。
。b.相关物质的溶解性如下表:
| 物质的名称 | 葡萄糖酸钙 | 葡萄糖酸 | 溴化钙 |
| 在水中的溶解性 | 可溶于冷水,易溶于热水 | 可溶 | 极易溶 |
| 在乙醇中的溶解性 | 微溶 | 微溶 | 可溶 |
回答下列问题:
(1)步骤I中溴水氧化葡萄糖时采用了如图所示反应装置,你认为缺少的仪器是
 溶液水浴的作用是
溶液水浴的作用是
(2)制备葡萄糖酸钙的过程中,葡萄糖的氧化也可用其他试剂,下列物质中最适合的是___________(填序号)。
A.新制 悬浊液 悬浊液 | B.酸性 溶液 溶液 |
C. /葡萄糖氧化酶 /葡萄糖氧化酶 | D. 溶液 溶液 |
(3)步骤Ⅱ中加入过量的
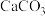 ,生成葡萄糖酸钙的化学方程式为
,生成葡萄糖酸钙的化学方程式为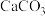 除了能提高葡萄糖酸的转化率,还有的作用是
除了能提高葡萄糖酸的转化率,还有的作用是(4)洗涤操作中最合适的洗涤剂是
A.冷水 B.热水 C.乙醇
(5)利用重结晶法可除去葡萄糖酸钙粗品中的杂质,提高产品的质量,选出葡萄糖酸钙重结晶过程中合理的操作并排序:
①蒸发浓缩至溶液表面出现晶膜
②待晶体充分析出后,减压过滤
③将滤液冷却至室温,加入
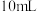 95%的乙醇溶液并搅拌,促进晶体析出
95%的乙醇溶液并搅拌,促进晶体析出④趁热减压过滤,除去不溶物
⑤在50℃下用恒温干燥箱烘干,称重
⑥取烧杯加入
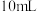 蒸馏水,加热至微沸,加入葡萄糖酸钙粗品,得到葡萄糖酸钙饱和溶液
蒸馏水,加热至微沸,加入葡萄糖酸钙粗品,得到葡萄糖酸钙饱和溶液
您最近一年使用:0次
名校
2 . 硝酸是一种重要的化工原料,某工厂利用氨催化法制备硝酸的工艺流程如下。_____________ 。
(2)原料气在氧化炉中不同温度和催化剂条件下生成不同产物(如图所示)。900℃时发生的主要反应的化学方程式为_____________ 。_____________ 。
(4)工业制硝酸的尾气中含有NO、NO2,通常用NaOH溶液吸收,发生的反应有:
反应I: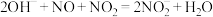
反应Ⅱ:
①反应I生成 时,转移电子的物质的量为
时,转移电子的物质的量为__________ mol。
②当尾气中NO2的含量小于50%时,向NaOH溶液中加入H2O2能提升氮氧化物的去除率,原因是_______________ 。
(5)上述工业流程中体现绿色化学理念的设计是______________ (写出1条)。
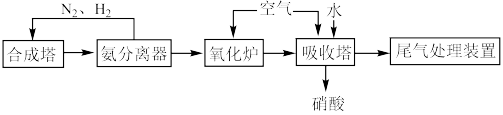
(2)原料气在氧化炉中不同温度和催化剂条件下生成不同产物(如图所示)。900℃时发生的主要反应的化学方程式为

(4)工业制硝酸的尾气中含有NO、NO2,通常用NaOH溶液吸收,发生的反应有:
反应I:
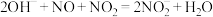
反应Ⅱ:

①反应I生成
 时,转移电子的物质的量为
时,转移电子的物质的量为②当尾气中NO2的含量小于50%时,向NaOH溶液中加入H2O2能提升氮氧化物的去除率,原因是
(5)上述工业流程中体现绿色化学理念的设计是
您最近一年使用:0次
2024-03-24更新
|
137次组卷
|
3卷引用:北京市中关村中学2023-2024学年高一下学期开学考化学试题
3 . 三草酸合铁酸钾晶体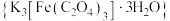 为翠绿色的晶体,易溶于水,难溶于乙醇,是一种重要的光敏材料和有机催化剂。某化学兴趣小组设计如下实验对
为翠绿色的晶体,易溶于水,难溶于乙醇,是一种重要的光敏材料和有机催化剂。某化学兴趣小组设计如下实验对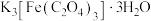 进行探究。
进行探究。
请回答下列问题:
I.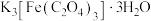 的制备
的制备
主要试剂为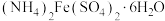 、
、 溶液、
溶液、 饱和溶液、
饱和溶液、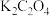 饱和溶液、
饱和溶液、 溶液、
溶液、 乙醇。经过下列三步合成:
乙醇。经过下列三步合成:
沉淀:
氧化配位: (过量)
(过量) (未配平)
(未配平)
酸溶配位: (未配平)
(未配平)
(1)配平“酸溶配位”中制备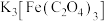 反应的化学方程式:
反应的化学方程式:_____ 。
(2)制备过程中乙醇的作用是_____ 。分离出晶体时需减压抽滤,装置如图所示,抽滤的优点是_____ ;抽滤完毕需进行下列操作,从实验安全角度考虑,你认为接下来最合理的第一步操作为_____ (填标号)。
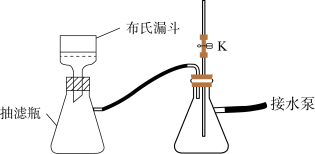
①取下布氏漏斗②关闭水泵开关③打开活塞K④拔下抽滤瓶处橡皮管
Ⅱ.探究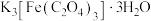 热分解的气体产物组成
热分解的气体产物组成
(3)某研究小组将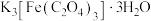 在一定条件下加热分解,利用如图装置(可重复使用)验证所得气体产物中含有
在一定条件下加热分解,利用如图装置(可重复使用)验证所得气体产物中含有 和
和 。
。
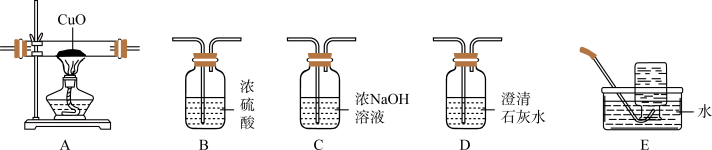
①按气流从左到右的方向,合理的装置连接顺序为_____ 。
_____→_____→D→B→_____→D→E(填装置标号,装置可重复使用)。
②当观察到第一个D装置中出现浑浊现象时,确认气体产物中含有_____ (填化学式);当观察到A装置中有红色固体物质生成且_____ 时,确认气体产物中含有CO。
Ⅲ.阴离子所带电荷数目的测定
(4)测定晶体中阴离子所带电荷数目可以利用离子交换法,步骤如下:
步骤1:准确称取一定质量晶体,完全溶解于一定量水中。
步骤2:使溶液通过阴离子交换柱,并用蒸馏水冲洗交换柱,收集所有过柱液体。{已知离子交换反应: }
}
步骤3:以甲基橙为指示剂,用盐酸标准溶液滴定过柱液体至终点。
①滴定终点的现象为_____ 。
②步骤2中未用蒸馏水冲洗交换柱,则对测得阴离子所带电荷数目的影响是_____ (填“偏大”“偏小”或“无影响”)。
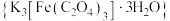 为翠绿色的晶体,易溶于水,难溶于乙醇,是一种重要的光敏材料和有机催化剂。某化学兴趣小组设计如下实验对
为翠绿色的晶体,易溶于水,难溶于乙醇,是一种重要的光敏材料和有机催化剂。某化学兴趣小组设计如下实验对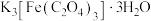 进行探究。
进行探究。请回答下列问题:
I.
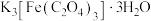 的制备
的制备主要试剂为
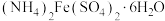 、
、 溶液、
溶液、 饱和溶液、
饱和溶液、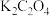 饱和溶液、
饱和溶液、 溶液、
溶液、 乙醇。经过下列三步合成:
乙醇。经过下列三步合成:沉淀:

氧化配位:
 (过量)
(过量) (未配平)
(未配平)酸溶配位:
 (未配平)
(未配平)(1)配平“酸溶配位”中制备
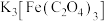 反应的化学方程式:
反应的化学方程式:(2)制备过程中乙醇的作用是

①取下布氏漏斗②关闭水泵开关③打开活塞K④拔下抽滤瓶处橡皮管
Ⅱ.探究
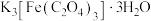 热分解的气体产物组成
热分解的气体产物组成(3)某研究小组将
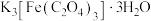 在一定条件下加热分解,利用如图装置(可重复使用)验证所得气体产物中含有
在一定条件下加热分解,利用如图装置(可重复使用)验证所得气体产物中含有 和
和 。
。
①按气流从左到右的方向,合理的装置连接顺序为
_____→_____→D→B→_____→D→E(填装置标号,装置可重复使用)。
②当观察到第一个D装置中出现浑浊现象时,确认气体产物中含有
Ⅲ.阴离子所带电荷数目的测定
(4)测定晶体中阴离子所带电荷数目可以利用离子交换法,步骤如下:
步骤1:准确称取一定质量晶体,完全溶解于一定量水中。
步骤2:使溶液通过阴离子交换柱,并用蒸馏水冲洗交换柱,收集所有过柱液体。{已知离子交换反应:
 }
}步骤3:以甲基橙为指示剂,用盐酸标准溶液滴定过柱液体至终点。
①滴定终点的现象为
②步骤2中未用蒸馏水冲洗交换柱,则对测得阴离子所带电荷数目的影响是
您最近一年使用:0次
名校
解题方法
4 . 工业上可由天然二氧化锰粉与硫化锰矿(还含 等元素)制备
等元素)制备 ,工艺流程如图:
,工艺流程如图:

下列说法正确的是
 等元素)制备
等元素)制备 ,工艺流程如图:
,工艺流程如图:
下列说法正确的是
A.已知“滤渣1”中含有S,则“溶浸”中涉及生成S的反应中氧化剂与还原剂的物质的量之比为 |
B.“氧化”中添加适量的 的作用是将 的作用是将 氧化为 氧化为 以保证铁元素全部进入“滤渣2” 以保证铁元素全部进入“滤渣2” |
C.为提高生产效率,“调 ”工序应该在较高温度下进行 ”工序应该在较高温度下进行 |
D.已知“除杂2”的目的是生成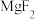 沉淀,则溶液酸度越高越能减少氢氧化物形式沉淀,除杂效果越好 沉淀,则溶液酸度越高越能减少氢氧化物形式沉淀,除杂效果越好 |
您最近一年使用:0次
2024-03-18更新
|
336次组卷
|
3卷引用:河北省保定市部分高中2023-2024学年高三下学期开学化学试题
名校
5 . 磷酸铁是锂离子电池常用正极材料,以硫铁矿( ,少量杂质
,少量杂质 ,
, )为原料制备磷酸铁的工艺流程图如下:
)为原料制备磷酸铁的工艺流程图如下:

回答下面问题:
(1)焙烧时发生的反应: ,在
,在 中S元素的化合价是
中S元素的化合价是_______ 价,该反应中氧化产物是_______ (填化学式)。
(2)加入Fe粉前浸取液中含量最多的金属阳离子是_______ ,其水解的离子方程式是_______ 。该离子与 溶液反应会生成红褐色沉淀,反应的离子方程式是
溶液反应会生成红褐色沉淀,反应的离子方程式是_______ 。
(3)滤渣B主要成分是 ,利用平衡移动原理解释加入
,利用平衡移动原理解释加入 固体除去
固体除去 的原理是:
的原理是:_______ (用离子方程式结合文字说明)。已知 ,完全沉淀时
,完全沉淀时 ,则“调pH”时溶液的pH最小是
,则“调pH”时溶液的pH最小是_______ 。
(4)已知 溶液呈碱性,写出
溶液呈碱性,写出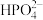 水解的水解常数表达式
水解的水解常数表达式
_______ 。比较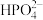 水解的水解常数
水解的水解常数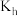 和
和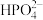 的电离常数
的电离常数 的大小:
的大小: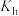
_______ (填“<”“>”或“=”) ,溶液中
,溶液中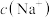
_______ (填“<”“>”或“=”) 。
。
(5)在“沉淀”步骤中先加 目的是将
目的是将 氧化为
氧化为 ,写出反应的离子方程式
,写出反应的离子方程式_______ 。
 ,少量杂质
,少量杂质 ,
, )为原料制备磷酸铁的工艺流程图如下:
)为原料制备磷酸铁的工艺流程图如下:
回答下面问题:
(1)焙烧时发生的反应:
 ,在
,在 中S元素的化合价是
中S元素的化合价是(2)加入Fe粉前浸取液中含量最多的金属阳离子是
 溶液反应会生成红褐色沉淀,反应的离子方程式是
溶液反应会生成红褐色沉淀,反应的离子方程式是(3)滤渣B主要成分是
 ,利用平衡移动原理解释加入
,利用平衡移动原理解释加入 固体除去
固体除去 的原理是:
的原理是: ,完全沉淀时
,完全沉淀时 ,则“调pH”时溶液的pH最小是
,则“调pH”时溶液的pH最小是(4)已知
 溶液呈碱性,写出
溶液呈碱性,写出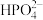 水解的水解常数表达式
水解的水解常数表达式
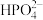 水解的水解常数
水解的水解常数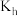 和
和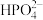 的电离常数
的电离常数 的大小:
的大小: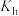
 ,溶液中
,溶液中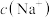
 。
。(5)在“沉淀”步骤中先加
 目的是将
目的是将 氧化为
氧化为 ,写出反应的离子方程式
,写出反应的离子方程式
您最近一年使用:0次
名校
解题方法
6 . 自分子识别兴起以来,冠醚、杯酚烃等的合成引起了研究者的广泛关注。硫代杯[4]芳烃已被应用于许多方面,如监测和分离一些阳离子、阴离子等。合成对叔丁基硫代杯[4]芳烃(M=720.0g⋅mol-1)的原理表示如下:
利用如图所示装置(加热、搅拌、夹持等装置省略),将60.00g对叔丁基苯酚、25.60gS8、8g氢氧化钠和40mL二苯醚加入500mL三颈烧瓶中,在N2气氛下磁力加热搅拌,逐步升温到230℃,温度保持在230℃反应4小时。停止加热并冷却至100℃以下后,加入40mL 6mol·L-1的盐酸和400mL乙醇的混合溶液,搅拌,抽滤,用乙醇和蒸馏水交替洗涤固体,得到粗产物。将粗产物在氯仿/乙醇中重结晶,得到30.24g纯化的对叔丁基硫代杯[4]芳烃。回答下列问题:
(1)仪器A的名称是___________ ,其作用是___________ 。
(2)对叔丁基邻苯二酚(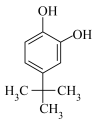 )的沸点小于2-叔丁基对苯二酚(
)的沸点小于2-叔丁基对苯二酚(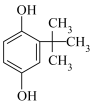 )的原因是
)的原因是___________ 。
(3)加热过程中要不断通入氮气,目的是___________ 。
(4)停止加热后,向反应器中加入盐酸和乙醇混合溶液的目的是___________ 。
(5)实验过程中会产生一种有毒气体,尾气吸收装置中应用___________ (填试剂名称)将该气体除去。
(6)在重结晶过程中,需要用到如图所示仪器中的___________ (填字母)___________ (计算结果精确到0.1%)。
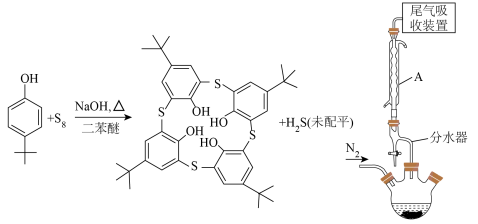
利用如图所示装置(加热、搅拌、夹持等装置省略),将60.00g对叔丁基苯酚、25.60gS8、8g氢氧化钠和40mL二苯醚加入500mL三颈烧瓶中,在N2气氛下磁力加热搅拌,逐步升温到230℃,温度保持在230℃反应4小时。停止加热并冷却至100℃以下后,加入40mL 6mol·L-1的盐酸和400mL乙醇的混合溶液,搅拌,抽滤,用乙醇和蒸馏水交替洗涤固体,得到粗产物。将粗产物在氯仿/乙醇中重结晶,得到30.24g纯化的对叔丁基硫代杯[4]芳烃。回答下列问题:
(1)仪器A的名称是
(2)对叔丁基邻苯二酚(
 )的沸点小于2-叔丁基对苯二酚(
)的沸点小于2-叔丁基对苯二酚( )的原因是
)的原因是(3)加热过程中要不断通入氮气,目的是
(4)停止加热后,向反应器中加入盐酸和乙醇混合溶液的目的是
(5)实验过程中会产生一种有毒气体,尾气吸收装置中应用
(6)在重结晶过程中,需要用到如图所示仪器中的
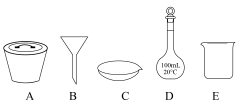
您最近一年使用:0次
2024-03-10更新
|
625次组卷
|
2卷引用:山西省晋城市第一中学校2023-2024学年高三下学期开学考试理综化学试题
名校
7 . 二硫化碳( )是一种重要有机溶剂,易挥发、易燃烧。利用硅酸作催化剂,甲烷和硫黄在
)是一种重要有机溶剂,易挥发、易燃烧。利用硅酸作催化剂,甲烷和硫黄在 条件下发生反应可制得
条件下发生反应可制得 ,根据所给信息,回答下列问题。
,根据所给信息,回答下列问题。
反应原理:
反应装置: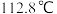 ,沸点
,沸点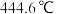 ;
; 的熔点
的熔点 ,沸点
,沸点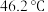 。
。
(1)装置A的名称是___________ ,加热装置A之前,需要先通入一段时间的 ,其目的是
,其目的是___________ (写出一点即可)。
(2)装置B的用途是___________ ,吸收尾气中的硫化氢可使用的试剂是___________ (填试剂名称)。
(3)反应过程中轻轻摇动装置A,使液态硫附着在装置A的内壁上,这样作的目的是___________ 。
(4)实验结束后,将制得的产品用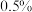 的高锰酸钾溶液洗涤三次,再加入汞不断振荡除去硫单质,分离出
的高锰酸钾溶液洗涤三次,再加入汞不断振荡除去硫单质,分离出 利用无水氯化钙处理后,再经过操作a可获得高纯的
利用无水氯化钙处理后,再经过操作a可获得高纯的 。利用高锰酸钾溶液洗涤是为了除去溶在
。利用高锰酸钾溶液洗涤是为了除去溶在 中的
中的___________ (写化学式),用无水氯化钙处理 的目的是
的目的是___________ ,操作a是___________ (写操作名称)。
(5)工业利用上述原理生产 时,常将副产品
时,常将副产品 利用克劳斯法转化为
利用克劳斯法转化为 ,从而实现循环利用,该方法分两步进行:
,从而实现循环利用,该方法分两步进行: 、
、___________ (写出化学方程式)。
 )是一种重要有机溶剂,易挥发、易燃烧。利用硅酸作催化剂,甲烷和硫黄在
)是一种重要有机溶剂,易挥发、易燃烧。利用硅酸作催化剂,甲烷和硫黄在 条件下发生反应可制得
条件下发生反应可制得 ,根据所给信息,回答下列问题。
,根据所给信息,回答下列问题。反应原理:

反应装置:

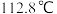 ,沸点
,沸点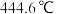 ;
; 的熔点
的熔点 ,沸点
,沸点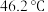 。
。(1)装置A的名称是
 ,其目的是
,其目的是(2)装置B的用途是
(3)反应过程中轻轻摇动装置A,使液态硫附着在装置A的内壁上,这样作的目的是
(4)实验结束后,将制得的产品用
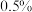 的高锰酸钾溶液洗涤三次,再加入汞不断振荡除去硫单质,分离出
的高锰酸钾溶液洗涤三次,再加入汞不断振荡除去硫单质,分离出 利用无水氯化钙处理后,再经过操作a可获得高纯的
利用无水氯化钙处理后,再经过操作a可获得高纯的 。利用高锰酸钾溶液洗涤是为了除去溶在
。利用高锰酸钾溶液洗涤是为了除去溶在 中的
中的 的目的是
的目的是(5)工业利用上述原理生产
 时,常将副产品
时,常将副产品 利用克劳斯法转化为
利用克劳斯法转化为 ,从而实现循环利用,该方法分两步进行:
,从而实现循环利用,该方法分两步进行: 、
、
您最近一年使用:0次
2024-03-08更新
|
110次组卷
|
4卷引用:陕西省延安市黄龙县中学2023-2024学年高三下学期开学考试理综试卷-高中化学
名校
解题方法
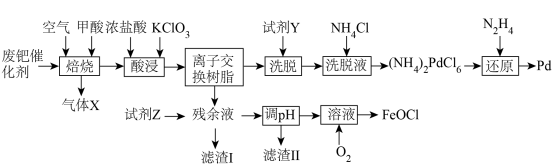
8 . 钯(Pd)见一种银白色过渡金属,质软、有良好的延展性和可塑性,他锻造、压延和拉丝。块状金属钯能吸收大量氢气,使体积显著胀大、变脆乃至破裂成碎片。一种从废钯催化剂(杂质主要含有机物、活性炭及少量Fe、Cu、Al等元素)中回收钯和类芬顿催化剂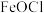 的工艺流程如图所示:
的工艺流程如图所示:
已知:①常温下,钯不溶于盐酸;Pd易被氧化为难溶于酸的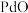 而失去催化活性;
而失去催化活性;
②阴、阳离子交换树脂的基本工作原理分别为 、
、 (R—表示树脂的有机成分);
(R—表示树脂的有机成分);
③常温下,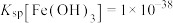 ;
;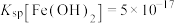 ;
;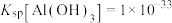 ;当溶液中某离子浓度小于等于
;当溶液中某离子浓度小于等于 时,可认为该离子沉淀完全;
时,可认为该离子沉淀完全;
④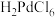 是一种二元强酸,
是一种二元强酸, 在溶液中存在配位平衡:
在溶液中存在配位平衡: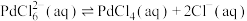
 ;
;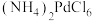 在水中溶解度小。
在水中溶解度小。
回答下列问题:
(1)废钯催化剂“焙烧”时,先通入空气进行逆流式焙烧,其主要目的是___________ ,再通入甲酸继续焙烧的目的是___________ 。
(2)“酸浸”过程需要升高温度至70℃左右,则主要反应的离子方程式为___________ ,实现浸取Pd的同时,还可能会存在的缺陷是___________ 。
(3)“洗脱”时,加入最佳“试剂Y”的名称是___________ ,“洗脱液”中要加入过量 的目的是
的目的是___________ 。
(4)“还原”过程中,不生成污染环境的气体,则被氧化的元素与被还原的元素物质的量之比为___________ 。“调pH”步骤中,若铁元素和铝元素浓度均为 ,则调pH的范围为
,则调pH的范围为___________ (lg2=0.3)。
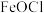 的工艺流程如图所示:
的工艺流程如图所示:
已知:①常温下,钯不溶于盐酸;Pd易被氧化为难溶于酸的
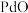 而失去催化活性;
而失去催化活性;②阴、阳离子交换树脂的基本工作原理分别为
 、
、 (R—表示树脂的有机成分);
(R—表示树脂的有机成分);③常温下,
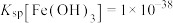 ;
;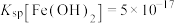 ;
;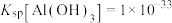 ;当溶液中某离子浓度小于等于
;当溶液中某离子浓度小于等于 时,可认为该离子沉淀完全;
时,可认为该离子沉淀完全;④
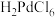 是一种二元强酸,
是一种二元强酸, 在溶液中存在配位平衡:
在溶液中存在配位平衡: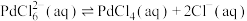
 ;
;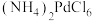 在水中溶解度小。
在水中溶解度小。回答下列问题:
(1)废钯催化剂“焙烧”时,先通入空气进行逆流式焙烧,其主要目的是
(2)“酸浸”过程需要升高温度至70℃左右,则主要反应的离子方程式为
(3)“洗脱”时,加入最佳“试剂Y”的名称是
 的目的是
的目的是(4)“还原”过程中,不生成污染环境的气体,则被氧化的元素与被还原的元素物质的量之比为
 ,则调pH的范围为
,则调pH的范围为
您最近一年使用:0次
名校
解题方法
9 . 乙酰苯胺是一种具有解热镇痛作用的白色晶体,20℃时在乙醇中的溶解度为36.9 g,在水中溶解度为0.46 g,100℃时水中溶解度为5.50 g。某实验小组设计提纯粗乙酰苯胺(含少量氯化钠和有机杂质)方案如下:

下列说法不正确的是

下列说法不正确的是
| A.操作Ⅰ中若观察到乙酰苯胺未完全溶解,可补加适量水 |
| B.操作Ⅱ稍冷却目的是防止暴沸,加入活性炭可吸附有机杂质 |
| C.操作Ⅲ宜缓慢自然冷却结晶,有利于得到较大晶体颗粒 |
| D.操作Ⅳ可用乙醇洗涤,利于快速晾干 |
您最近一年使用:0次
名校
10 . 超细银粉是电气和电子工业的重要材料,利用含银废催化剂(主要成分为 ,还有少量
,还有少量 ,
, 和
和 )为原料,制备超细银粉的工业流程如下所示,下列说法错误的是
)为原料,制备超细银粉的工业流程如下所示,下列说法错误的是
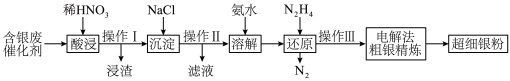
 ,还有少量
,还有少量 ,
, 和
和 )为原料,制备超细银粉的工业流程如下所示,下列说法错误的是
)为原料,制备超细银粉的工业流程如下所示,下列说法错误的是
A.操作Ⅰ产生的浸渣主要的成分为 |
| B.操作Ⅱ、操作Ⅲ均有过滤、洗涤沉淀等操作 |
C.“还原”得到21.6kg ,理论上消耗1.6kg ,理论上消耗1.6kg |
| D.电解法粗银精炼时将粗银置于阴极 |
您最近一年使用:0次



