名校
解题方法
1 . 食盐是日常生活的必需品,也是重要的化工原料。试剂级NaCl可用海盐(含泥沙、海藻、K+、Ca2+、Mg2+、Fe3+、SO 等杂质)为原料制备。实验室提纯NaCl的流程如图:
等杂质)为原料制备。实验室提纯NaCl的流程如图:
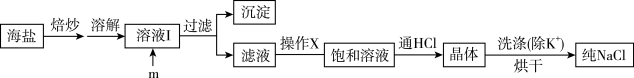
提供的试剂:饱和Na2CO3溶液、饱和K2CO3溶液、NaOH溶液、BaCl2溶液、Ba(NO3)2溶液、75%乙醇、四氯化碳
(1)欲除去溶液I中的Ca2+、Mg2+、Fe3+、 ,在提供的试剂中,选出m所代表的试剂,按滴加顺序依次为
,在提供的试剂中,选出m所代表的试剂,按滴加顺序依次为_______ 、NaOH、_______ (只填化学式);洗涤除去NaCl晶体表面附带的少量KCl,在提供的试剂中,选用的试剂为_______ 。
(2)操作X为用提纯的NaCl配制500mL 4.00mol/L NaCl溶液,所用的玻璃仪器除烧杯、玻璃棒外还有_______ (填仪器名称)
(3)用如图所示装置,以焙炒后的海盐为原料制备HCl气体,并通入NaCl饱和溶液中使NaCl结晶析出。
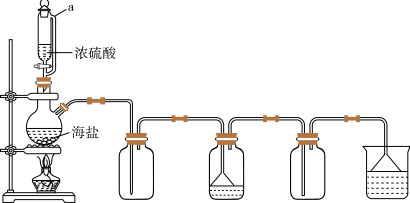
①用浓硫酸和海盐混合加热制取氯化氢利用了浓硫酸的性质是_______ (填编号),相比分液漏斗,选用仪器a的优点是_______ 。
a.高沸点 b.强酸性 c.强氧化性
②对比实验发现,将烧瓶中的海盐磨细可加快NaCl晶体的析出,其原因是_______ 。
(4)设计实验测定NaCl产品中SO 的含量,填写表格。
的含量,填写表格。
 等杂质)为原料制备。实验室提纯NaCl的流程如图:
等杂质)为原料制备。实验室提纯NaCl的流程如图:
提供的试剂:饱和Na2CO3溶液、饱和K2CO3溶液、NaOH溶液、BaCl2溶液、Ba(NO3)2溶液、75%乙醇、四氯化碳
(1)欲除去溶液I中的Ca2+、Mg2+、Fe3+、
 ,在提供的试剂中,选出m所代表的试剂,按滴加顺序依次为
,在提供的试剂中,选出m所代表的试剂,按滴加顺序依次为(2)操作X为用提纯的NaCl配制500mL 4.00mol/L NaCl溶液,所用的玻璃仪器除烧杯、玻璃棒外还有
(3)用如图所示装置,以焙炒后的海盐为原料制备HCl气体,并通入NaCl饱和溶液中使NaCl结晶析出。

①用浓硫酸和海盐混合加热制取氯化氢利用了浓硫酸的性质是
a.高沸点 b.强酸性 c.强氧化性
②对比实验发现,将烧瓶中的海盐磨细可加快NaCl晶体的析出,其原因是
(4)设计实验测定NaCl产品中SO
 的含量,填写表格。
的含量,填写表格。| 操作 | 目的/结论 | |
| ① | 称取样品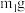 ,加水溶解,加盐酸调至弱酸性,滴加过量c1mol/LBaCl2溶液V1mL ,加水溶解,加盐酸调至弱酸性,滴加过量c1mol/LBaCl2溶液V1mL | 目的: |
| ② | 过滤洗涤,干燥后称得沉淀为m2g | 结论:样品中SO 的质量分数为 的质量分数为 |
您最近一年使用:0次
2021-04-11更新
|
275次组卷
|
3卷引用:上海市青浦区2021届高三等级考二模化学试题
2 . 连二亚硫酸钠(Na2S2O4)俗称保险粉,可以用作染色工艺的还原剂,纸浆、肥皂等的漂白剂。Na2S2O4易溶于水,难溶于甲醇,在碱性介质中较稳定,在潮湿空气中易被氧化生成两种常见的酸式盐。锌粉法制备Na2S2O4的工艺流程如图所示:

回答下列问题:
(1)若用Na2SO3固体和某酸反应制备SO2气体,你认为下列最适宜选用的酸是_______ 。
A.浓盐酸 B.质量分数为70%的H2SO4
C.稀硝酸 D.质量分数为10%的稀硫酸
(2)在步骤Ⅲ中加入固体NaCl的作用是_______ ;
(3)保险粉在潮湿空气中被氧化的化学方程式:_______ 。
(4)后续处理得到保险粉产品的过程中
①洗涤步骤可能需要用到以下操作:a.加入水至浸没沉淀物;b.加入甲醇至浸没沉淀物; c.洗涤剂缓慢通过沉淀物;d.洗涤剂快速通过;e.关小水龙头;f.开大水龙头;g.重复2-3次。请选出正确的操作并排序____ →____ →____ →g→____
②干燥步骤如图所示,选用此装置的目的是:_______ 。

(5)为测定所制保险粉的纯度,称取3.0g保险粉样品溶于冷水中,配成100mL溶液,用移液管取出25mL该溶液于锥形瓶中,用0.10mol·L-1的酸性KMnO4溶液滴定。
①滴定终点的现象是_______ 。
②若在滴定前未向锥形瓶中通氮气,则会导致测定的保险粉含量_______ (填“偏高”、“偏低”或“无影响”)

回答下列问题:
(1)若用Na2SO3固体和某酸反应制备SO2气体,你认为下列最适宜选用的酸是
A.浓盐酸 B.质量分数为70%的H2SO4
C.稀硝酸 D.质量分数为10%的稀硫酸
(2)在步骤Ⅲ中加入固体NaCl的作用是
(3)保险粉在潮湿空气中被氧化的化学方程式:
(4)后续处理得到保险粉产品的过程中
①洗涤步骤可能需要用到以下操作:a.加入水至浸没沉淀物;b.加入甲醇至浸没沉淀物; c.洗涤剂缓慢通过沉淀物;d.洗涤剂快速通过;e.关小水龙头;f.开大水龙头;g.重复2-3次。请选出正确的操作并排序
②干燥步骤如图所示,选用此装置的目的是:

(5)为测定所制保险粉的纯度,称取3.0g保险粉样品溶于冷水中,配成100mL溶液,用移液管取出25mL该溶液于锥形瓶中,用0.10mol·L-1的酸性KMnO4溶液滴定。
①滴定终点的现象是
②若在滴定前未向锥形瓶中通氮气,则会导致测定的保险粉含量
您最近一年使用:0次
2020-11-30更新
|
266次组卷
|
3卷引用:解密12 实验化学(分层训练)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(浙江专版)
(已下线)解密12 实验化学(分层训练)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(浙江专版)浙江省十校联盟2021届高三10月联考化学试题浙江省瑞安中学十校联盟2020-2021学年高三10月联考化学试题
名校
3 . X、Y、Z、W四种化合物均由1~18号元素组成,其中X含有四种元素,X、Y、Z均含钠元素,W为无色无味气体。这四种化合物具有下列转化关系(部分反应物、产物及反应条件已略去)。请回答下列问题:

(1)X生成Z的化学方程式是___________ 。
(2)X含有的四种元素之间(二种、三种或四种)可组成多种化合物,选用其中某些化合物,利用下图装置(夹持固定装置已略去)进行实验,装置Ⅲ中产生白色沉淀,装置V中可收集到一种无色气体。

①装置II中物质的化学式是___________ 。
②用X含有的四种元素中的两种组成的某化合物,在催化剂存在下制备并收集纯净干燥的装置V中气体,所需仪器装置是___________ (从上图中选择必要装置,填写编号)。
(3)向Z溶液中通入氯气,可制得某种生产和生活中常用的漂白、消毒的物质,同时有X生成,该反应的化学方程式是___________ 。
(4)为测定X和Z混合物中Z的质量分数,某课外小组取ag混合物充分加热,质量减少bg,则混合物中Z的质量分数是___________ (用含a、b的代数式表示)。

(1)X生成Z的化学方程式是
(2)X含有的四种元素之间(二种、三种或四种)可组成多种化合物,选用其中某些化合物,利用下图装置(夹持固定装置已略去)进行实验,装置Ⅲ中产生白色沉淀,装置V中可收集到一种无色气体。

①装置II中物质的化学式是
②用X含有的四种元素中的两种组成的某化合物,在催化剂存在下制备并收集纯净干燥的装置V中气体,所需仪器装置是
(3)向Z溶液中通入氯气,可制得某种生产和生活中常用的漂白、消毒的物质,同时有X生成,该反应的化学方程式是
(4)为测定X和Z混合物中Z的质量分数,某课外小组取ag混合物充分加热,质量减少bg,则混合物中Z的质量分数是
您最近一年使用:0次
2021高三·全国·专题练习
4 . 碳酸镧咀嚼片可用于慢性肾衰患者高磷血症的治疗,不含钙和铝。碳酸镧可由LaCl3为原料来制备,整个反应在较低的pH条件下进行,避免生成碱式碳酸镧[La(OH)CO3]。
(1)化学兴趣小组利用下列装置在实验室中用碳酸氢铵制备碳酸镧。
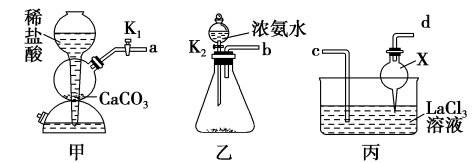
①仪器X的名称为___________ ;检验装置甲气密性良好的方法是___________ 。
②实验中K1、K2打开的先后顺序为___________ ;为保证碳酸镧的纯度,实验过程中需要注意的问题有___________ 。
(2)碳酸钠或碳酸氢钠与氯化镧反应均可生成碳酸镧。
①为了高磷血症患者的安全,通常选用碳酸氢钠溶液,过程中会发生两个平行反应,其离子方程式为___________ 和___________ 。
②选择碳酸氢钠溶液制备碳酸镧的优点是___________ (任写一条)。
(3)碳酸镧(摩尔质量为458 g·mol-1)质量分数的测定:准确称取15.0 g产品试样,溶于10.0 mL稀盐酸中,加入10 mL NH3NH4Cl缓冲溶液,加入0.2 g紫脲酸铵混合指示剂,用0.5 mol·L-1 EDTA(Na2H2Y)标准溶液滴定至呈蓝紫色(La3++H2Y2-=LaY-+2H+),消耗EDTA溶液60.00 mL。则产品中碳酸镧的质量分数为多少___________ ?(写出计算过程)
(1)化学兴趣小组利用下列装置在实验室中用碳酸氢铵制备碳酸镧。

①仪器X的名称为
②实验中K1、K2打开的先后顺序为
(2)碳酸钠或碳酸氢钠与氯化镧反应均可生成碳酸镧。
①为了高磷血症患者的安全,通常选用碳酸氢钠溶液,过程中会发生两个平行反应,其离子方程式为
②选择碳酸氢钠溶液制备碳酸镧的优点是
(3)碳酸镧(摩尔质量为458 g·mol-1)质量分数的测定:准确称取15.0 g产品试样,溶于10.0 mL稀盐酸中,加入10 mL NH3NH4Cl缓冲溶液,加入0.2 g紫脲酸铵混合指示剂,用0.5 mol·L-1 EDTA(Na2H2Y)标准溶液滴定至呈蓝紫色(La3++H2Y2-=LaY-+2H+),消耗EDTA溶液60.00 mL。则产品中碳酸镧的质量分数为多少
您最近一年使用:0次
5 . 氯元素是生产生活中常见的非金属元素。
I.新制氯水的主要成分有Cl2、HClO、H+、Cl-,因而具有多种性质。
(1)把Cl2通入水中,发生反应的化学方程式为_______ 。
(2)用氯水进行如下表实验:
①实验I的现象说明,氯水具有的性质是_______ 但久置的氯水最终会失去其中某一性质而变成_______ (填名称);
②实验II出现沉淀的离子反应方程式为_______ :
③实验III出现气泡,该气体是_______ (填化学式)。
II.二氧化氯(ClO2)作为一种高效强氧化剂已被联合国世界卫生组织(WHO)列为AI级安全消毒剂。ClO2与Cl2的氧化性相近,可用于自来水消毒和果蔬保鲜等方面。实验室用亚氯酸钠固体与氯气反应制备ClO2:2NaClO2+Cl2=2ClO2+2NaCl。已知:ClO2是一种易溶于水而难溶于有机溶剂的气体,性质非常不稳定,温度过高或水溶液中ClO2的质量分数高于30%等均有可能引起爆炸,易与碱液反应生成盐和水。下图是实验室中制取干燥纯净氯气并进一步最终制取和收集一定量较纯净的ClO2的装置(某些夹持装置和垫持用品省略)。

其中E中盛有CC14液体(用于除去ClO2中未反应的Cl2)。
(1)NaClO2中氯元素的化合价是_______ 。
(2)写出装置A中烧瓶内发生反应的化学方程式_______ 。
(3)F是用排空气法收集ClO2的装置,应添加选用的装置是_______ (填字母)。

(4)将产生的二氧化氯气体进行溶解吸收保存,吸收液最好使用_______ (填正确答案标号)。
A. 20mL60℃的温水 B. 100mL冰水 C.100mL NaOH溶液 D. 100mL 沸水
I.新制氯水的主要成分有Cl2、HClO、H+、Cl-,因而具有多种性质。
(1)把Cl2通入水中,发生反应的化学方程式为
(2)用氯水进行如下表实验:
实验 | 操作 | 现象 |
I | 把氯水点在蓝色石蕊试纸上 | 试纸先变红后褪色 |
II | 向氯水中滴加适量AgNO3溶液,不断振荡 | 有白色沉淀生成 |
III | 向氯水中滴加适量Na2CO3溶液,不断振荡 | 有气泡产生 |
②实验II出现沉淀的离子反应方程式为
③实验III出现气泡,该气体是
II.二氧化氯(ClO2)作为一种高效强氧化剂已被联合国世界卫生组织(WHO)列为AI级安全消毒剂。ClO2与Cl2的氧化性相近,可用于自来水消毒和果蔬保鲜等方面。实验室用亚氯酸钠固体与氯气反应制备ClO2:2NaClO2+Cl2=2ClO2+2NaCl。已知:ClO2是一种易溶于水而难溶于有机溶剂的气体,性质非常不稳定,温度过高或水溶液中ClO2的质量分数高于30%等均有可能引起爆炸,易与碱液反应生成盐和水。下图是实验室中制取干燥纯净氯气并进一步最终制取和收集一定量较纯净的ClO2的装置(某些夹持装置和垫持用品省略)。

其中E中盛有CC14液体(用于除去ClO2中未反应的Cl2)。
(1)NaClO2中氯元素的化合价是
(2)写出装置A中烧瓶内发生反应的化学方程式
(3)F是用排空气法收集ClO2的装置,应添加选用的装置是

(4)将产生的二氧化氯气体进行溶解吸收保存,吸收液最好使用
A. 20mL60℃的温水 B. 100mL冰水 C.100mL NaOH溶液 D. 100mL 沸水
您最近一年使用:0次
名校
解题方法
6 . 过氧化钠常作漂白剂、杀菌剂、消毒剂。过氧化钠保存不当容易吸收空气中CO2而变质。某课外活动小组为了粗略测定过氧化钠的纯度,他们称取a g样品,并设计用如图装置来测定过氧化钠的质量分数。
①将仪器连接好以后,必须进行的第一步操作是_____ 。
②B装置出来的气体是否需要干燥______ (填“是”或“否”)。
③D中NaOH溶液的作用_________ 。
④实验结束时,读取实验中生成气体的体积时,不合理的是_____ 。
a.直接读取气体体积,不需冷却到室温
b.上下移动量筒,使得E、F中液面高度相同
c.视线与凹液面的最低点相平读取量筒中水的体积
⑤读出量筒内水的体积后,折算成标准状况下氧气的体积为V mL,则样品中过氧化钠的质量分数为____ 。
⑥实验完成后E到F之间导管内残留水的体积会使测量结果________ (填“偏大”“偏小”或“不影响”)。
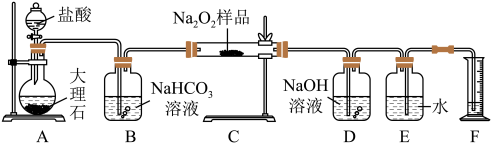
①将仪器连接好以后,必须进行的第一步操作是
②B装置出来的气体是否需要干燥
③D中NaOH溶液的作用
④实验结束时,读取实验中生成气体的体积时,不合理的是
a.直接读取气体体积,不需冷却到室温
b.上下移动量筒,使得E、F中液面高度相同
c.视线与凹液面的最低点相平读取量筒中水的体积
⑤读出量筒内水的体积后,折算成标准状况下氧气的体积为V mL,则样品中过氧化钠的质量分数为
⑥实验完成后E到F之间导管内残留水的体积会使测量结果
您最近一年使用:0次
2019-12-18更新
|
128次组卷
|
2卷引用:山东省济南市平阴县第一中学2021-2022学年高一上学期10月阶段检测化学试题



