名校
1 . Ⅰ.某校化学兴趣小组为研究Cl2的性质,设计如图所示装置进行实验。装置Ⅲ中夹持装置已略去,其中a为干燥的品红试纸,b为湿润的品红试纸。
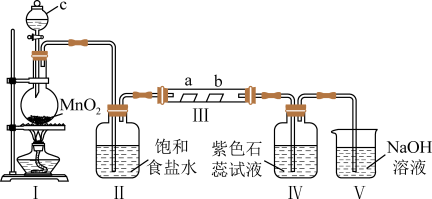
(1)装置Ⅰ中仪器c的名称是_______ ,写出装置Ⅰ中制备Cl2的化学方程式为_______ 。
(2)装置Ⅱ的作用是_______ 。
(3)实验结束后,该组同学在装置Ⅲ中观察到b的红色褪去,但是并未观察到“a无明显变化”这一预期现象。为了达到这一实验目的,你认为还需在图中装置Ⅱ与Ⅲ之间添加图中的_______ 装置(填序号)。

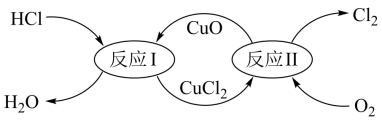
(4)“地康法”制取Cl2的反应原理如图所示,在450℃条件下,反应Ⅱ的化学方程式为_______ 。
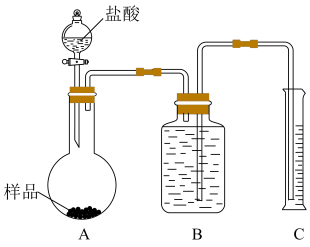
Ⅱ.工业上碳酸钠大多采用侯氏制碱法制取,所得碳酸钠样品中往往含有少量的NaCl,现欲测定样品中Na2CO3的质量分数,某探究性学习小组设计了如下实验方案。
(5)把一定质量的样品与足量盐酸反应后,用如图所示装置测定产生CO2气体的体积,为了使测量结果准确,B中溶液选用_______ ,但选用该溶液后实验结果仍然不够准确,可能的原因是_______ 。

(1)装置Ⅰ中仪器c的名称是
(2)装置Ⅱ的作用是
(3)实验结束后,该组同学在装置Ⅲ中观察到b的红色褪去,但是并未观察到“a无明显变化”这一预期现象。为了达到这一实验目的,你认为还需在图中装置Ⅱ与Ⅲ之间添加图中的

(4)“地康法”制取Cl2的反应原理如图所示,在450℃条件下,反应Ⅱ的化学方程式为

Ⅱ.工业上碳酸钠大多采用侯氏制碱法制取,所得碳酸钠样品中往往含有少量的NaCl,现欲测定样品中Na2CO3的质量分数,某探究性学习小组设计了如下实验方案。
(5)把一定质量的样品与足量盐酸反应后,用如图所示装置测定产生CO2气体的体积,为了使测量结果准确,B中溶液选用

您最近一年使用:0次
2023-01-19更新
|
339次组卷
|
2卷引用:河北省保定市泽龙实验中学2022-2023学年高一下学期开学检测化学试题
名校
2 . 氯酸钾 和次氯酸钠(NaClO)是氯元素重要的含氧酸盐,实验室中利用下图装置制备这两种盐。回答下列问题:
和次氯酸钠(NaClO)是氯元素重要的含氧酸盐,实验室中利用下图装置制备这两种盐。回答下列问题:
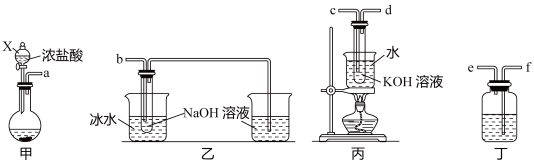
(1)仪器X名称是_______ ,甲装置圆底烧瓶中的试剂为 固体,写出发生反应的化学方程式
固体,写出发生反应的化学方程式_______ 。
(2)为达成实验目的,上述仪器口连接顺序依次为:a−____ 。
(3)丁装置中所盛试剂为___ ;乙装置中采用冰水浴冷却的目的是___ 。
(4)反应结束取出b中试管,经冷却结晶,___ ,____ ,干燥,到得到 晶体。
晶体。
(5)为进一步测定所得 晶体的纯度,设计了如下实验方案:
晶体的纯度,设计了如下实验方案:
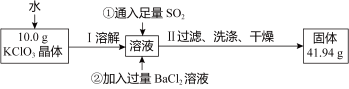
写出通入足量 时,溶液中发生反应的离子方程式
时,溶液中发生反应的离子方程式_______ 。依据上述实验结果,测得该晶体的纯度为_______ 。
 和次氯酸钠(NaClO)是氯元素重要的含氧酸盐,实验室中利用下图装置制备这两种盐。回答下列问题:
和次氯酸钠(NaClO)是氯元素重要的含氧酸盐,实验室中利用下图装置制备这两种盐。回答下列问题:
(1)仪器X名称是
 固体,写出发生反应的化学方程式
固体,写出发生反应的化学方程式(2)为达成实验目的,上述仪器口连接顺序依次为:a−
(3)丁装置中所盛试剂为
(4)反应结束取出b中试管,经冷却结晶,
 晶体。
晶体。(5)为进一步测定所得
 晶体的纯度,设计了如下实验方案:
晶体的纯度,设计了如下实验方案:
写出通入足量
 时,溶液中发生反应的离子方程式
时,溶液中发生反应的离子方程式
您最近一年使用:0次
解题方法
3 . 下列实验装置能达到实验目的的是
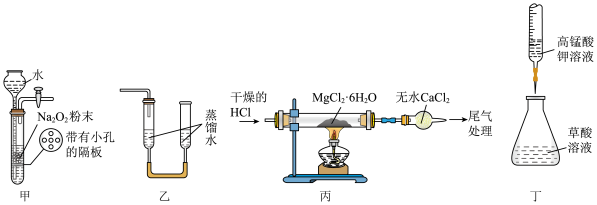

| A.甲装置:制取少量O2 | B.乙装置:测量少量氯气的体积 |
| C.丙装置:制备无水氯化镁 | D.丁装置:测定草酸溶液的浓度 |
您最近一年使用:0次
4 . 下列实验操作规范且能达到实验目的的是


| A.①装置用于制备无水乙醇 |
| B.②装置A中的澄清石灰水变浑浊可证明NaHCO3更易分解 |
| C.③装置测定NaOH溶液的浓度 |
| D.④装置所示实验过程中白色沉淀转化成红褐色沉淀,可证明Fe(OH)3更难溶 |
您最近一年使用:0次
2022-01-22更新
|
918次组卷
|
8卷引用:山东省菏泽市单县第二中学2022-2023学年高三下学期开学第一次模拟考试化学试题
山东省菏泽市单县第二中学2022-2023学年高三下学期开学第一次模拟考试化学试题(已下线)二轮专题强化练 专题17 典型实验装置及化学实验基本操作河南省济源平顶山许昌2021-2022学年高三第一次质量检测理综化学试题(已下线)秘籍04 实验仪器使用与基本操作-备战2022年高考化学抢分秘籍(全国通用)(已下线)专项09 化学实验基础-备战2022年高考化学阶段性新题精选专项特训(全国卷)(3月期)(已下线)黄金卷9-【赢在高考·黄金20卷】备战2022年高考化学模拟卷(江苏卷)(已下线)卷05 小题素养卷-【小题小卷】冲刺2022年高考化学小题限时集训(新高考专用)(已下线)押江苏卷第3题 化学实验基础知识和技能 -备战2022年高考化学临考题号押题(江苏卷)
名校
5 . 亚硝酰硫酸(NOSO4H)主要用于染料、医药等工业,是一种浅黄色、遇水易分解的固体,但溶于浓硫酸后并不分解。某实验小组将在A中产生的SO2通入浓硫酸和浓硝酸的混合溶液中制备亚硝酰硫酸,并测定产品的纯度。
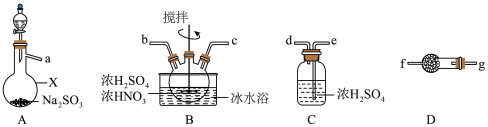
(1)仪器X的名称为___________ ;
(2)按气流从左到右的顺序,上述仪器的连接顺序为(填仪器接口字母)___________ 。
(3)①装置B中发生反应的化学方程式为___________ 。
②开始时反应缓慢,待生成少量NOSO4H后,温度变化不大,但反应速率明显加快,其可能原因是___________ 。
(4)装置B中维持反应体系温度不高于20℃的主要原因是___________ 。
(5)测定产品的纯度:称取4.5g产品放入锥形瓶中,加入100.00 mL 0.10mol/L的KMnO4溶液和适量H2SO4,摇匀,再将溶液加热至60~70℃(使生成的HNO3挥发逸出),冷却至室温,然后用0.20 mol/L的Na2C2O4标准溶液滴定至终点,消耗Na2C2O4溶液的体积为25.00 mL。
已知:2KMnO4+5NOSO4H+2H2O=K2SO4+2MnSO4+5HNO3+2H2SO4,2KMnO4+5Na2C2O4+8H2SO4=K2SO4+2MnSO4+10CO2+5Na2SO4+8H2O。
①滴定终点的现象为___________ 。
②该产品的纯度为___________ % (保留小数点后一位)。

(1)仪器X的名称为
(2)按气流从左到右的顺序,上述仪器的连接顺序为(填仪器接口字母)
(3)①装置B中发生反应的化学方程式为
②开始时反应缓慢,待生成少量NOSO4H后,温度变化不大,但反应速率明显加快,其可能原因是
(4)装置B中维持反应体系温度不高于20℃的主要原因是
(5)测定产品的纯度:称取4.5g产品放入锥形瓶中,加入100.00 mL 0.10mol/L的KMnO4溶液和适量H2SO4,摇匀,再将溶液加热至60~70℃(使生成的HNO3挥发逸出),冷却至室温,然后用0.20 mol/L的Na2C2O4标准溶液滴定至终点,消耗Na2C2O4溶液的体积为25.00 mL。
已知:2KMnO4+5NOSO4H+2H2O=K2SO4+2MnSO4+5HNO3+2H2SO4,2KMnO4+5Na2C2O4+8H2SO4=K2SO4+2MnSO4+10CO2+5Na2SO4+8H2O。
①滴定终点的现象为
②该产品的纯度为
您最近一年使用:0次
名校
6 . 硫酸亚铁铵 [ ]俗称摩尔盐。硫酸亚铁在空气中易被氧化,但与硫酸铵反应生成摩尔盐后较稳定。模拟工业制备硫酸亚铁铵晶体的实验装置如图所示。回答下列问题:
]俗称摩尔盐。硫酸亚铁在空气中易被氧化,但与硫酸铵反应生成摩尔盐后较稳定。模拟工业制备硫酸亚铁铵晶体的实验装置如图所示。回答下列问题:

(1)先用饱和碳酸钠溶液煮沸铁屑(含少量油污、铁锈等),再用清水洗净。用饱和碳酸钠溶液煮沸的目的是___________ 。
(2)按如图连接好装置,经检验气密性良好后加入相应的药品,打开 ,关闭
,关闭 ,装置B中发生反应的离子方程式可能是
,装置B中发生反应的离子方程式可能是___________ (填字母)。
A. B.
B.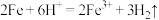
C.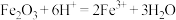 D.
D.
铁屑快反应完时,打开___________ ,关闭___________ ,装置B中的溶液会流入装置A,其原因是___________ 。
(3)常温下,将反应后的溶液放置一段时间,瓶底将结晶析出硫酸亚铁铵。为了测定晶体中 的含量,称取一份质量为4.0g的硫酸亚铁铵晶体样品,配成溶液。用
的含量,称取一份质量为4.0g的硫酸亚铁铵晶体样品,配成溶液。用 酸性
酸性 溶液滴定至终点,消耗
溶液滴定至终点,消耗 溶液体积为
溶液体积为 。反应到达滴定终点的现象为
。反应到达滴定终点的现象为___________ ,计算晶体中 的质量分数为
的质量分数为___________ 。
 ]俗称摩尔盐。硫酸亚铁在空气中易被氧化,但与硫酸铵反应生成摩尔盐后较稳定。模拟工业制备硫酸亚铁铵晶体的实验装置如图所示。回答下列问题:
]俗称摩尔盐。硫酸亚铁在空气中易被氧化,但与硫酸铵反应生成摩尔盐后较稳定。模拟工业制备硫酸亚铁铵晶体的实验装置如图所示。回答下列问题:
(1)先用饱和碳酸钠溶液煮沸铁屑(含少量油污、铁锈等),再用清水洗净。用饱和碳酸钠溶液煮沸的目的是
(2)按如图连接好装置,经检验气密性良好后加入相应的药品,打开
 ,关闭
,关闭 ,装置B中发生反应的离子方程式可能是
,装置B中发生反应的离子方程式可能是A.
 B.
B.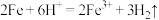
C.
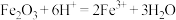 D.
D.
铁屑快反应完时,打开
(3)常温下,将反应后的溶液放置一段时间,瓶底将结晶析出硫酸亚铁铵。为了测定晶体中
 的含量,称取一份质量为4.0g的硫酸亚铁铵晶体样品,配成溶液。用
的含量,称取一份质量为4.0g的硫酸亚铁铵晶体样品,配成溶液。用 酸性
酸性 溶液滴定至终点,消耗
溶液滴定至终点,消耗 溶液体积为
溶液体积为 。反应到达滴定终点的现象为
。反应到达滴定终点的现象为 的质量分数为
的质量分数为
您最近一年使用:0次
解题方法
7 . 保险粉(连二亚硫酸钠, )常作漂白剂。目前工业上主要采用甲酸钠
)常作漂白剂。目前工业上主要采用甲酸钠 法制备保险粉。某小组在实验室制备保险粉并探究其性质。
法制备保险粉。某小组在实验室制备保险粉并探究其性质。
实验(一)制备保险粉。
反应原理为 ,装置如图所示(部分装置已省略)。
,装置如图所示(部分装置已省略)。
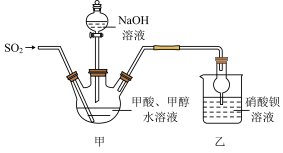
请回答下列问题:
(1)乙装置中产生的白色沉淀是___________ (填化学式)。
(2)实验中,先旋开分液漏斗的活塞,后通入 ,这样操作的目的是
,这样操作的目的是___________ 。若甲装置中不加入甲醇,则保险粉的产率将___________ (填“增大”“减小”或“不变”)。
(3)分离产品之前,需加入适量 粉末,其作用是
粉末,其作用是___________ 。
实验(二)探究保险粉的性质。
(4)由实验II可知,在该反应中 表现出的性质是
表现出的性质是___________ (填字母标号)。
A.氧化性 B.还原性 C.氧化性和还原性
写出实验III的离子方程式___________ 。
实验(三)测定保险粉的纯度。
(5)称取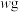 连二亚硫酸钠样品溶于水配制成
连二亚硫酸钠样品溶于水配制成 溶液,准确量取
溶液,准确量取 配制溶液于锥形瓶中,加入足量甲醛溶液,充分反应后,滴加几滴淀粉溶液,用
配制溶液于锥形瓶中,加入足量甲醛溶液,充分反应后,滴加几滴淀粉溶液,用 碘水滴定至终点时消耗滴定液为
碘水滴定至终点时消耗滴定液为 。有关反应如下:
。有关反应如下:


滴定终点的现象是________ 。该 样品的纯度为
样品的纯度为________  (用含字母的式子表示)。
(用含字母的式子表示)。
 )常作漂白剂。目前工业上主要采用甲酸钠
)常作漂白剂。目前工业上主要采用甲酸钠 法制备保险粉。某小组在实验室制备保险粉并探究其性质。
法制备保险粉。某小组在实验室制备保险粉并探究其性质。实验(一)制备保险粉。
反应原理为
 ,装置如图所示(部分装置已省略)。
,装置如图所示(部分装置已省略)。
请回答下列问题:
(1)乙装置中产生的白色沉淀是
(2)实验中,先旋开分液漏斗的活塞,后通入
 ,这样操作的目的是
,这样操作的目的是(3)分离产品之前,需加入适量
 粉末,其作用是
粉末,其作用是实验(二)探究保险粉的性质。
| 实验 | 操作及现象 |
| I | 取少量产品加热,将气体通入品红溶液中,品红溶液褪色 |
| II | 少量产品加入稀硫酸,产生气体,溶液变浑浊。将气体通入品红溶液,溶液褪色 |
| III | 向酸性 溶液中加入足量产品粉末,溶液褪色 溶液中加入足量产品粉末,溶液褪色 |
 表现出的性质是
表现出的性质是A.氧化性 B.还原性 C.氧化性和还原性
写出实验III的离子方程式
实验(三)测定保险粉的纯度。
(5)称取
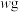 连二亚硫酸钠样品溶于水配制成
连二亚硫酸钠样品溶于水配制成 溶液,准确量取
溶液,准确量取 配制溶液于锥形瓶中,加入足量甲醛溶液,充分反应后,滴加几滴淀粉溶液,用
配制溶液于锥形瓶中,加入足量甲醛溶液,充分反应后,滴加几滴淀粉溶液,用 碘水滴定至终点时消耗滴定液为
碘水滴定至终点时消耗滴定液为 。有关反应如下:
。有关反应如下:

滴定终点的现象是
 样品的纯度为
样品的纯度为 (用含字母的式子表示)。
(用含字母的式子表示)。
您最近一年使用:0次
解题方法
8 .  (三氯化六氨合钴)属于经典配合物,实验室以
(三氯化六氨合钴)属于经典配合物,实验室以 为原料制备
为原料制备 的方法和过程如下:
的方法和过程如下:
Ⅰ.制备 。
。
已知:钴单质与氯气在加热条件下反应可制得纯净 ,钴单质在300℃以上易被氧气氧化;
,钴单质在300℃以上易被氧气氧化; 的熔点为86℃,易潮解。
的熔点为86℃,易潮解。
制备装置如图:
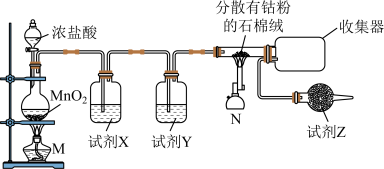
(1)试剂X是___________ ;试剂Z的作用为___________ 。
(2)上述装置制取氯气的化学方程式为___________ 。
Ⅱ.制备 ——配合、氧化。
——配合、氧化。
步骤ⅰ:在锥形瓶中,将4g 固体溶于8.4mL水中,再加入6g研细的
固体溶于8.4mL水中,再加入6g研细的 晶体,溶解得到混合溶液。
晶体,溶解得到混合溶液。
步骤ⅱ:将上述混合溶液转移至三颈烧瓶中,加入研细的活性炭和浓氨水,再逐滴加入 溶液,水浴加热至50~60℃,保持20min。然后用冰水浴冷却至0℃左右,抽滤,得粗产品。
溶液,水浴加热至50~60℃,保持20min。然后用冰水浴冷却至0℃左右,抽滤,得粗产品。
(3)滴加 时若速度过快,产物中会含有
时若速度过快,产物中会含有 杂质,原因为
杂质,原因为___________ 。
(4)水浴加热温度控制在50~60℃,温度不宜过高的原因是___________ 。
Ⅲ.测定 产品纯度。
产品纯度。
(5)用如图装置测定产品中 的含量(部分装置已省略):
的含量(部分装置已省略):

①蒸氨:取 样品(杂质不参与反应)加入过量试剂后,加热三颈烧瓶,蒸出的
样品(杂质不参与反应)加入过量试剂后,加热三颈烧瓶,蒸出的 通入盛有
通入盛有
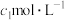
 标准溶液的锥形瓶中。液封装置2的作用是
标准溶液的锥形瓶中。液封装置2的作用是___________ 。
②滴定:将液封装置2中的水倒入锥形瓶后,使用甲基橙作指示剂,用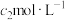
 溶液滴定剩余的
溶液滴定剩余的 ,到达滴定终点时消耗
,到达滴定终点时消耗
 溶液。滴定终点的现象为
溶液。滴定终点的现象为___________ 。
 (三氯化六氨合钴)属于经典配合物,实验室以
(三氯化六氨合钴)属于经典配合物,实验室以 为原料制备
为原料制备 的方法和过程如下:
的方法和过程如下:Ⅰ.制备
 。
。已知:钴单质与氯气在加热条件下反应可制得纯净
 ,钴单质在300℃以上易被氧气氧化;
,钴单质在300℃以上易被氧气氧化; 的熔点为86℃,易潮解。
的熔点为86℃,易潮解。制备装置如图:

(1)试剂X是
(2)上述装置制取氯气的化学方程式为
Ⅱ.制备
 ——配合、氧化。
——配合、氧化。步骤ⅰ:在锥形瓶中,将4g
 固体溶于8.4mL水中,再加入6g研细的
固体溶于8.4mL水中,再加入6g研细的 晶体,溶解得到混合溶液。
晶体,溶解得到混合溶液。步骤ⅱ:将上述混合溶液转移至三颈烧瓶中,加入研细的活性炭和浓氨水,再逐滴加入
 溶液,水浴加热至50~60℃,保持20min。然后用冰水浴冷却至0℃左右,抽滤,得粗产品。
溶液,水浴加热至50~60℃,保持20min。然后用冰水浴冷却至0℃左右,抽滤,得粗产品。(3)滴加
 时若速度过快,产物中会含有
时若速度过快,产物中会含有 杂质,原因为
杂质,原因为(4)水浴加热温度控制在50~60℃,温度不宜过高的原因是
Ⅲ.测定
 产品纯度。
产品纯度。(5)用如图装置测定产品中
 的含量(部分装置已省略):
的含量(部分装置已省略):
①蒸氨:取
 样品(杂质不参与反应)加入过量试剂后,加热三颈烧瓶,蒸出的
样品(杂质不参与反应)加入过量试剂后,加热三颈烧瓶,蒸出的 通入盛有
通入盛有
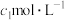
 标准溶液的锥形瓶中。液封装置2的作用是
标准溶液的锥形瓶中。液封装置2的作用是②滴定:将液封装置2中的水倒入锥形瓶后,使用甲基橙作指示剂,用
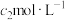
 溶液滴定剩余的
溶液滴定剩余的 ,到达滴定终点时消耗
,到达滴定终点时消耗
 溶液。滴定终点的现象为
溶液。滴定终点的现象为
您最近一年使用:0次
名校
9 . 乙酸正丁酯是一种优良的有机溶剂。通常由乙酸与正丁醇在硫酸催化下发生酯化反应来制备。
实验原理: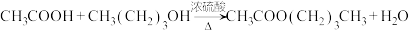
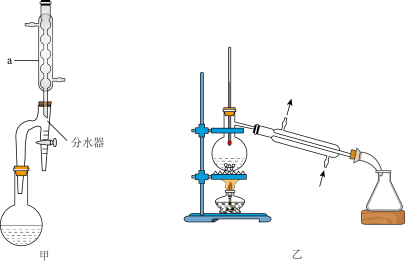
反应装置如图甲所示(夹持装置略)。
实验步骤:
①在100mL圆底烧瓶中加入9.25mL正丁醇和6mL乙酸,混匀,再加入3~4滴浓硫酸,摇匀;加入沸石,按如图装置安装仪器,加热反应一段时间;
②反应完成,停止加热;反应液冷却后,将分水器中分出的酯层和烧瓶中的反应液一起倒入分液漏斗中;
③依次用水、碳酸钠溶液、水洗涤至中性,然后将酯层倒入锥形瓶中,加少量无水硫酸镁;
④将锥形瓶中的所有物质全部转移到蒸馏烧瓶中,安装好蒸馏装置(如图乙所示,气密性良好,部分夹持装置略),加热蒸馏,收集馏分。
已知:①
②乙酸正丁酯、正丁醇和水三者可形成二元或三元恒沸混合物,当冷凝为液体时,在分水器中分为两层,下层为溶解少量酯和醇的水,可逐次分出。
回答下列问题:
(1)仪器a的名称为___________ 。实验中加入沸石的作用为___________ 。
(2)步骤②中判断反应基本完成的实验现象为___________ :与常规发生装置相比,加装分水器的优点是___________ 。
(3)步骤③中用Na2CO3溶液洗涤的主要目的是___________ 。
(4)本实验中正丁醇可能发生副反应生成其它有机物,反应的方程式为___________ 、___________ 。
(5)写出步骤④中(包括乙装置)存在的错误:___________ 。
(6)本实验中,按照正确的实验操作共收集到馏分7.3g,则产率为___________ %(保留两位有效数字)。
实验原理:
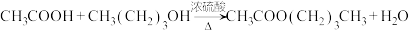
反应装置如图甲所示(夹持装置略)。
实验步骤:
①在100mL圆底烧瓶中加入9.25mL正丁醇和6mL乙酸,混匀,再加入3~4滴浓硫酸,摇匀;加入沸石,按如图装置安装仪器,加热反应一段时间;
②反应完成,停止加热;反应液冷却后,将分水器中分出的酯层和烧瓶中的反应液一起倒入分液漏斗中;
③依次用水、碳酸钠溶液、水洗涤至中性,然后将酯层倒入锥形瓶中,加少量无水硫酸镁;
④将锥形瓶中的所有物质全部转移到蒸馏烧瓶中,安装好蒸馏装置(如图乙所示,气密性良好,部分夹持装置略),加热蒸馏,收集馏分。

已知:①
| 乙酸 | 无色液体,密度1.05g·cm-3,沸点117.9℃,Mr=60 |
| 正丁醇 | 无色液体,微溶于水,沸点118℃,密度0.8g·cm-3,Mr=74 |
| 乙酸正丁酯 | 无色油状液体,不溶于水,沸点126.3℃,Mr=116 |
回答下列问题:
(1)仪器a的名称为
(2)步骤②中判断反应基本完成的实验现象为
(3)步骤③中用Na2CO3溶液洗涤的主要目的是
(4)本实验中正丁醇可能发生副反应生成其它有机物,反应的方程式为
(5)写出步骤④中(包括乙装置)存在的错误:
(6)本实验中,按照正确的实验操作共收集到馏分7.3g,则产率为
您最近一年使用:0次
2023-08-02更新
|
351次组卷
|
2卷引用:江西省乐安县第二中学2023-2024学年高三上学期开学考试化学试题
解题方法
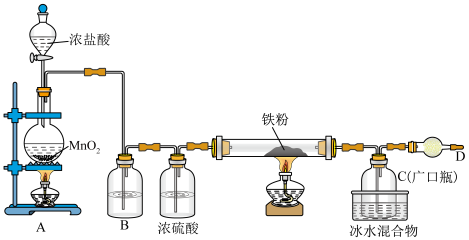
10 . 铁有两种氯化物,都是重要的化工试剂。某化学活动小组用如图所示的装置(夹持装置略去)模拟工业生产制备无水氯化铁。请回答下列问题:
查阅有关资料如下:
①氯化铁熔点为306℃,沸点为315℃;易吸收空气中的水分而潮解。
②氯化亚铁熔点为670℃,易升华。
(1)A装置中盛放浓盐酸的实验仪器名称是_______ 。
(2)A中发生反应的离子方程式为________________________________________ 。
(3)B中试剂的作用是除去氯气中的HCl气体,该试剂是_______ 。
(4)过量铁粉与氯气,加热条件下反应的化学方程式为__________________________ 。
(5)D中装的药品是碱石灰,其作用是___________________________________________ 。
(6)该小组在实验中发现稀盐酸与MnO2混合加热不生成氯气,对用稀盐酸实验没有氯气生成的原因经讨论后有如下猜想:
猜想①:是由于c(H+)低所致。
猜想②:是由于_______ 所致。
小组设计了以下实验方案进行验证:
a.稀盐酸滴入MnO2中,然后通入HCl气体加热
b.稀盐酸滴入MnO2中,然后加入NaCl固体加热
c.稀盐酸滴入MnO2中,然后加入浓硫酸加热
d.MnO2与NaCl的浓溶液混合加热
e.浓硫酸与NaCl固体、MnO2固体共热
实验现象:a、c、e有黄绿色气体生成,b、d没有黄绿色气体生成。
由此可知猜想_______ 成立。
(7)如果省略B装置进行实验,一段时间后,取装置C中的产物,按以下步骤进行测定:
①称取4.60g产物溶于过量的稀盐酸中;
②加入足量H2O2溶液;
③再加入足量NaOH溶液;
④过滤、洗涤后灼烧沉淀;
⑤称量所得红棕色固体为2.40g。
则该产物中铁元素的质量分数为_______ %(结果精确到小数点后两位)。

查阅有关资料如下:
①氯化铁熔点为306℃,沸点为315℃;易吸收空气中的水分而潮解。
②氯化亚铁熔点为670℃,易升华。
(1)A装置中盛放浓盐酸的实验仪器名称是
(2)A中发生反应的离子方程式为
(3)B中试剂的作用是除去氯气中的HCl气体,该试剂是
(4)过量铁粉与氯气,加热条件下反应的化学方程式为
(5)D中装的药品是碱石灰,其作用是
(6)该小组在实验中发现稀盐酸与MnO2混合加热不生成氯气,对用稀盐酸实验没有氯气生成的原因经讨论后有如下猜想:
猜想①:是由于c(H+)低所致。
猜想②:是由于
小组设计了以下实验方案进行验证:
a.稀盐酸滴入MnO2中,然后通入HCl气体加热
b.稀盐酸滴入MnO2中,然后加入NaCl固体加热
c.稀盐酸滴入MnO2中,然后加入浓硫酸加热
d.MnO2与NaCl的浓溶液混合加热
e.浓硫酸与NaCl固体、MnO2固体共热
实验现象:a、c、e有黄绿色气体生成,b、d没有黄绿色气体生成。
由此可知猜想
(7)如果省略B装置进行实验,一段时间后,取装置C中的产物,按以下步骤进行测定:
①称取4.60g产物溶于过量的稀盐酸中;
②加入足量H2O2溶液;
③再加入足量NaOH溶液;
④过滤、洗涤后灼烧沉淀;
⑤称量所得红棕色固体为2.40g。
则该产物中铁元素的质量分数为
您最近一年使用:0次



