1 . 下列检验离子的方法及现象描述正确的是
| A.检验Na+:将干净的铂丝蘸取少量溶液在酒精灯上灼烧,观察火焰呈浅紫色 |
B.检验 :滴入NaOH溶液后,加热,用湿润红色石蕊试纸检验发现变蓝 :滴入NaOH溶液后,加热,用湿润红色石蕊试纸检验发现变蓝 |
C.检验SO :加入 :加入 溶液出现白色沉淀,再加足量稀盐酸沉淀不溶解 溶液出现白色沉淀,再加足量稀盐酸沉淀不溶解 |
D.检验Cl-:确定溶液中无 后,加入 后,加入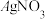 溶液出现白色沉淀 溶液出现白色沉淀 |
您最近一年使用:0次
2021-05-18更新
|
219次组卷
|
9卷引用:安徽省阜阳市2019-2020学年高一下学期开学考化学试题
安徽省阜阳市2019-2020学年高一下学期开学考化学试题安徽省阜阳市界首中学2019-2020学年高一下学期期中考试化学试题云南省玉溪市第一中学2016-2017学年高一下学期期末考试化学试题夯基提能2020届高三化学选择题对题专练——常见无机物及其性质应用——氮及其化合物(提升练习)河北省尚义一中2020-2021学年高一下学期期中考试化学试题广西浦北中学2021-2022学年高一上学期期中考试化学试题山西省芮城县陌南中学2021-2022学年高一下学期5月月考化学试题福建省漳州市华安县第一中学2022-2023学年高一上学期第一次月考化学试题河北省邯郸市魏县2021-2022学年高一上学期11月联考化学试题
2 . 对于某些离子的检验及其结论一定正确的是
A.加入稀盐酸产生无色无味气体,将气体通入石灰水中,变浑浊,一定有CO |
B.加入BaCl2溶液产生白色沉淀,再加上稀盐酸沉淀不消失,一定有SO |
C.加入足量稀盐酸无沉淀,再加BaCl2溶液有白色沉淀,一定有SO |
| D.加入Na2CO3溶液产生白色沉淀,再加稀盐酸白色沉淀消失,一定有Ba2+ |
您最近一年使用:0次
2021-04-22更新
|
211次组卷
|
21卷引用:2013-2014学年安徽省马鞍山二中高一上学期期中考试化学试卷
(已下线)2013-2014学年安徽省马鞍山二中高一上学期期中考试化学试卷(已下线)2011-2012学年北京四中高一上学期期中考试化学试卷(已下线)2012-2013学年吉林省实验中学高一上学期期末考试化学试卷(已下线)2011-2012学年浙江省苍南县灵溪二高高一第一次月考化学试卷(已下线)2013-2014学年江苏省南京市高淳区高一上学期期末考试化学试卷(已下线)2014—2015学年甘肃兰州一中高一上学期期中考试化学卷2015-2016学年宁夏育才中学高一上学期期中测试化学试卷2015-2016学年黑龙江齐齐哈尔实验中学高一上期中化学卷2015-2016学年湖北省老河口一中高一上学期期末考试化学试卷2016-2017学年新疆哈密二中高一上期中化学试卷2016-2017学年山东省济南市历城区第二中学高一下学期开学考试化学试卷【全国百强校】河南省实验中学2017-2018学年高一上学期期中考试化学试题江西省赣州市石城县石城中学2019-2020学年高一上学期期中考试化学试题高一必修第一册(鲁科2019)第2章第2节 电解质的电离 离子反应 方法帮河南省长葛市第一高级中学2020-2021学年高一上学期期中考试化学试卷题重庆实验中学2021届高三第一学月测试化学试题福建省南安市柳城中学2020-2021学年高一上学期期中考试化学试题陕西省西安市第一中学2021-2022学年高一上学期期中考试化学试题上海市久隆模范中学2021-2022学年高一上学期期中考试化学试题黑龙江省齐齐哈尔市三立高级中学2021-2022学年高一4月月考化学试题5.1.3 硫酸根离子检验、粗盐的提纯 随堂练习
3 . 下列是对某溶液进行离子检测的方法和结论,其中正确的是
A.先加入适量的硝酸酸化,再加入 溶液,产生白色沉淀,则溶液中一定含有大量的 溶液,产生白色沉淀,则溶液中一定含有大量的 |
B.加入足量的 溶液,产生白色沉淀,则溶液中一定含有大量的 溶液,产生白色沉淀,则溶液中一定含有大量的 |
C.向溶液中加 溶液,无明显变化,再加少量氯水,溶液呈血红色,则溶液中一定有 溶液,无明显变化,再加少量氯水,溶液呈血红色,则溶液中一定有 |
D.先加入适量的盐酸酸化,再加入 溶液,产生白色沉淀,则溶液中一定含有大量的 溶液,产生白色沉淀,则溶液中一定含有大量的 |
您最近一年使用:0次
名校
解题方法
4 . 下列对某溶液所含离子的检验,叙述正确的是
A.滴入 溶液和稀硝酸,产生白色沉淀,则原溶液中一定含有 溶液和稀硝酸,产生白色沉淀,则原溶液中一定含有 |
B.滴入盐酸酸化,再滴入硝酸银溶液,产生白色沉淀,则原溶液中一定含有 |
C.滴入 溶液并加热,产生能使湿润的蓝色石蕊试纸变红的气体,则原溶液中一定含有 溶液并加热,产生能使湿润的蓝色石蕊试纸变红的气体,则原溶液中一定含有 |
D.滴入 溶液无明显现象,再通入少量 溶液无明显现象,再通入少量 后呈红色,则原溶液中一定含有 后呈红色,则原溶液中一定含有 |
您最近一年使用:0次
2021-02-16更新
|
1264次组卷
|
12卷引用:安徽省滁州市定远县育才学校2021-2022学年高一上学期期末考试化学试题
安徽省滁州市定远县育才学校2021-2022学年高一上学期期末考试化学试题【全国百强校】山西省大同市第一中学2018-2019学年高一上学期期末考试化学试题(人教版2019)必修第二册 第五章 化工生产中的重要非金属元素 第二节 氮及其化合物黑龙江省双鸭山市第一中学2020-2021学年高一下学期期中考试化学试题吉林省长春市清蒲中学昆山路校区2020-2021学年高一下学期期中考试化学试题(已下线)第11练 第三章章末质量检测-2022年【寒假分层作业】高一化学(人教版2019)山东省实验中学2022-2023学年高一上学期期末考试化学试题山东省曹县第一中学 2022-2023学年高一下学期开学考试化学试题四川省内江市第六中学2022-2023学年高一下学期入学考试化学试题山东省威海市乳山市银滩高级中学2023-2024学年高一上学期12月月考化学试题第三章 实验活动2 铁及其化合物的性质 期末备考复习 2023-2024学年高一上学期化学人教版(2019)必修第一册 黑龙江省齐齐哈尔市讷河市2023-2024学年高一下学期联合考试 化学试题
5 . 下列关于常见离子的检验方法和结论,其中正确的是
| A.加入AgNO3溶液,有白色沉淀生成,证明原溶液一定有Cl− |
B.先加入BaCl2溶液,有白色沉淀生成,再加入稀盐酸沉淀不溶解,证明原溶液一定有SO |
| C.先加入KSCN溶液,无现象,再加氯水后溶液变红,证明原溶液一定有Fe2+ |
| D.加入KSCN溶液变红,证明原溶液一定有Fe3+,一定没有Fe2+ |
您最近一年使用:0次
2021-01-06更新
|
178次组卷
|
3卷引用:安徽省砀山县第二中学2020-2021学年高一上学期第二次月考化学试题
名校
6 . X溶液中可能含有下列8种离子中的几种:Fe3+、Fe2+、Na+、NH 、CO
、CO 、Cl−、SO
、Cl−、SO 、SO
、SO 。某同学为确定其成分,设计并完成以下实验(已知:Fe3+与SCN−呈血红色,且不考虑水解,所加试剂均足量):
。某同学为确定其成分,设计并完成以下实验(已知:Fe3+与SCN−呈血红色,且不考虑水解,所加试剂均足量):
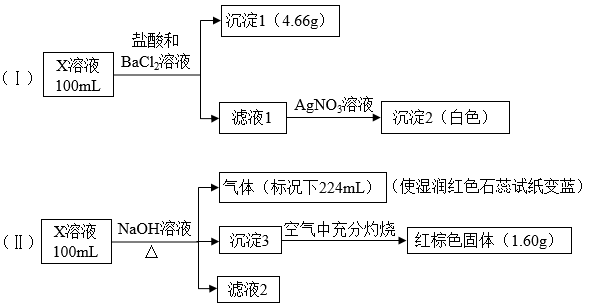
下列说法正确的是
 、CO
、CO 、Cl−、SO
、Cl−、SO 、SO
、SO 。某同学为确定其成分,设计并完成以下实验(已知:Fe3+与SCN−呈血红色,且不考虑水解,所加试剂均足量):
。某同学为确定其成分,设计并完成以下实验(已知:Fe3+与SCN−呈血红色,且不考虑水解,所加试剂均足量):
下列说法正确的是
A.X溶液中一定存在Na+、SO 、SO 、SO 、CO 、CO |
B.X溶液中一定存在NH 、Na+、SO 、Na+、SO ,至少含有Fe3+、Fe2+离子中的一种 ,至少含有Fe3+、Fe2+离子中的一种 |
| C.取少量X溶液,先加入适量氯水,再加少量KSCN溶液,若溶液呈血红色,则含有Fe2+ |
D.X溶液中一定含有Cl−,且c(Cl−)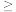 0.1mol·L−1 0.1mol·L−1 |
您最近一年使用:0次
2020-11-29更新
|
680次组卷
|
2卷引用:安徽省安庆市第一中学2020-2021学年高一上学期期中考试化学试题
7 . 下列检验方法、现象和结论均正确的是
| 序号 | 检验方法和现象 | 结论 |
| A | 向未知溶液中加入盐酸酸化BaCl2溶液,有白色沉淀生成 | 该未知溶液中一定含有SO |
| B | 向未知溶液中加入浓NaOH溶液,微热,产生能使湿润的红色石蕊试纸变蓝的气体 | 该未知溶液中一定含有NH |
| C | 向未知溶液中加入AgNO3溶液,有白色沉淀生成 | 该未知溶液中一定含有Cl– |
| D | 向未知溶液中加入盐酸,生成的气体使澄清石灰水变浑浊 | 该未知溶液中一定含有CO |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2020-09-12更新
|
154次组卷
|
2卷引用:安徽省马鞍山市2019-2020学年高一下学期期末考试化学试题
13-14高三上·上海·期中
8 . 某溶液中可能存在Br-、CO 、SO
、SO 、Al3+、I-、Mg2+、Na+七种离子中的某几种。现取该溶液进行实验,得到如下现象:
、Al3+、I-、Mg2+、Na+七种离子中的某几种。现取该溶液进行实验,得到如下现象:
①向溶液中滴加足量氯水后,溶液变橙色,且有无色气泡冒出;
②向所得橙色溶液中加入足量BaCl2溶液,无沉淀生成;
③向所得溶液中继续滴加淀粉溶液,溶液不变蓝色。
已知:5Cl2+I2+6H2O=10HCl+2HIO3
据此可以判断,该溶液中肯定不存在的离子组是( )
 、SO
、SO 、Al3+、I-、Mg2+、Na+七种离子中的某几种。现取该溶液进行实验,得到如下现象:
、Al3+、I-、Mg2+、Na+七种离子中的某几种。现取该溶液进行实验,得到如下现象:①向溶液中滴加足量氯水后,溶液变橙色,且有无色气泡冒出;
②向所得橙色溶液中加入足量BaCl2溶液,无沉淀生成;
③向所得溶液中继续滴加淀粉溶液,溶液不变蓝色。
已知:5Cl2+I2+6H2O=10HCl+2HIO3
据此可以判断,该溶液中肯定不存在的离子组是( )
A.Al3+、Mg2+、SO |
B.Mg2+、CO 、I- 、I- |
C.Al3+、SO 、I- 、I- |
D.Al3+、Br-、SO |
您最近一年使用:0次
2020-08-15更新
|
1061次组卷
|
29卷引用:安徽省宿州市灵璧中学2019-2020学年度高三上学期第三次月考化学试题
安徽省宿州市灵璧中学2019-2020学年度高三上学期第三次月考化学试题安徽省太和第一中学2021届高三上学期第一次校本教材反馈测试化学试题(已下线)2014届上海市复旦大学附属中学高三上学期期中考试化学试卷(已下线)2014届上海市闵行区高三上学期期末教学质量检测化学试卷(已下线)2014届上海复旦附中第一学期期中考试高三化学试卷湖北省沙市中学2017-2018学年高二上学期第三次双周考试化学试题湖南省衡阳市第八中学2018届高三(实验班)上学期第一次质检化学试题(已下线)2019高考备考一轮复习精品资料 第二章 化学物质及其变化 第2讲 离子反应和离子方程式【教学案】(已下线)2019年7月21日《每日一题》2020届高考一轮复习—— 每周一测山东省泰安市第一中学2020届高三10月月考化学试题上海市奉贤中学2019-2020学年高三化学10月月考试卷山东省泰安市宁阳县第一中学2020届高三上学期第二次段考化学试题(已下线)第07讲 离子共存 离子的检验和推断(精练)——2021年高考化学一轮复习讲练测苏教版(2020)高一必修第一册专题3 突破2 离子推断及鉴别人教版(2019)高一必修第一册 第一章 专题1 离子推断及鉴别湖南省邵阳市邵东县创新实验学校2021届高三上学期第一次月考化学试题湖北松滋市言程中学2020-2021学年高一上学期9月月考化学试题湖南省宁乡市第一高级中学2021届高三上学期11月摸底考试化学试题陕西省西安市长安区第一中学2020-2021学年高一上学期第二次月考化学试题(已下线)课时07 离子共存-2022年高考化学一轮复习小题多维练(全国通用)(已下线)考点04 离子反应-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点04 离子反应-备战2022年高考化学一轮复习考点帮(浙江专用)(已下线)考点04 离子反应-备战2023年高考化学一轮复习考点帮(全国通用)宁夏银川市第六中学2022-2023学年高三上学期第二次月考化学试题(已下线)第一章 化学物质及其变化 第3练 离子反应的应用(已下线)考点04 离子反应(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)上海市吴淞中学2022-2023学年高三下学期第一次月考化学试题黑龙江省鸡西实验学校2023-2024学年高三上学期开学化学试题辽宁省辽西联合校2023-2024学年高三上学期期中考试化学试题
名校
解题方法
9 . 某溶液中可能含有H+、NH 、Mg2+、 Al3+、Fe3+、CO
、Mg2+、 Al3+、Fe3+、CO 、SO
、SO 、NO
、NO 中的几种。①若加入锌粒,产生无色无味的气体;②若加入NaOH溶液,产生白色沉淀,且产生的沉淀量与加入NaOH的物质的量之间的关系如图所示。则下列说法不正确的是
中的几种。①若加入锌粒,产生无色无味的气体;②若加入NaOH溶液,产生白色沉淀,且产生的沉淀量与加入NaOH的物质的量之间的关系如图所示。则下列说法不正确的是
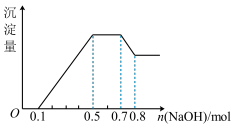
 、Mg2+、 Al3+、Fe3+、CO
、Mg2+、 Al3+、Fe3+、CO 、SO
、SO 、NO
、NO 中的几种。①若加入锌粒,产生无色无味的气体;②若加入NaOH溶液,产生白色沉淀,且产生的沉淀量与加入NaOH的物质的量之间的关系如图所示。则下列说法不正确的是
中的几种。①若加入锌粒,产生无色无味的气体;②若加入NaOH溶液,产生白色沉淀,且产生的沉淀量与加入NaOH的物质的量之间的关系如图所示。则下列说法不正确的是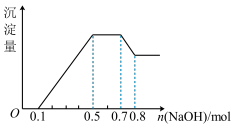
A.溶液中一定含有NH | B.溶液中一定含有Al3+ |
C.溶液中一定含有NO | D.溶液中一定含有SO |
您最近一年使用:0次
2020-07-21更新
|
562次组卷
|
2卷引用:安徽省黄山市屯溪第一中学2019-2020学年高一下学期期末考试化学试题
名校
10 . 铋酸钠(NaBiO3)是分析化学中的重要试剂,在水中缓慢分解,遇沸水或酸则迅速分解。某兴趣小组设计实验制取铋酸钠并探究其应用。回答下列问题:
Ⅰ.制取铋酸钠
制取装置如图(加热和夹持仪器已略去),部分物质性质如下:
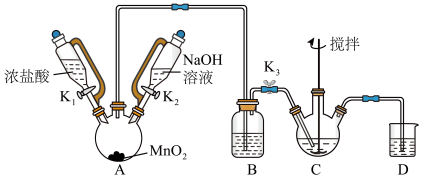
(1)C中盛放Bi(OH)3与NaOH的混合物,与Cl2反应生成NaBiO3,反应的化学方程式为__ 。B装置的作用是__ 。
(2)当观察到__ (填现象)时,可以初步判断C中反应已经完成。
(3)拆除装置前必须先除去残留的Cl2,以免污染空气。除去烧瓶A中残留Cl2的操作是:关闭__ ;打开__ 。
(4)反应结束后,为从装置C中获得尽可能多的产品,需要的操作有_ 。
Ⅱ.铋酸钠的应用——检验Mn2+
(5)往待检液中加入铋酸钠晶体,加硫酸酸化,生成Bi3+,且溶液变为紫红色,证明待检液中存在Mn2+。产生紫红色现象的离子方程式为__ 。
Ⅲ.产品纯度的测定
(6)取上述NaBiO3产品ag,加入足量稀硫酸和MnSO4稀溶液使其完全反应,再用bmol•L-1的H2C2O4标准溶液滴定生成的MnO4-(已知:H2C2O4+MnO4-—CO2+Mn2++H2O,未配平),当溶液紫红色恰好褪去时,消耗cmL标准溶液。该产品的纯度为__ (用含a、b、c的代数式表示)。
Ⅰ.制取铋酸钠
制取装置如图(加热和夹持仪器已略去),部分物质性质如下:

物质 | NaBiO3 | Bi(OH)3 |
性质 | 不溶于冷水;浅黄色 | 难溶于水;白色 |
(2)当观察到
(3)拆除装置前必须先除去残留的Cl2,以免污染空气。除去烧瓶A中残留Cl2的操作是:关闭
(4)反应结束后,为从装置C中获得尽可能多的产品,需要的操作有
Ⅱ.铋酸钠的应用——检验Mn2+
(5)往待检液中加入铋酸钠晶体,加硫酸酸化,生成Bi3+,且溶液变为紫红色,证明待检液中存在Mn2+。产生紫红色现象的离子方程式为
Ⅲ.产品纯度的测定
(6)取上述NaBiO3产品ag,加入足量稀硫酸和MnSO4稀溶液使其完全反应,再用bmol•L-1的H2C2O4标准溶液滴定生成的MnO4-(已知:H2C2O4+MnO4-—CO2+Mn2++H2O,未配平),当溶液紫红色恰好褪去时,消耗cmL标准溶液。该产品的纯度为
您最近一年使用:0次
2020-05-11更新
|
119次组卷
|
2卷引用:安徽省芜湖市示范高中2020届高三5月联考理综化学试题



