名校
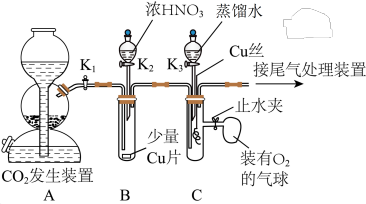
1 . 某兴趣小组设计实验验证铜与浓硝酸、稀硝酸的反应,装置如图所示(夹持装置未画出):
按图示连接好装置,_______后,装入药品,关闭 、
、 ,打开
,打开 ,一段时间后,再关闭
,一段时间后,再关闭 ,打开
,打开 ,加入足量的浓
,加入足量的浓 。
。
实验二:验证铜与稀硝酸的反应
待装置B中反应完全后……
回答下列有关问题:
(1)实验一中的横线上应填入的内容是_______ ;装置B中装浓硝酸的仪器名称是_______ 。
(2)实验一中“关闭 、
、 ,打开
,打开 ”的目的是
”的目的是_______
(3)装置B中发生反应的离子方程式为_______
(4)实验二的后续操作顺序为_______ (填标号),打开止水夹后装置C的具支试管中的现象为_______ 。
a.打开止水夹 b.打开 c.打开
c.打开 ,加入蒸馏水 d.关闭
,加入蒸馏水 d.关闭 e.插入铜丝。
e.插入铜丝。
(5)实验结束后,有同学观察到装置B中溶液呈绿色,装置C中溶液呈蓝色。小组同学认为颜色不同的原因可能如下:
猜想1:硝酸铜溶液的物质的量浓度不同,溶液颜色不同,浓度小时呈蓝色,浓度大时呈绿色。
猜想2: 溶解在硝酸铜溶液中,导致溶液颜色不同。
溶解在硝酸铜溶液中,导致溶液颜色不同。
继续实验,打开 ,一段时间后,装置B中溶液变为蓝色,说明
,一段时间后,装置B中溶液变为蓝色,说明_______ 可能成立,请设计实验验证另一猜想的可能性:_______ 。
按图示连接好装置,_______后,装入药品,关闭
 、
、 ,打开
,打开 ,一段时间后,再关闭
,一段时间后,再关闭 ,打开
,打开 ,加入足量的浓
,加入足量的浓 。
。实验二:验证铜与稀硝酸的反应
待装置B中反应完全后……
回答下列有关问题:
(1)实验一中的横线上应填入的内容是
(2)实验一中“关闭
 、
、 ,打开
,打开 ”的目的是
”的目的是(3)装置B中发生反应的离子方程式为
(4)实验二的后续操作顺序为
a.打开止水夹 b.打开
 c.打开
c.打开 ,加入蒸馏水 d.关闭
,加入蒸馏水 d.关闭 e.插入铜丝。
e.插入铜丝。(5)实验结束后,有同学观察到装置B中溶液呈绿色,装置C中溶液呈蓝色。小组同学认为颜色不同的原因可能如下:
猜想1:硝酸铜溶液的物质的量浓度不同,溶液颜色不同,浓度小时呈蓝色,浓度大时呈绿色。
猜想2:
 溶解在硝酸铜溶液中,导致溶液颜色不同。
溶解在硝酸铜溶液中,导致溶液颜色不同。继续实验,打开
 ,一段时间后,装置B中溶液变为蓝色,说明
,一段时间后,装置B中溶液变为蓝色,说明
您最近一年使用:0次
2024-06-01更新
|
393次组卷
|
4卷引用:河北省保定市名校协作体2024届高三下学期三模化学试题
名校
2 . 在医学上,氯化铵片用于治疗黏痰不易咳出症状,某化学探究活动小组为制备 并探究
并探究 的某些性质,进行了以下实验。回答下列问题:
的某些性质,进行了以下实验。回答下列问题:
步骤一:按上图所示连接装置,进行操作Ⅰ,然后向三颈烧瓶中加入8.0g粉状NaCl,再滴加浓氨水,搅拌至NaCl恰好完全溶解,停止滴加浓氨水,得到饱和氨化食盐水。
步骤二:控制一定范围温度,将 缓慢通入饱和氨化食盐水中,待有大量晶体析出时,继续通入一段时间的
缓慢通入饱和氨化食盐水中,待有大量晶体析出时,继续通入一段时间的 ,抽滤。
,抽滤。
步骤三:控制一定范围温度,向滤液中加入适量研细的NaCl,并通入 ,待析出大量晶体时,经过一系列操作,即得
,待析出大量晶体时,经过一系列操作,即得 晶体。
晶体。
已知:①几种物质的溶解度随温度变化如图所示(高于35℃时 开始分解);
开始分解);
(1)步骤一中操作Ⅰ为________________ 。
(2)装置B的作用包括除杂和________________ 。
(3)步骤二和步骤三中适宜的温度分别为________ 和________ (填字母)。步骤二中析出的晶体为________ (填化学式),继续通入 的作用是
的作用是________ 。
A.0~10℃ B.30~35℃ C.55~60℃ D.90~100℃
实验Ⅱ: 溶液的性质探究
溶液的性质探究
向0.5g镁粉中加入足量的 的
的 溶液,观察到镁粉剧烈反应,产生有刺激性气味的气体和灰白色难溶固体.活动小组进行了以下探究:
溶液,观察到镁粉剧烈反应,产生有刺激性气味的气体和灰白色难溶固体.活动小组进行了以下探究:
a.气体成分探究:用排水法(水中滴加几滴紫色石蕊溶液)收集一小试管气体。
(4)____________ (填实验操作或现象,下同),说明气体中含 ;
;________________ ,说明气体中含 。
。
b.沉淀成分探究:将灰白色固体洗净后,再加入稀 溶解,然后滴加几滴
溶解,然后滴加几滴 溶液,有白色沉淀出现。
溶液,有白色沉淀出现。
(5)结合已知信息和实验现象推测,灰白色固体应属于________ (填“混盐”、“复盐”或“碱式盐”),其化学式可能为________ 。
 并探究
并探究 的某些性质,进行了以下实验。回答下列问题:
的某些性质,进行了以下实验。回答下列问题: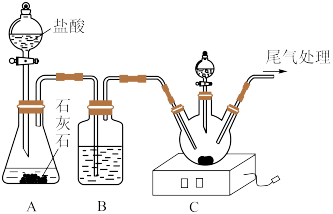

步骤一:按上图所示连接装置,进行操作Ⅰ,然后向三颈烧瓶中加入8.0g粉状NaCl,再滴加浓氨水,搅拌至NaCl恰好完全溶解,停止滴加浓氨水,得到饱和氨化食盐水。
步骤二:控制一定范围温度,将
 缓慢通入饱和氨化食盐水中,待有大量晶体析出时,继续通入一段时间的
缓慢通入饱和氨化食盐水中,待有大量晶体析出时,继续通入一段时间的 ,抽滤。
,抽滤。步骤三:控制一定范围温度,向滤液中加入适量研细的NaCl,并通入
 ,待析出大量晶体时,经过一系列操作,即得
,待析出大量晶体时,经过一系列操作,即得 晶体。
晶体。已知:①几种物质的溶解度随温度变化如图所示(高于35℃时
 开始分解);
开始分解);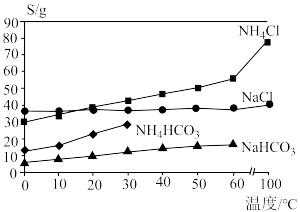
(1)步骤一中操作Ⅰ为
(2)装置B的作用包括除杂和
(3)步骤二和步骤三中适宜的温度分别为
 的作用是
的作用是A.0~10℃ B.30~35℃ C.55~60℃ D.90~100℃
实验Ⅱ:
 溶液的性质探究
溶液的性质探究向0.5g镁粉中加入足量的
 的
的 溶液,观察到镁粉剧烈反应,产生有刺激性气味的气体和灰白色难溶固体.活动小组进行了以下探究:
溶液,观察到镁粉剧烈反应,产生有刺激性气味的气体和灰白色难溶固体.活动小组进行了以下探究:a.气体成分探究:用排水法(水中滴加几滴紫色石蕊溶液)收集一小试管气体。
(4)
 ;
; 。
。b.沉淀成分探究:将灰白色固体洗净后,再加入稀
 溶解,然后滴加几滴
溶解,然后滴加几滴 溶液,有白色沉淀出现。
溶液,有白色沉淀出现。(5)结合已知信息和实验现象推测,灰白色固体应属于
您最近一年使用:0次
2024-05-31更新
|
55次组卷
|
2卷引用:河北省2024届高三下学期普通高中学业水平选择性考试化学冲刺卷(二)
名校
解题方法
3 . 某兴趣小组研究NaClO溶液与KI溶液的反应,实验记录如下:
已知:碘的化合物主要以 和
和 的形式存在。酸性条件下
的形式存在。酸性条件下 不能氧化
不能氧化 ,可以氧化
,可以氧化 。下列说法正确的是
。下列说法正确的是
| 实验编号 | 实验操作 | 实验现象 |
| Ⅰ | ⅰ.0.5 mL 0.5 NaClO溶液 NaClO溶液ⅱ.几滴淀粉溶液
| ⅰ.溶液变为浅黄色 ⅱ.溶液变蓝 |
| Ⅱ | ⅰ.0.5 mL 0.5 KI溶液 KI溶液ⅱ.几滴淀粉溶液
| ⅰ.溶液保持无色 ⅱ.溶液不变蓝,溶液的pH=10 |
 和
和 的形式存在。酸性条件下
的形式存在。酸性条件下 不能氧化
不能氧化 ,可以氧化
,可以氧化 。下列说法正确的是
。下列说法正确的是A.实验Ⅰ中,溶液变为浅黄色的原因是生成了少量的 |
| B.实验Ⅰ中,变蓝的溶液中再加入足量NaOH溶液,溶液蓝色褪去 |
| C.实验Ⅱ中,溶液不变蓝是因为NaClO具有漂白性 |
| D.实验Ⅱ中,加入过量的HI,溶液仍不会变蓝 |
您最近一年使用:0次
4 . 某实验小组在验证某些离子的性质时,做了如下实验,并对实验现象进行了相关探究。
实验 | 试剂 | 编号及现象 | |
试管 | 滴管 | ||
| 1.0 | 1.0 | Ⅰ.产生黄色沉淀,溶液无色 |
1.0 | Ⅱ.产生白色沉淀,溶液变黄 | ||
(1)通过所学知识分析,实验Ⅰ中的黄色沉淀可能是
 或
或(2)设计实验检验黄色沉淀是否含
 :取适量的黄色沉淀,
:取适量的黄色沉淀, 。故实验Ⅰ中发生反应的离子方程式为
。故实验Ⅰ中发生反应的离子方程式为(3)将适量实验Ⅱ中得到的黄色溶液加入淀粉溶液中,溶液变蓝,由此推断实验Ⅱ中产生白色沉淀的离子方程式为
(4)某同学分析实验Ⅰ、Ⅱ的现象得出结论:
 氧化性比
氧化性比 强。你认为该结论
强。你认为该结论(5)为检验
 能否氧化
能否氧化 ,设计实验Ⅲ,装置如图所示:
,设计实验Ⅲ,装置如图所示: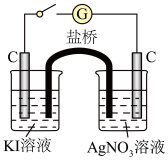
闭合开关,KI溶液变为棕黄色, 溶液中C电极上有银析出,电流计指针偏转。
溶液中C电极上有银析出,电流计指针偏转。
查阅资料:
①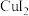 微溶于水,不稳定,在溶液中易发生氧化还原反应生成CuI、
微溶于水,不稳定,在溶液中易发生氧化还原反应生成CuI、 。
。
②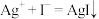
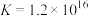 。
。
① 溶液中C电极作
溶液中C电极作
②实验Ⅲ中有Ag单质生成,而实验Ⅰ中没有,其原因可能是
您最近一年使用:0次
5 . 根据实验操作和现象,下列结论中正确的是
选项 | 实验操作和现象 | 结论 |
A | 常温下将铝片分别插入稀硝酸和浓硝酸中,前者产生无色气体,后者无明显现象 | 稀硝酸的氧化性比浓硝酸强 |
B | 向 溶液中通入 溶液中通入 ,无明显现象;再通入X气体,出现沉淀 ,无明显现象;再通入X气体,出现沉淀 | 气体X一定具有强氧化性或溶于水显碱性 |
C | 向两支分别盛有少量等物质的量的白色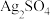 固体和黑色 固体和黑色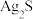 固体的试管中,同时加入等体积、等浓度的氨水,振荡,白色固体溶解,黑色固体不溶解 固体的试管中,同时加入等体积、等浓度的氨水,振荡,白色固体溶解,黑色固体不溶解 | 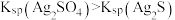 |
D | 向盛有 甲苯的试管中加入几滴酸性高锰酸钾溶液,振荡后溶液褪色 甲苯的试管中加入几滴酸性高锰酸钾溶液,振荡后溶液褪色 | 苯环受甲基影响,可被酸性高锰酸钾溶液氧化 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
6 . 回答下列问题:
(1)金属与硝酸反应通常不能生成 ,用过量3mol/L
,用过量3mol/L  与铁粉反应,
与铁粉反应, 的还原产物主要是NO,请写出反应的离子方程式:
的还原产物主要是NO,请写出反应的离子方程式:_______ 。
有同学在查阅文献时发现文献有记载: 与铁反应能产生
与铁反应能产生 。于是其小组进行了金属铁与硝酸反应能否产生
。于是其小组进行了金属铁与硝酸反应能否产生 及其有利条件的探究。
及其有利条件的探究。
实验Ⅰ:20℃,将过量铁粉溶于
 ,立即有无色气体生成,充分反应后,溶液几乎无色。
,立即有无色气体生成,充分反应后,溶液几乎无色。
(2)检验气体:方法如图所示。 ,不含NO。实验证据是
,不含NO。实验证据是_______ 。
(3)检验溶液:取上层清液,等分两份
①向一份滴加 溶液,产生
溶液,产生_______ ,说明含有 。
。
②向另一份加入 溶液,产生灰绿色沉淀;加热至沸腾,有刺激性气味气体逸出,用湿润红色石蕊试纸检验,试纸变蓝。综合①、②,说明实验Ⅰ中发生的反应有
溶液,产生灰绿色沉淀;加热至沸腾,有刺激性气味气体逸出,用湿润红色石蕊试纸检验,试纸变蓝。综合①、②,说明实验Ⅰ中发生的反应有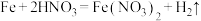 ,另外还有
,另外还有_______ (写出化学方程式)。
对 产生的原因提出假设:在稀的酸性溶液中,
产生的原因提出假设:在稀的酸性溶液中, 中
中 的氧化性大于
的氧化性大于 ,验证如下:
,验证如下:
(4)实验Ⅱ:将铜粉溶于
 。经检测,发现没有
。经检测,发现没有_______ (填化学式)生成,初步证实假设不成立。
(5)再次查阅文献发现:在酸性介质中,尽管电极电势数据显示 离子是个颇强的氧化剂,然而动力学原因导致它在稀酸中的反应一般都很慢。于是小组改变条件重复实验Ⅰ,向2mL
离子是个颇强的氧化剂,然而动力学原因导致它在稀酸中的反应一般都很慢。于是小组改变条件重复实验Ⅰ,向2mL 
 ,中加入过量铁粉,结果如下:
,中加入过量铁粉,结果如下:
经检验,实验Ⅲ、Ⅳ、Ⅴ中, 的还原产物与实验Ⅰ相同。从反应速率的角度解释温度升高
的还原产物与实验Ⅰ相同。从反应速率的角度解释温度升高 体积减少的原因
体积减少的原因_______ 。
(6)综上所述,有利于金属与硝酸反应生成氢气的条件是_______ 。
(1)金属与硝酸反应通常不能生成
 ,用过量3mol/L
,用过量3mol/L  与铁粉反应,
与铁粉反应, 的还原产物主要是NO,请写出反应的离子方程式:
的还原产物主要是NO,请写出反应的离子方程式:有同学在查阅文献时发现文献有记载:
 与铁反应能产生
与铁反应能产生 。于是其小组进行了金属铁与硝酸反应能否产生
。于是其小组进行了金属铁与硝酸反应能否产生 及其有利条件的探究。
及其有利条件的探究。实验Ⅰ:20℃,将过量铁粉溶于

 ,立即有无色气体生成,充分反应后,溶液几乎无色。
,立即有无色气体生成,充分反应后,溶液几乎无色。(2)检验气体:方法如图所示。
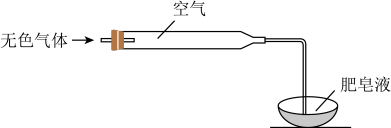
 ,不含NO。实验证据是
,不含NO。实验证据是(3)检验溶液:取上层清液,等分两份
①向一份滴加
 溶液,产生
溶液,产生 。
。②向另一份加入
 溶液,产生灰绿色沉淀;加热至沸腾,有刺激性气味气体逸出,用湿润红色石蕊试纸检验,试纸变蓝。综合①、②,说明实验Ⅰ中发生的反应有
溶液,产生灰绿色沉淀;加热至沸腾,有刺激性气味气体逸出,用湿润红色石蕊试纸检验,试纸变蓝。综合①、②,说明实验Ⅰ中发生的反应有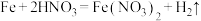 ,另外还有
,另外还有对
 产生的原因提出假设:在稀的酸性溶液中,
产生的原因提出假设:在稀的酸性溶液中, 中
中 的氧化性大于
的氧化性大于 ,验证如下:
,验证如下:(4)实验Ⅱ:将铜粉溶于

 。经检测,发现没有
。经检测,发现没有(5)再次查阅文献发现:在酸性介质中,尽管电极电势数据显示
 离子是个颇强的氧化剂,然而动力学原因导致它在稀酸中的反应一般都很慢。于是小组改变条件重复实验Ⅰ,向2mL
离子是个颇强的氧化剂,然而动力学原因导致它在稀酸中的反应一般都很慢。于是小组改变条件重复实验Ⅰ,向2mL 
 ,中加入过量铁粉,结果如下:
,中加入过量铁粉,结果如下:| 实验序号 | Ⅲ | Ⅳ | Ⅴ |
| 温度 | 20℃ | 40℃ | 60℃ |
生成 体积 体积 | 6.0mL | 3.4 mL | 2.6 mL |
 的还原产物与实验Ⅰ相同。从反应速率的角度解释温度升高
的还原产物与实验Ⅰ相同。从反应速率的角度解释温度升高 体积减少的原因
体积减少的原因(6)综上所述,有利于金属与硝酸反应生成氢气的条件是
您最近一年使用:0次
2024-02-26更新
|
430次组卷
|
3卷引用:河北省石家庄市第二中学2023-2024学年高三下学期质检二模拟化学试题
河北省石家庄市第二中学2023-2024学年高三下学期质检二模拟化学试题江西省五市九校协作体2023-2024学年高三上学期第一次联考化学试题(已下线)专题09 化学实验综合题-【好题汇编】2024年高考化学一模试题分类汇编(新高考七省专用)
名校
7 .  是一种常见的氧化剂,广泛用于生活中作消毒剂。某小组设计实验探究
是一种常见的氧化剂,广泛用于生活中作消毒剂。某小组设计实验探究 的氧化能力与介质pH的关系(已知
的氧化能力与介质pH的关系(已知 溶液呈绿色,酸性条件下发生歧化反应生成
溶液呈绿色,酸性条件下发生歧化反应生成 和
和 )。
)。
请回答下列问题:
(1)装置A中盛放 溶液的仪器名称为
溶液的仪器名称为___________ ,实验开始前应进行的操作为___________ ,装置D的作用为___________ 。
(2)装置A中浓盐酸在反应中表现出来的性质是___________ 。
(3)由实验推知,A中氧化性:
___________ (填“>”、“<”或“=”) ;若装置C中绿色溶液变为紫红色,
;若装置C中绿色溶液变为紫红色,___________ (填“能”或“不能”)根据此现象判断 的氧化性强于
的氧化性强于 。
。
(4)有关高锰酸钾的实验及现象如表所示。
①已知实验Ⅰ中氧化产物为 ,则实验Ⅰ中发生反应的离子方程式为
,则实验Ⅰ中发生反应的离子方程式为___________ 。
②实验结论:其他条件相同,介质pH越低, 氧化性越
氧化性越___________ (填“强”或“弱”)。
 是一种常见的氧化剂,广泛用于生活中作消毒剂。某小组设计实验探究
是一种常见的氧化剂,广泛用于生活中作消毒剂。某小组设计实验探究 的氧化能力与介质pH的关系(已知
的氧化能力与介质pH的关系(已知 溶液呈绿色,酸性条件下发生歧化反应生成
溶液呈绿色,酸性条件下发生歧化反应生成 和
和 )。
)。
请回答下列问题:
(1)装置A中盛放
 溶液的仪器名称为
溶液的仪器名称为(2)装置A中浓盐酸在反应中表现出来的性质是
(3)由实验推知,A中氧化性:

 ;若装置C中绿色溶液变为紫红色,
;若装置C中绿色溶液变为紫红色, 的氧化性强于
的氧化性强于 。
。(4)有关高锰酸钾的实验及现象如表所示。
| 实验 | 装置 | 试剂R(5 mL含0.1 mol·L  的溶液) 的溶液) | 现象(通入乙烯的体积相等) |
| Ⅰ | 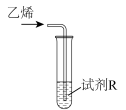 |  溶液 溶液 | 较快产生黑色沉淀 |
| Ⅱ | KOH和 溶液 溶液 | 紫红色溶液较慢变为绿色溶液 | |
| Ⅲ | 稀硫酸和 溶液 溶液 | 紫红色溶液很快变为无色溶液 |
 ,则实验Ⅰ中发生反应的离子方程式为
,则实验Ⅰ中发生反应的离子方程式为②实验结论:其他条件相同,介质pH越低,
 氧化性越
氧化性越
您最近一年使用:0次
2023-10-27更新
|
253次组卷
|
5卷引用:河北省邢台市五岳联盟2023-2024学年高三上学期10月期中考试化学试题
名校
解题方法
8 . 某学习小组探究浓、稀硝酸氧化性的相对强弱,按如图装置进行实验(夹持仪器已略去)。实验表明浓硝酸能将NO氧化成 ,而稀硝酸不能氧化NO。由此得出的结论是浓硝酸的氧化性强于稀硝酸。
,而稀硝酸不能氧化NO。由此得出的结论是浓硝酸的氧化性强于稀硝酸。

可选药品:浓硝酸、稀硝酸、蒸馏水、浓硫酸、氢氧化钠溶液。
已知:氢氧化钠溶液不与NO反应,能与 反应:
反应: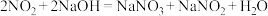 。
。
I.
(1)装置a的名称是___________ ,连接好装置后应先___________ 。
(2)装置②③④中盛放的药品依次是___________ 、___________ 、___________ 。
(3)该小组要得出“浓硝酸的氧化性强于稀硝酸”的实验结论,所依据的实验现象是装置③液面上方气体仍为无色,装置④的现象是___________ 。
Ⅱ.装置①铜片溶解,最初反应较慢,随后加快,有大量红棕色气体放出,反应后试管中溶液呈现鲜草绿色,某小组同学设计实验探究溶液呈鲜草绿色的原因之一。
【查阅资料】
i.铜与浓硝酸反应,开始生成的 溶于水生成
溶于水生成 ,
, 与
与 反应生成绿色的化合物;
反应生成绿色的化合物;
ii.金属和浓硝酸反应过程中有 生成,可大大加快金属与浓硝酸反应的速率。其原理为:
生成,可大大加快金属与浓硝酸反应的速率。其原理为:
第一步:
第二步: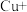 …
…
第三步: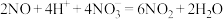
【设计实验】
分别向装有大小相同铜片的三支试管内依次加入下列试剂后,同时并记录实验现象。
(4)x=___________ 。
(5)补全中原理的第二步反应的离子方程式:___________ 。
(6)实验3中没有绿色出现的原因是___________ 。
 ,而稀硝酸不能氧化NO。由此得出的结论是浓硝酸的氧化性强于稀硝酸。
,而稀硝酸不能氧化NO。由此得出的结论是浓硝酸的氧化性强于稀硝酸。
可选药品:浓硝酸、稀硝酸、蒸馏水、浓硫酸、氢氧化钠溶液。
已知:氢氧化钠溶液不与NO反应,能与
 反应:
反应: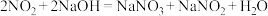 。
。I.
(1)装置a的名称是
(2)装置②③④中盛放的药品依次是
(3)该小组要得出“浓硝酸的氧化性强于稀硝酸”的实验结论,所依据的实验现象是装置③液面上方气体仍为无色,装置④的现象是
Ⅱ.装置①铜片溶解,最初反应较慢,随后加快,有大量红棕色气体放出,反应后试管中溶液呈现鲜草绿色,某小组同学设计实验探究溶液呈鲜草绿色的原因之一。
【查阅资料】
i.铜与浓硝酸反应,开始生成的
 溶于水生成
溶于水生成 ,
, 与
与 反应生成绿色的化合物;
反应生成绿色的化合物;ii.金属和浓硝酸反应过程中有
 生成,可大大加快金属与浓硝酸反应的速率。其原理为:
生成,可大大加快金属与浓硝酸反应的速率。其原理为:第一步:

第二步:
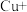 …
…第三步:
【设计实验】
分别向装有大小相同铜片的三支试管内依次加入下列试剂后,同时并记录实验现象。
| 实验 | 浓硝酸/mL | 蒸馏水/滴 | 30% /滴 /滴 | 现象 |
| 1 | 1 | 0 | 0 | 快速反应,异常剧烈,溶液为鲜草绿色 |
| 2 | 1 | 3 | 0 | 快速反应,反应剧烈,溶液为鲜草绿色 |
| 3 | 1 | 0 | x | 反应较慢,溶液为蓝色,没有绿色出现 |
(5)补全中原理的第二步反应的离子方程式:
(6)实验3中没有绿色出现的原因是
您最近一年使用:0次
2023-07-12更新
|
354次组卷
|
2卷引用:河北省保定市唐县第一中学2023-2024学年高三上学期9月月考化学试题
9 . 某化学兴趣小组同学做了探究Cl2与Na2SO3溶液反应,实验装置如下。
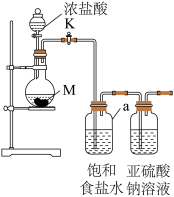
(1)装置中仪器a的名称是___________ ,饱和食盐水的作用是___________ ,发生装置的气密性检查操作方法是___________ 。
(2)试剂M是___________ (填名称)。写出制取氯气的化学方程式___________ 。
(3)该装置的不足之处___________ 。
(4)Cl2与Na2SO3溶液反应的离子方程式为___________ 。
(5)设计实验,简述实验步骤,证明洗气瓶中的Na2SO3已被氧化___________ 。

(1)装置中仪器a的名称是
(2)试剂M是
(3)该装置的不足之处
(4)Cl2与Na2SO3溶液反应的离子方程式为
(5)设计实验,简述实验步骤,证明洗气瓶中的Na2SO3已被氧化
您最近一年使用:0次
名校
解题方法
10 . 化学是以实验为基础的学科。下列根据实验操作和现象能得到相应结论的是
| 选项 | 实验操作和现象 | 结论 |
| A | 常温下,将两块相同的未经打磨的铝片分别投入5.0mL饱和的 溶液和 溶液和 溶液中,前者无明显现象,后者迅速反应,现象明显 溶液中,前者无明显现象,后者迅速反应,现象明显 |  能加速破坏铝片表面的氧化膜 能加速破坏铝片表面的氧化膜 |
| B | 常温下,向 溶液中加入 溶液中加入 溶液,将带火星的木条放在试管口,木条复燃 溶液,将带火星的木条放在试管口,木条复燃 | 氧化性: |
| C | 向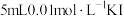 溶液中加入 溶液中加入 溶液(pH=1),溶液呈棕黄色,再滴加几滴KSCN溶液,溶液变为红色 溶液(pH=1),溶液呈棕黄色,再滴加几滴KSCN溶液,溶液变为红色 |  和 和 的反应存在限度 的反应存在限度 |
| D | 将浓盐酸和亚硫酸钠反应产生的气体通入酸性 溶液中,溶液紫红色褪去 溶液中,溶液紫红色褪去 |  具有还原性 具有还原性 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2023-06-27更新
|
492次组卷
|
6卷引用:河北省部分高中2022-2023学年高三下学期第三次模拟考试化学试题


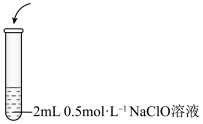

 KI溶液
KI溶液 溶液
溶液

