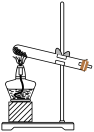
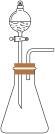
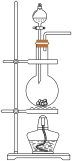
1 . 为探究Na2SO3的性质,实验小组同学进行了如下实验:

| A.③和④中产生的气体成分完全相同 | B.②和⑥中沉淀的主要成分不同 |
| C.①→②和④→⑥均只发生了复分解反应 | D. 的还原性在酸性条件下增强 的还原性在酸性条件下增强 |
您最近一年使用:0次
2023-04-06更新
|
2580次组卷
|
11卷引用:山西省晋城一中2022-2023学年高一下学期第三次调研考试化学试题
山西省晋城一中2022-2023学年高一下学期第三次调研考试化学试题北京市海淀区2022-2023学年高三下学期期中练习化学试题山东省东营市第一中学2023届高三下学期二模化学试题浙江省杭州第四中学2022-2023学年高一下学期期中考试化学试题(已下线)【2023】【高一下】【期中考】【杭四下沙】【高中化学】【罗梦宇收集】(已下线)题型35 微型成套装置实验流程(已下线)题型45 物质性质探究型综合实验天津市滨海新区2023-2024学年塘沽第一中学高三上学期第二次月考化学试题(已下线)热点19 化学微型实验北京一零一中2023-2024学年高三上学期第一次月考(开学考)化学试卷 北京市顺义区第二中学2023-2024学年高三下学期开学测化学试题
2 . 探究氮及其化合物的性质,下列方案设计、现象和结论都正确的是
| 实验方案 | 现象 | 结论 | |
| A | 常温下,将Fe片分别插入稀硝酸和浓硝酸中 | 一段时间后,前者有气体产生,后者无明显现象 | 稀硝酸的氧化性强于浓硝酸 |
| B | 将 样品溶于稀硫酸后,滴加KSCN溶液 样品溶于稀硫酸后,滴加KSCN溶液 | 溶液变红 |  晶体已氧化变质 晶体已氧化变质 |
| C | 向两个同规格烧瓶中分别装入同比例的 和 和 气体,并分别浸泡于热水和冷水中 气体,并分别浸泡于热水和冷水中 | 一段时间后,两烧瓶内颜色深浅不同 | 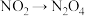 的转化存在限度 的转化存在限度 |
| D | 将盛有 固体的试管加热 固体的试管加热 | 试管底部固体消失,试管口有晶体凝结 |  固体受热易升华 固体受热易升华 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2023-11-10更新
|
1472次组卷
|
5卷引用:山西省晋中市平遥县第二中学校2023-2024学年高三上学期适应性训练四理科综合试题
山西省晋中市平遥县第二中学校2023-2024学年高三上学期适应性训练四理科综合试题浙江省温州市普通高中2024届高三上学期第一次适应性考试(一模)化学试题(已下线)热点08 表格型实验方案的设计与评价(已下线)专题03 化学实验基础-【好题汇编】2024年高考化学一模试题分类汇编(全国通用)(已下线)专题03 化学实验基础(3大题型)-【好题汇编】2024年高考化学一模试题分类汇编(浙江专用)
解题方法
3 . 在点滴板①②③三个孔穴中分别滴入3滴新制的氯水,再向②③中分别滴入3滴NaBr溶液、NaI溶液;向④⑤两个孔穴中分别滴入3滴溴水,向⑤中滴入3滴NaI溶液。下列关于该实验的说法正确的是


| A.新制氯水中水的电离程度大于纯水的 |
B.①②③可得出氧化性: |
| C.若用久置的氯水进行上述实验,实验现象与原实验现象完全相同 |
| D.上述实验中可以探究同主族元素性质的递变规律 |
您最近一年使用:0次
2023-12-24更新
|
938次组卷
|
4卷引用:山西省忻州市名校2023-2024学年高三上学期联合质量检测化学试卷
山西省忻州市名校2023-2024学年高三上学期联合质量检测化学试卷广东省部分名校2023-2024学年高三上学期联合质量检测化学试题(已下线)专题02 元素化合物 有机化合物-【好题汇编】2024年高考化学一模试题分类汇编(全国通用)(已下线)专题02 元素化合物 有机化合物-【好题汇编】2024年高考化学一模试题分类汇编(新高考七省专用)
4 . 用图所示装置进行实验,探究硝酸与铁反应的产物。
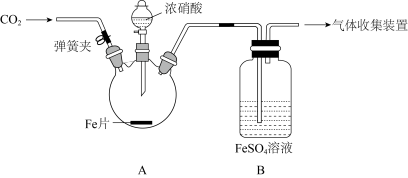
已知:FeSO4+NO=Fe(NO)SO4(棕色) ∆H<0 。
下列说法正确的是

| 主要实验操作 | 实验现象 |
| 打开弹簧夹,通入一段时间CO2后,滴入浓硝酸后无明显现象,加热烧瓶,反应开始后停止加热。 | ①A 中有红棕色气体产生,一段时间后,气体颜色逐渐变浅;反应停止后,A 中无固体剩余。 ②B 中溶液变棕色。 |
| 取少量A 中溶液,加几滴氯水,再滴入硫氰化钾溶液 | ③溶液变为红色 |
| 取少量 B 中溶液,加热 | ④B中棕色溶液变浅,有无色气体逸出,且在空气中变为红棕色 |
下列说法正确的是
| A.滴入浓硝酸加热前没有明显现象的原因是:温度低,反应速率太慢 |
| B.实验现象③说明反应后A 中溶液含有 Fe2+ |
| C.实验现象④说明 A 中有 NO 生成 |
D.可用浓 NaOH 溶液和湿润的红色石蕊试纸检验硝酸的还原产物中是否有 NH |
您最近一年使用:0次
2021-05-21更新
|
1905次组卷
|
8卷引用:山西省长治市2022届高三上学期九月份质量监测化学试题
山西省长治市2022届高三上学期九月份质量监测化学试题湖北省武汉市汉阳一中2021届高三下学期三模化学试题(已下线)第29讲 化学综合实验(精讲)-2022年一轮复习讲练测(已下线)考点12 氮及其化合物-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点12 氮及其化合物-备战2022年高考化学一轮复习考点帮(浙江专用)(已下线)专题13 氮及其化合物 (热点讲义)-2022年高三毕业班化学常考点归纳与变式演练 辽宁省实验中学2021-2022学年高一下学期期中阶段测试化学试题(已下线)第四章 非金属及其化合物 第23练 硝酸 含氮化合物的转化关系
5 . 进行乙醇的催化氧化及产物检验的实验装置如图所示,下列有关说法错误的是


A.乙醇能发生反应: |
| B.Ⅰ中左侧固体颜色按“红色→黑色→红色”变化 |
C.本实验可证明 能挥发 能挥发 |
| D.Ⅱ中很快有银镜生成 |
您最近一年使用:0次
2023-04-11更新
|
568次组卷
|
2卷引用:山西省太原师范学院附属中学、太原市师苑中学校2022-2023学年高一下学期5月月考化学试题
6 . 二氧化硫是重要的工业原料,探究其制备方法和性质具有非常重要的意义。某研究小组拟用下图装置测定SO2转化为SO3的转化率。(已知SO3熔点为16.8oC,假设气体进入装置时分别被完全吸收,且忽略空气中CO2的影响。)】

(1)仪器a的名称是___________ 。
(2)B装置的作用是干燥SO2和O2、使SO2和O2两种气体混合均匀、___________ 。
(3)D中烧杯装的液体是___________ (填“热水”或“冰水”),其作用是___________ 。
(4)当停止通入SO2,熄灭酒精灯后,需要继续通一段时间的氧气,其目的是___________ 。
(5)写出E中反应的离子方程式___________ 。
(6)实验结束后,若装置D增加的质量为72g,装置E中产生白色沉淀的质量为23.3 g,则此条件下二氧化硫的转化率是___________ 。
(7)为达同样目的,E中的Ba(NO3)2也可以用___________代替

(1)仪器a的名称是
(2)B装置的作用是干燥SO2和O2、使SO2和O2两种气体混合均匀、
(3)D中烧杯装的液体是
(4)当停止通入SO2,熄灭酒精灯后,需要继续通一段时间的氧气,其目的是
(5)写出E中反应的离子方程式
(6)实验结束后,若装置D增加的质量为72g,装置E中产生白色沉淀的质量为23.3 g,则此条件下二氧化硫的转化率是
(7)为达同样目的,E中的Ba(NO3)2也可以用___________代替
| A.足量的饱和食盐水 |
| B.足量的BaCl2溶液 |
| C.足量的Ba(OH)2溶液 |
| D.足量的BaCl2和H2O2混合溶液 |
您最近一年使用:0次
2022-03-30更新
|
461次组卷
|
3卷引用:山西省晋中市平遥县第二中学校2022-2023学年高三上学期10月质检化学试题
名校
7 . 已知:溴化铁在200°C以上易分解,煮沸水溶液也会使其分解,生成溴化亚铁和溴单质。实验室里利用如图装置制取纯净的无水FeBr3。
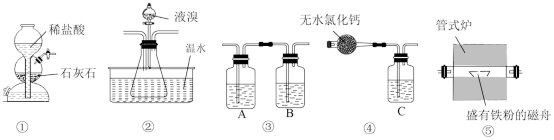
下列说法正确的是

下列说法正确的是
| A.A、B、C分别盛有饱和Na2CO3溶液、浓硫酸和烧碱溶液 |
| B.装置②中温水的作用是降低装置①中生成的CO2在液溴中的溶解度 |
| C.实验开始时,先加热管式炉,再打开装置①中活塞 |
| D.实验结束时,先停止加热并停止滴入液溴,继续通入CO2至室温 |
您最近一年使用:0次
2021-10-30更新
|
707次组卷
|
3卷引用:山西省晋城市第一中学校2023-2024学年高三上学期11月期中考试化学试题
名校
解题方法
8 . 硫和氮及其化合物性质具有多样性。回答下列问题:
(1) 固体在高温下易发生分解(
固体在高温下易发生分解(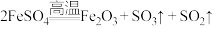 ),利用下图装置来检验分解的气态产物:
),利用下图装置来检验分解的气态产物:_______ 、_______ ,确认分解产物中存在 、
、 的现象分别为
的现象分别为_______ 、_______ 。
②装置C为尾气吸收装置,若其中盛放酸性 溶液,则反应的离子方程式为
溶液,则反应的离子方程式为_______ 。
(2)氨基钠可以用于生产 ——安全气囊气体发生剂,实验小组用下图装置来制备少量的氨基钠,已知:
——安全气囊气体发生剂,实验小组用下图装置来制备少量的氨基钠,已知: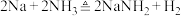 ,氨基钠极易与水剧烈反应,且易被空气氧化。
,氨基钠极易与水剧烈反应,且易被空气氧化。_______ 装置(填装置的标号)和_______ (填试剂标号)来制备氨气。
A.氯化铵固体 B.浓氨水和生石灰 C.氯化铵溶液与钠
②b装置中药品可选_______ (填选项字母)。
A.浓硫酸 B.无水氯化钙 C.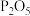 D.碱石灰
D.碱石灰
③氨基钠与水反应的化学方程式为_______ 。
④下列关于制备氨基钠实验方案正确的是_______ (填选项字母)。
A.实验开始时,为使氨气充分反应先点燃c处酒精灯,再通入氨气
B.d为尾气吸收装置,导管不伸入液面是为了防止倒吸
C.该实验方案存在缺陷,应在e、d之间再增加一个b装置或用装有无水氯化钙的干燥管替换d装置
(1)
 固体在高温下易发生分解(
固体在高温下易发生分解(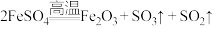 ),利用下图装置来检验分解的气态产物:
),利用下图装置来检验分解的气态产物:
 、
、 的现象分别为
的现象分别为②装置C为尾气吸收装置,若其中盛放酸性
 溶液,则反应的离子方程式为
溶液,则反应的离子方程式为(2)氨基钠可以用于生产
 ——安全气囊气体发生剂,实验小组用下图装置来制备少量的氨基钠,已知:
——安全气囊气体发生剂,实验小组用下图装置来制备少量的氨基钠,已知: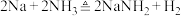 ,氨基钠极易与水剧烈反应,且易被空气氧化。
,氨基钠极易与水剧烈反应,且易被空气氧化。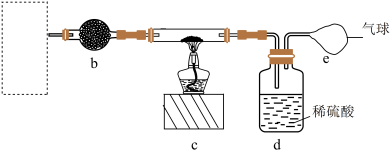
|
|
|
| f | g | h |
②b装置中药品可选
A.浓硫酸 B.无水氯化钙 C.
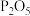 D.碱石灰
D.碱石灰③氨基钠与水反应的化学方程式为
④下列关于制备氨基钠实验方案正确的是
A.实验开始时,为使氨气充分反应先点燃c处酒精灯,再通入氨气
B.d为尾气吸收装置,导管不伸入液面是为了防止倒吸
C.该实验方案存在缺陷,应在e、d之间再增加一个b装置或用装有无水氯化钙的干燥管替换d装置
您最近一年使用:0次
2023-04-16更新
|
261次组卷
|
2卷引用:山西省大同市第一中学校2022-2023学年高一下学期5月月考化学试题
9 . 为了验证铁(一定量)与浓硫酸反应产生的气体的成分,某小组利用如图所示装置(可重复使用)进行实验(尾气处理省略)。

请回答下列问题:
(1)常温下,铁遇浓硫酸会纯化,钝化属于_______ (填“物理”或“化学”)变化。
(2)气流从左至右,装置连接顺序为A→_______ →_______ →B→_______ →_______ →_______ 。
(3)装置D中发生反应的离子方程式为_______ ,装置F的作用是_______ 。
(4)已知浓硫酸已全部加入圆底烧瓶中。随着反应的进行,浓硫酸浓度变小,装置B,D共增重48.0g(不考虑 和
和 的逸出),则刚产生
的逸出),则刚产生 时硫酸的浓度为
时硫酸的浓度为_______ 。(反应结束后圆底烧瓶中溶液体积为100mL)
(5)实验完毕后,检验烧瓶中溶液含 的试剂是
的试剂是_______ ,检验该溶液含 的实验方法是
的实验方法是_______ 。

请回答下列问题:
(1)常温下,铁遇浓硫酸会纯化,钝化属于
(2)气流从左至右,装置连接顺序为A→
(3)装置D中发生反应的离子方程式为
(4)已知浓硫酸已全部加入圆底烧瓶中。随着反应的进行,浓硫酸浓度变小,装置B,D共增重48.0g(不考虑
 和
和 的逸出),则刚产生
的逸出),则刚产生 时硫酸的浓度为
时硫酸的浓度为(5)实验完毕后,检验烧瓶中溶液含
 的试剂是
的试剂是 的实验方法是
的实验方法是
您最近一年使用:0次
2022-05-28更新
|
137次组卷
|
2卷引用:山西省晋中市榆次第一中学校2021-2022学年高一下学期5月联合考试化学试题
10 . 某学习小组为探究 与
与 的酸性强弱开展下列实验,所用装置如图所示。回答下列问题:
的酸性强弱开展下列实验,所用装置如图所示。回答下列问题:
(1)仪器 的名称为
的名称为_____ 。
(2)装置 的作用是
的作用是_____ 。
(3)装置D中盛放的试剂是_____ (填“酸性 溶液”“
溶液”“ 溶液”或“
溶液”或“ 溶液”),该装置的作用是
溶液”),该装置的作用是_____ ,发生反应的离子方程式为_____ 。
(4)通过装置E、F中的现象:_____ 可证明 的酸性强于
的酸性强于 ,用
,用 试纸测定等浓度的
试纸测定等浓度的 溶液和
溶液和 溶液的
溶液的 ,
,_____ (填“能”或“不能”)判断 与
与 的酸性强弱。
的酸性强弱。
(5)由石灰乳与 反应制备漂白粉,发生反应的化学方程式为
反应制备漂白粉,发生反应的化学方程式为_____ ,若标准状况下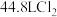 制得了
制得了 漂白粉,则漂白粉的产率为
漂白粉,则漂白粉的产率为_____  (保留两位有效数字)。
(保留两位有效数字)。
 与
与 的酸性强弱开展下列实验,所用装置如图所示。回答下列问题:
的酸性强弱开展下列实验,所用装置如图所示。回答下列问题:
(1)仪器
 的名称为
的名称为(2)装置
 的作用是
的作用是(3)装置D中盛放的试剂是
 溶液”“
溶液”“ 溶液”或“
溶液”或“ 溶液”),该装置的作用是
溶液”),该装置的作用是(4)通过装置E、F中的现象:
 的酸性强于
的酸性强于 ,用
,用 试纸测定等浓度的
试纸测定等浓度的 溶液和
溶液和 溶液的
溶液的 ,
, 与
与 的酸性强弱。
的酸性强弱。(5)由石灰乳与
 反应制备漂白粉,发生反应的化学方程式为
反应制备漂白粉,发生反应的化学方程式为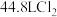 制得了
制得了 漂白粉,则漂白粉的产率为
漂白粉,则漂白粉的产率为 (保留两位有效数字)。
(保留两位有效数字)。
您最近一年使用:0次
2023-09-04更新
|
114次组卷
|
2卷引用:山西省部分学校2023-2024学年高三第一联考(月考)化学试题