1 . 高中化学学科核心素养要求进行科学探究。现对二氧化硫的性质进行深入探究。
I.实验、类比、推理是化学学习的重要方法。某课外活动小组根据 与
与 的反应,用如图所示装置探究
的反应,用如图所示装置探究 与
与 的反应,并探究其产物成分。(已知:
的反应,并探究其产物成分。(已知: 与水蒸气在加热时会发生反应)
与水蒸气在加热时会发生反应)
(1)装置B的作用之一是观察 的生成速率,为保证实验的严谨性其中的液体最好选择
的生成速率,为保证实验的严谨性其中的液体最好选择___________ (填序号)
a.饱和 溶液 b.饱和
溶液 b.饱和 溶液
溶液
c.饱和 溶液 d.浓硫酸
溶液 d.浓硫酸
(2)依据 与
与 的反应,三位同学对
的反应,三位同学对 与
与 反应的产物提出不同假设,并将装置
反应的产物提出不同假设,并将装置 中玻璃管内固体产物加入如下图所示的装置
中玻璃管内固体产物加入如下图所示的装置 中大试管,进一步设计实验探究
中大试管,进一步设计实验探究 与
与 反应的产物,若固体产物只有两种,依据充分反应后的现象,完成下列表格:
反应的产物,若固体产物只有两种,依据充分反应后的现象,完成下列表格:

为进一步验证假设③中 的存在,可将
的存在,可将 中试剂换成
中试剂换成___________ 。(填试剂的化学式)
II.某兴趣小组欲探究 与
与 的反应。
的反应。
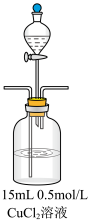
(3)甲为了确认现象II中白色沉淀的成分,进行如下探究。查阅资料:
并进行如下实验:
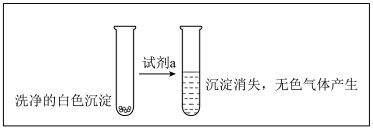
①试剂 是
是___________ 。
②现象II中生成白色沉淀的离子方程式是___________ 。
(4)乙认为实验存在干扰,欲探究纯净的 悬浊液与
悬浊液与 的反应。
的反应。
①乙过滤I中的蓝色沉淀,洗涤,取最后一次洗涤液于试管中,___________ (填操作和现象),证明已洗涤干净。再进行如下实验:
②乙预测产物是 ,取砖红色沉淀,洗涤后,
,取砖红色沉淀,洗涤后,___________ (填操作和现象),证明产物是 。
。
(5)纯净的 悬浊液与
悬浊液与 发生反应的化学方程式是
发生反应的化学方程式是___________ 。
I.实验、类比、推理是化学学习的重要方法。某课外活动小组根据
 与
与 的反应,用如图所示装置探究
的反应,用如图所示装置探究 与
与 的反应,并探究其产物成分。(已知:
的反应,并探究其产物成分。(已知: 与水蒸气在加热时会发生反应)
与水蒸气在加热时会发生反应)
(1)装置B的作用之一是观察
 的生成速率,为保证实验的严谨性其中的液体最好选择
的生成速率,为保证实验的严谨性其中的液体最好选择a.饱和
 溶液 b.饱和
溶液 b.饱和 溶液
溶液c.饱和
 溶液 d.浓硫酸
溶液 d.浓硫酸(2)依据
 与
与 的反应,三位同学对
的反应,三位同学对 与
与 反应的产物提出不同假设,并将装置
反应的产物提出不同假设,并将装置 中玻璃管内固体产物加入如下图所示的装置
中玻璃管内固体产物加入如下图所示的装置 中大试管,进一步设计实验探究
中大试管,进一步设计实验探究 与
与 反应的产物,若固体产物只有两种,依据充分反应后的现象,完成下列表格:
反应的产物,若固体产物只有两种,依据充分反应后的现象,完成下列表格:
| 假设 |  中现象 中现象 |  中现象 中现象 |
① | 固体不完全溶解,无气泡产生 | 溶液不褪色 |
② | 固体不完全溶解,且有气泡产生 | 溶液褪色 |
③ 和 和 | 固体完全溶解,且有气泡产生 |
 的存在,可将
的存在,可将 中试剂换成
中试剂换成II.某兴趣小组欲探究
 与
与 的反应。
的反应。
| 实验步骤 | 现象 |
步骤1:打开分液漏斗,向烧瓶中加入 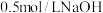 溶液 溶液 | I.有蓝色絮状沉淀,静置后分层。 |
步骤2:从左侧导管通入 气体 气体 | II.静置后分层,底部有白色沉淀 |
| 物质 | 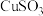 |  |  |
| 溶解性 | 不溶于水,浅黄色沉淀 | 不溶于水,白色沉淀 | 不溶于水,砖红色沉淀 |
| 性质 | 与酸反应 | 能溶于浓盐酸 | 酸性体系中不稳定,进一步反应生成Cu和 |

①试剂
 是
是②现象II中生成白色沉淀的离子方程式是
(4)乙认为实验存在干扰,欲探究纯净的
 悬浊液与
悬浊液与 的反应。
的反应。①乙过滤I中的蓝色沉淀,洗涤,取最后一次洗涤液于试管中,
| 实验 | 实验步骤 | 现象 |
 纯净的  悬浊液 悬浊液 | 从左侧导管通入 气体 气体 | III.静置后分层,上层溶液为蓝色,底部有砖红色沉淀 |
 ,取砖红色沉淀,洗涤后,
,取砖红色沉淀,洗涤后, 。
。(5)纯净的
 悬浊液与
悬浊液与 发生反应的化学方程式是
发生反应的化学方程式是
您最近一年使用:0次
2023-08-19更新
|
111次组卷
|
2卷引用:江西省宜春市丰城拖船中学2023-2024学年高二上学期开学化学试题
名校
解题方法
2 . 草酸(HOOC-COOH)是一种常见的有机酸,利用淀粉制备草酸的实验流程如图:
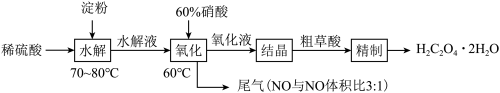
回答下列问题:
(1)“水解”时,检验淀粉是否水解完全,所用的试剂是_____ ;“水解”及“氧化”步骤中适宜的加热方式是_______ 。
(2)“氧化”时实验装置如图所示(夹持及加热装置已略):
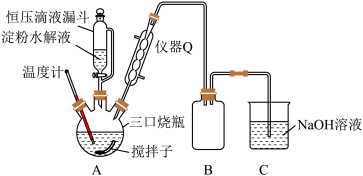
①仪器Q的名称是__________ 。
②三口(颈)烧瓶中生成H2C2O4·2H2O的化学方程式为__________ 。
③装置B的作用是________ ,装置C的作用是_________ 。
(3)已知在20℃、70℃时,草酸的溶解度依次为为9.5 g/(l00g水),84.5g/(l00g水),则粗草酸“精制”需采用的提纯方法为____ 。
(4)探究H2C2O4的性质:
①向NaHCO3溶液中加入草酸溶液,产生大量气体,可得出草酸的酸性比碳酸_____ (填“强”或“弱”)。
②向草酸中加入足量C2H5OH和适量浓硫酸加热,产生有芳香气味的油状物。该生成物为_____ (写结构简式)。

回答下列问题:
(1)“水解”时,检验淀粉是否水解完全,所用的试剂是
(2)“氧化”时实验装置如图所示(夹持及加热装置已略):

①仪器Q的名称是
②三口(颈)烧瓶中生成H2C2O4·2H2O的化学方程式为
③装置B的作用是
(3)已知在20℃、70℃时,草酸的溶解度依次为为9.5 g/(l00g水),84.5g/(l00g水),则粗草酸“精制”需采用的提纯方法为
(4)探究H2C2O4的性质:
①向NaHCO3溶液中加入草酸溶液,产生大量气体,可得出草酸的酸性比碳酸
②向草酸中加入足量C2H5OH和适量浓硫酸加热,产生有芳香气味的油状物。该生成物为
您最近一年使用:0次
2023-07-03更新
|
83次组卷
|
3卷引用:江西省宜春市丰城中学2023-2024学年高二下学期开学考试化学试题
3 . 依据下列实验得出的结论正确的是

| A.常温下,在水中苯酚的溶解度大于苯酚钠的溶解度 |
| B.酸性:乙酸>碳酸>苯酚 |
C.实验1用 溶液替代NaOH溶液现象相同 溶液替代NaOH溶液现象相同 |
D.向实验1变澄清的溶液中通入过量的 ,无明显现象 ,无明显现象 |
您最近一年使用:0次
2023-06-29更新
|
161次组卷
|
3卷引用:江西省抚州市2022-2023学年高二下学期学生学业质量监测化学试题
江西省抚州市2022-2023学年高二下学期学生学业质量监测化学试题 (已下线)专题03 烃的衍生物-【好题汇编】备战2023-2024学年高二化学下学期期末真题分类汇编(人教版2019)江苏省常州市北郊高级中学2023-2024学年高二下学期期中考试化学试题
4 . 亚硝酸钠(NaNO2)易溶于水,微溶于乙醇,可作为肉类食品的护色剂,并可以防止肉毒杆菌在肉类食品中生长,保持肉制品的结构和营养价值;但是过量摄入会导致中毒。某化学兴趣小组对亚硝酸钠进行多角度探究:
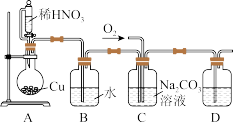
I.亚硝酸钠的制备
(1)D中澄清石灰水变浑浊,则C中制备NaNO2的离子方程式为____ 。
II.探究亚硝酸钠与硫酸反应生成的气体产物(常见氮的氧化物)
已知:①NO+NO2+2OH-=2 +H2O
+H2O
②气体液化的温度:NO2:21℃,NO:-152℃
(2)反应前应打开弹簧夹,先通入一段时间氮气,其目的是____ 。
(3)为了检验装置A中生成的气体产物,装置的连接顺序(从左→右连接):A→C→____→____→____。____
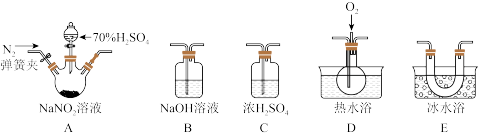
(4)关闭弹簧夹,打开分液漏斗活塞,滴入70%硫酸后,A中产生红棕色气体。
①确认A中产生的气体含有NO,依据的现象是____ 。
②装置E的作用是____ 。
③通过上述实验探究过程,可得出装置A中反应的化学方程式为____ 。
III.设计实验证明酸性条件下NaNO2具有氧化性
(5)供选用的试剂:NaNO2溶液、KMnO4溶液、FeSO4溶液、KI溶液、稀硫酸、淀粉溶液、KSCN溶液。根据提供的试剂,设计酸性条件下NaNO2具有氧化性的实验方案:____ 。

I.亚硝酸钠的制备
(1)D中澄清石灰水变浑浊,则C中制备NaNO2的离子方程式为
II.探究亚硝酸钠与硫酸反应生成的气体产物(常见氮的氧化物)
已知:①NO+NO2+2OH-=2
 +H2O
+H2O②气体液化的温度:NO2:21℃,NO:-152℃
(2)反应前应打开弹簧夹,先通入一段时间氮气,其目的是
(3)为了检验装置A中生成的气体产物,装置的连接顺序(从左→右连接):A→C→____→____→____。
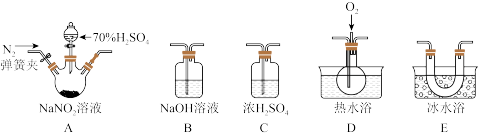
(4)关闭弹簧夹,打开分液漏斗活塞,滴入70%硫酸后,A中产生红棕色气体。
①确认A中产生的气体含有NO,依据的现象是
②装置E的作用是
③通过上述实验探究过程,可得出装置A中反应的化学方程式为
III.设计实验证明酸性条件下NaNO2具有氧化性
(5)供选用的试剂:NaNO2溶液、KMnO4溶液、FeSO4溶液、KI溶液、稀硫酸、淀粉溶液、KSCN溶液。根据提供的试剂,设计酸性条件下NaNO2具有氧化性的实验方案:
您最近一年使用:0次
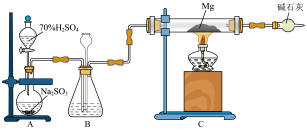
5 . 某同学设计实验探究工业制乙烯的原理和乙烯的主要化学性质,实验装置如图所示(已知烃类都不与碱反应)。

请回答下列问题:
(1)工业制乙烯的实验原理是烷烃(液态)在催化剂和加热条件下发生反应生成不饱和烃。例如,石油分馏产物之一十六烷烃发生反应: C16H34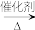 C8H18+甲,甲
C8H18+甲,甲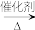 4乙,则甲的分子式为
4乙,则甲的分子式为________ ,乙的结构简式为________ 。
(2)B装置中的实验现象可能是________ 写出反应的化学方程式:________ ,其反应类型是________ 。
(3)C装置中可观察到的现象是________ ,反应类型是_________ 。
(4)查阅资料知,乙烯与酸性高锰酸钾溶液反应产生二氧化碳。根据本实验中装置________ (填装置序号)中的实验现象可判断该资料是否真实。为了探究溴与乙烯反应是加成反应而不是取代反应,可以测定装置B中溶液在反应前后的酸碱度,简述其理由:________ 。
(5)通过上述实验探究,检验甲烷和乙烯的方法是________ (填字母序号,下同);除去甲烷中乙烯的方法是________ 。
A.气体通入水中
B.气体通过盛溴水的洗气瓶
C.气体通过盛酸性高锰酸钾溶液的洗气瓶
D.气体通过氢氧化钠溶液

请回答下列问题:
(1)工业制乙烯的实验原理是烷烃(液态)在催化剂和加热条件下发生反应生成不饱和烃。例如,石油分馏产物之一十六烷烃发生反应: C16H34
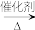 C8H18+甲,甲
C8H18+甲,甲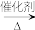 4乙,则甲的分子式为
4乙,则甲的分子式为(2)B装置中的实验现象可能是
(3)C装置中可观察到的现象是
(4)查阅资料知,乙烯与酸性高锰酸钾溶液反应产生二氧化碳。根据本实验中装置
(5)通过上述实验探究,检验甲烷和乙烯的方法是
A.气体通入水中
B.气体通过盛溴水的洗气瓶
C.气体通过盛酸性高锰酸钾溶液的洗气瓶
D.气体通过氢氧化钠溶液
您最近一年使用:0次
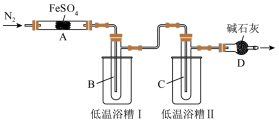
6 . 某学习小组拟研究FeSO4的分解实验探究,请你利用所学知识帮该小组完成以下实验方案。
[实验目的]探究FeSO4分解产物与温度关系。
[提出假设]
假设1:Fe2O3、SO3、SO2;假设2:FeO、SO3、SO2;假设3:Fe3O4、SO3、SO2。
[查阅资料]几种物质的物理性质如表所示。
回答下列问题:
(1)根据所学知识判断,假设2肯定不成立,理由是_______ 。
(2)实验过程中,在检查装置气密性之后点燃A处酒精灯之前的操作是_______ ,(只填操作),当A处固体完全分解后通入N2的目的是_______ 。
(3)低温浴槽I收集的物质是_______ (填化学式),低温浴槽II控制的温度范围为_______ 。
(4)甲、乙组分别进行实验,实验数据如下(不考虑损失,固体已完全分解且固体产物为纯净物):
甲组实验中A装置得到固体产物是_______ (填化学式)。
(5)为进一步确认固体产物成分,取乙组实验得到的固体溶于稀硫酸,将溶液分成两份,进行如下实验:在一份溶液中滴加铁氰化钾K3[Fe(CN)6]溶液,产生蓝色沉淀。在另一份溶液中滴加NH4SCN溶液,观察到的现象是_______ 。
[实验结论]通过上述实验,FeSO4分解产物与温度有关。
[交流反思]FeSO4分解反应中是否有O2生成?
(6)为验证实验猜想,他们设计两种方案检验O2:
方案1:将D管导出的气体通入酸化的淀粉-KI溶液中。
方案2:用带火星的木条放在D管口处。
假设过程中持续缓缓通入N2,对比以上两种方案,其中方案_______ (填“1”或“2”)可行。
[实验目的]探究FeSO4分解产物与温度关系。
[提出假设]
假设1:Fe2O3、SO3、SO2;假设2:FeO、SO3、SO2;假设3:Fe3O4、SO3、SO2。
[查阅资料]几种物质的物理性质如表所示。
| 物质 | SO3 | SO2 | O2 | N2 |
| 熔点/℃ | 16.8 | -72.4 | -218.4 | -209.9 |
| 沸点/℃ | 44.8 | -10 | -182.9 | -195.8 |

回答下列问题:
(1)根据所学知识判断,假设2肯定不成立,理由是
(2)实验过程中,在检查装置气密性之后点燃A处酒精灯之前的操作是
(3)低温浴槽I收集的物质是
(4)甲、乙组分别进行实验,实验数据如下(不考虑损失,固体已完全分解且固体产物为纯净物):
| 实验 | A处温度/℃ | FeSO4质量/g | 低温浴槽I净增质量/g | 低温浴槽II净增质量/g |
| 甲 | T1 | 3.04 | 0.80 | 0.64 |
| 乙 | T2 | 4.56 | 1.60 | 0.64 |
(5)为进一步确认固体产物成分,取乙组实验得到的固体溶于稀硫酸,将溶液分成两份,进行如下实验:在一份溶液中滴加铁氰化钾K3[Fe(CN)6]溶液,产生蓝色沉淀。在另一份溶液中滴加NH4SCN溶液,观察到的现象是
[实验结论]通过上述实验,FeSO4分解产物与温度有关。
[交流反思]FeSO4分解反应中是否有O2生成?
(6)为验证实验猜想,他们设计两种方案检验O2:
方案1:将D管导出的气体通入酸化的淀粉-KI溶液中。
方案2:用带火星的木条放在D管口处。
假设过程中持续缓缓通入N2,对比以上两种方案,其中方案
您最近一年使用:0次
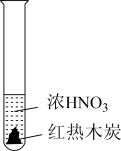
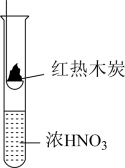
7 . 下述实验中均有红棕色气体产生,对比分析所得结论不正确的是
|
|
|
| ① | ② | ③ |
| A.由①中的红棕色气体,推断产生的气体一定是混合气体 |
| B.由②中的红棕色气体不能表明木炭与浓硝酸发生了反应 |
| C.由③说明浓硝酸具有挥发性,生成的红棕色气体为还原产物 |
| D.③的气体产物中检测出CO2,由此说明木炭一定与浓硝酸发生了反应 |
您最近一年使用:0次
2022-06-29更新
|
3788次组卷
|
82卷引用:江西省吉安市2021-2022学年高二下学期期末检测化学试题
江西省吉安市2021-2022学年高二下学期期末检测化学试题2019年上海市高中生化学竞赛初赛试题(“华理一化工杯”)初赛试题(已下线)【浙江新东方】48(已下线)【浙江新东方】【2020】【高二上】【期中】【HD-LP406】【化学】河南省洛阳市第一高级中学2016-2017学年高一6月月考化学试题2017年全国普通高等学校招生统一考试理综化学(北京卷精编版)河北省衡水中学2018届高三上学期一调考试化学试题山东省淄博第一中学2018届高三上学期开学考试化学试题四川省德阳市三校2018届高三联合测试化学试题(已下线)黄金30题系列 高一化学 小题好拿分【提升版】北京市清华大学附属中学2018届高三10月月考化学试题广西陆川县中学2018届高三12月月考化学试题北京市一零一中学2018届高三10月月考化学试题宁夏银川一中2017-2018学年高一上学期期末考试化学试题云南省峨山彝族自治县第一中学2018届高三上学期期末考试仿真化学试题黑龙江省伊春中学2017-2018学年高一化学上学期期末考试题河南省三门峡市2017-2018学年高一上学期期末考试化学试题广西陆川县中学2018届高三3月月考化学试题云南省玉溪第一中学2017-2018学年高一下学期4月月考化学试题云南省玉溪市玉溪一中2017-2018学年高一下学期4月月考化学试题(已下线)解密06 非金属及其化合物(教师版)——备战2018年高考化学之高频考点解密(已下线)2019高考备考一轮复习精品资料 第四章 常见的非金属及其化合物 第4讲 氮及其化合物【教学案】云南省玉溪市峨山一中2019届高三9月月考化学试题江苏省常州市第一中学2019届高三第一学期期初(8月)考试化学试题【全国百强校】陕西省西安市长安区第一中学2018-2019学年高一上学期期末考试化学试题【全国百强校】山西省山西大学附属中学2018-2019学年高一下学期2月模块诊断化学试题福建省泉州市泉港区第一中学2018-2019学年高一下学期期中考试化学试题百所名校联考-非金属及其化合物内蒙古包头稀土高新区二中2020届高三10月月考理综化学试题四川省绵阳市南山中学2020届高三10月月考化学试题(已下线)2019年12月11日 《每日一题》化学人教版(必修1)——硝酸的强氧化性2020届高三化学二轮冲刺新题专练——硝酸的性质及应用(提升练)贵州省黔南布依族苗族自治州龙里中学2019-2020学年高三上学期期末考试理综化学试题贵州省长顺县二中2019-2020学年高三上学期期末考试理综化学试题贵州省施秉县一中2019-2020学年高三上学期期末考试化学试题(已下线)专题3.5 氮及其化合物 -巅峰冲刺山东省2020年高考化学一轮考点扫描《2020年新高考政策解读与配套资源》福建省福州市第一中学2020年高一在线自测自评质检化学试题贵州省贵阳市第一中学2020届高三教学质量监测理科综合化学试题安徽省池州市第一中学2019-2020学年高一下学期期中教学质量检测化学试题云南省昆明市寻甸县民族中学2019-2020学年高一下学期第一次月考化学试题湖南省长沙市雅礼中学2020届高三5月高考化学模拟试卷安徽省六安市舒城中学2019-2020学年高一下学期第一次月考化学试题(已下线)专题05 元素及其化合物-2020年高考真题和模拟题化学分项汇编(已下线)第12讲 氮及其化合物-2021年高考化学一轮复习名师精讲练鲁科版(2019)高一必修第一册第三章C 高考挑战区 过高考 3年真题强化闯关高一必修第一册(鲁科2019)第3章 第3节 氮的循环 高考帮(已下线)小题必刷20 氮及其化合物——2021年高考化学一轮复习小题必刷(通用版)湖南省长沙市雅礼中学2021届高三上学期第一次月考化学试题北京一零一中2021届高三上学期第三次统练化学试题安徽省滁州市定远县重点中学2021届高三上学期11月质量检测化学试题陕西省西安市长安区第一中学2019-2020学年高一上学期期末考试化学试题专题7 第一~二单元 综合拔高练-高中化学必修第二册苏教版2019(人教版2019)必修第二册 第五章 化工生产中的重要非金属元素 第二节 氮及其化合物(已下线)【浙江新东方】高中化学20210304-015黑龙江省哈尔滨市阿城区龙涤中学2020-2021学年高一4月月考化学试题黑龙江省哈尔滨市第一六二中学校2020-2021学年高一下学期4月月考化学试题浙江省诸暨市2021届高三5月适应性考试化学试题福建省泉州科技中学2020-2021学年高一下学期期中考试化学试题(苏教版2019)必修第二册专题7 氮与社会可持续发展 C 高考挑战区安徽省芜湖市2020-2021学年高一下学期期末质量检测联考化学试题(已下线)课时23 氮及其化合物-2022年高考化学一轮复习小题多维练(全国通用)(已下线)考点12 氮及其化合物-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点12 氮及其化合物-备战2022年高考化学一轮复习考点帮(浙江专用)(已下线)第12讲 氮及其化合物(讲)— 2022年高考化学一轮复习讲练测(新教材新高考)河南部分学校2022届新高三8月份摸底联考化学试题北京市中国农业大学附属中学2020-2021学年高一上学期期末学业水平调研化学试题(已下线)专题07 常见非金属及其化合物-备战2022年高考化学学霸纠错(全国通用)课后-5.2.3 硝酸 酸雨及防治-人教2019必修第二册云南省瑞丽市第一民族中学2021-2022学年高三下学期3月月考化学试题辽宁省沈阳市第二十中学2019-2020学年高一下学期第一次月考化学试题(已下线)考点11 氮及其化合物-备战2023年高考化学一轮复习考点帮(全国通用)(已下线)第14讲 氮及其化合物(讲)-2023年高考化学一轮复习讲练测(全国通用)(已下线)第13练 氮及其化合物-2023年高考化学一轮复习小题多维练(全国通用)广东省揭阳华侨高级中学2021-2022学年高一下学期第一次阶段化学试题北京市首师附密云中学2021-2022学年高一下学期等级考化学试题山东省菏泽市单县第二中学2021-2022学年高一上学期(实验班)12月段考化学试题第四章 非金属及其化合物 第23讲 硝酸 含氮化合物的转化关系巩固训练12(已下线)题型61 硝酸、硝酸盐的性质安徽省合肥市第一中学2022-2023学年高一下学期第4次月考化学试题(已下线)考点11 氮及其化合物(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)北京市第九中学2023-2024学年高一下学期期中考试化学试题
名校
解题方法
8 . 熔融的金属锡(熔点231℃)在300℃左右能直接与氯气作用生成无水四氯化锡:Sn+2Cl2 SnCl4。纯SnCl4是无色液体(沸点114℃),在空气中极易水解生成SnO2•xH2O。某化学小组利用如图装置制备SnCl4,并对其性质进行探究。
SnCl4。纯SnCl4是无色液体(沸点114℃),在空气中极易水解生成SnO2•xH2O。某化学小组利用如图装置制备SnCl4,并对其性质进行探究。
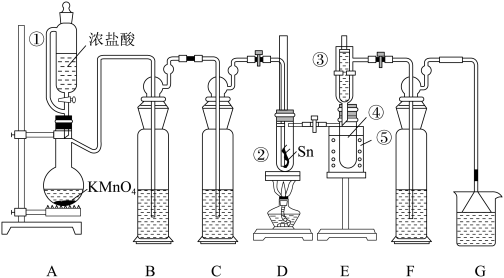
回答下列问题:
(1)装置A中烧瓶内反应的离子方程式为____ ;仪器①中导管的作用是___ 。
(2)B、C、F、G盛装的试剂应依次选用下列中的____ (填标号)。
a.浓H2SO4 b.饱和NaHCO3溶液 c.饱和NaCl溶液 d.NaOH浓溶液
(3)取少量Sn片切成丝状,放入D装置反应器②中。冷阱③和小烧杯⑤内都装入冷水,按图将仪器连接好后,再一次检验整个装置,确证系统不漏气。先打开恒压滴液漏斗活塞使反应发生,排尽装置中的空气后,再加热D装置中试管②使Sn丝熔化,并与Cl2发生反应。能说明装置中的空气被排尽的现象是____ ;生成的SnCl4经冷凝后,收集于E装置的试管④中,该液体常常呈黄绿色,原因是___ 。
(4)用玻璃棒蘸取少量产物SnCl4,放置在空气中,片刻即产生白色烟雾,产物为SnO2•xH2O和____ (填化学式)。
(5)0.500gSn完全反应,制得SnCl41.03g,产率为____ 。
 SnCl4。纯SnCl4是无色液体(沸点114℃),在空气中极易水解生成SnO2•xH2O。某化学小组利用如图装置制备SnCl4,并对其性质进行探究。
SnCl4。纯SnCl4是无色液体(沸点114℃),在空气中极易水解生成SnO2•xH2O。某化学小组利用如图装置制备SnCl4,并对其性质进行探究。
回答下列问题:
(1)装置A中烧瓶内反应的离子方程式为
(2)B、C、F、G盛装的试剂应依次选用下列中的
a.浓H2SO4 b.饱和NaHCO3溶液 c.饱和NaCl溶液 d.NaOH浓溶液
(3)取少量Sn片切成丝状,放入D装置反应器②中。冷阱③和小烧杯⑤内都装入冷水,按图将仪器连接好后,再一次检验整个装置,确证系统不漏气。先打开恒压滴液漏斗活塞使反应发生,排尽装置中的空气后,再加热D装置中试管②使Sn丝熔化,并与Cl2发生反应。能说明装置中的空气被排尽的现象是
(4)用玻璃棒蘸取少量产物SnCl4,放置在空气中,片刻即产生白色烟雾,产物为SnO2•xH2O和
(5)0.500gSn完全反应,制得SnCl41.03g,产率为
您最近一年使用:0次
2022-06-25更新
|
278次组卷
|
4卷引用:江西省宜春市丰城市2022-2023学年高二上学期期中考试化学试题
解题方法
9 . 下图是制备和研究乙炔性质的实验装置图,有关说法不正确的是
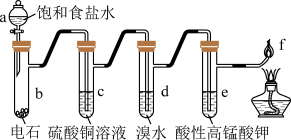

| A.d、e中溶液褪色的原理不同 |
| B.c(过量)的作用是除去影响后续实验的杂质 |
| C.用蒸馏水替代a中饱和食盐水产生的乙炔更为纯净 |
| D.f处产生明亮、伴有浓烟的火焰 |
您最近一年使用:0次
名校
解题方法
10 . 某化学小组为测定有机物G的组成和结构,设计如图实验装置:
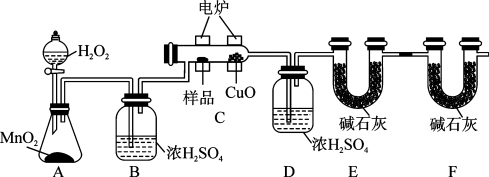
回答下列问题:
(1)实验开始时,先打开分液漏斗活塞,一段时间后再加热反应管C,目的是_______ 。
(2)装置B和装置D中浓硫酸的作用分别是_______ 和_______ 。
(3)装置E和装置F中碱石灰的作用分别是_______ 和_______ 。
(4)若准确称取2.2g样品G(只含C、H、O三种元素),经充分燃烧后(CuO的作用是确保有机物充分氧化,最终生成CO2和H2O),装置D质量增加1.8g,U形管E质量增加4.4g。又知有机物G的质谱图如图所示。

该有机物的分子式为_______ 。
(5)已知有机物G中含有羧基,经测定其核磁共振氢谱有3组峰,且峰面积之比为1:1:6。综上所述,G的结构简式为_______ 。

回答下列问题:
(1)实验开始时,先打开分液漏斗活塞,一段时间后再加热反应管C,目的是
(2)装置B和装置D中浓硫酸的作用分别是
(3)装置E和装置F中碱石灰的作用分别是
(4)若准确称取2.2g样品G(只含C、H、O三种元素),经充分燃烧后(CuO的作用是确保有机物充分氧化,最终生成CO2和H2O),装置D质量增加1.8g,U形管E质量增加4.4g。又知有机物G的质谱图如图所示。

该有机物的分子式为
(5)已知有机物G中含有羧基,经测定其核磁共振氢谱有3组峰,且峰面积之比为1:1:6。综上所述,G的结构简式为
您最近一年使用:0次
2022-05-28更新
|
322次组卷
|
9卷引用:江西省铜鼓中学2022-2023学年高二下学期4月月考化学试题
江西省铜鼓中学2022-2023学年高二下学期4月月考化学试题陕西省西安市长安区第一中学2020-2021学年高二上学期期末考试化学(理)试题(已下线)1.2 研究有机化合物的一般方法(B级能力练)-2020-2021学年高二化学章节分层检测ABC(人教版2019选择性必修3)(已下线)专题二 研究有机化合物的一般方法-2020-2021学年高二《新题速递·化学》(人教版2019选择性必修3)2月刊 (同步课堂必刷题)(已下线)1.2.2 确定有机化合物的实验式与分子结构-2020-2021学年高二化学课时同步练(人教版2019选择性必修3)湖北省部分示范高中六校联考2021-2022学年高二下学期期中考试化学试题广东省广州市第十六中学2022-2023学年高二下学期5月月考化学试题江苏省盐城市响水中学2021-2022学年高一下学期第二次学情分析考试化学试题安徽省蚌埠市第二中学2022-2023学年高一上学期第一次月考化学试题