名校
1 . 在处理NO废气的过程中,催化剂 会逐渐失活变为
会逐渐失活变为 。某小组为解决这一问题,实验研究
。某小组为解决这一问题,实验研究 和
和 之间的相互转化。
之间的相互转化。
资料:i.
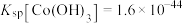
ii.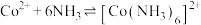
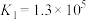
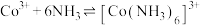
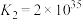
iii. 和
和 在酸性条件下均能生成
在酸性条件下均能生成
(1)探究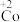 的还原性
的还原性
实验I.粉红色的 溶液或
溶液或 溶液在空气中久置,无明显变化。
溶液在空气中久置,无明显变化。
实验II.向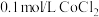 溶液中滴入2滴酸性
溶液中滴入2滴酸性 溶液,无明显变化。
溶液,无明显变化。
实验III.按下图装置进行实验,观察到电压表指针偏转。 可以被酸性
可以被酸性 溶液氧化。
溶液氧化。
乙同学补充实验Ⅳ,___________ (补全实验操作及现象),否定了该观点。
②探究碱性条件下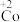 的还原性,进行实验。
的还原性,进行实验。
实验Ⅴ.___________ 。
③根据氧化还原反应规律解释还原性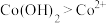 :
: 在碱性条件下,
在碱性条件下, 与
与 、
、 反应,使
反应,使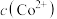 和
和 均降低,但
均降低,但___________ 降低的程度更大,还原剂的还原性增强。
(2)探究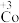 的氧化性
的氧化性
根据实验Ⅲ和Ⅳ推测氧化性: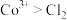 ,设计实验证明:向Ⅴ中得到的棕褐色沉淀中,
,设计实验证明:向Ⅴ中得到的棕褐色沉淀中,___________ (补全实验操作及现象),反应的离子方程式是___________ 。
(3)催化剂 的失活与再生
的失活与再生
①结合数据解释 能被氧化为
能被氧化为 而失活的原因:
而失活的原因:___________ 。
③根据以上实验,设计物质转化流程图 实现 的再生:
的再生:___________ 。
示例: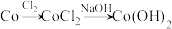 。
。
 会逐渐失活变为
会逐渐失活变为 。某小组为解决这一问题,实验研究
。某小组为解决这一问题,实验研究 和
和 之间的相互转化。
之间的相互转化。资料:i.
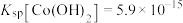
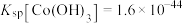
ii.
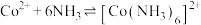
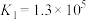
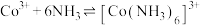
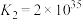
iii.
 和
和 在酸性条件下均能生成
在酸性条件下均能生成
(1)探究
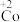 的还原性
的还原性实验I.粉红色的
 溶液或
溶液或 溶液在空气中久置,无明显变化。
溶液在空气中久置,无明显变化。实验II.向
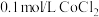 溶液中滴入2滴酸性
溶液中滴入2滴酸性 溶液,无明显变化。
溶液,无明显变化。实验III.按下图装置进行实验,观察到电压表指针偏转。

 可以被酸性
可以被酸性 溶液氧化。
溶液氧化。乙同学补充实验Ⅳ,
②探究碱性条件下
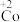 的还原性,进行实验。
的还原性,进行实验。实验Ⅴ.

③根据氧化还原反应规律解释还原性
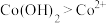 :
: 在碱性条件下,
在碱性条件下, 与
与 、
、 反应,使
反应,使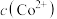 和
和 均降低,但
均降低,但(2)探究
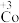 的氧化性
的氧化性根据实验Ⅲ和Ⅳ推测氧化性:
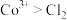 ,设计实验证明:向Ⅴ中得到的棕褐色沉淀中,
,设计实验证明:向Ⅴ中得到的棕褐色沉淀中,(3)催化剂
 的失活与再生
的失活与再生①结合数据解释
 能被氧化为
能被氧化为 而失活的原因:
而失活的原因:③根据以上实验,设计物质转化
 的再生:
的再生:示例:
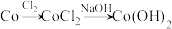 。
。
您最近一年使用:0次
2 . 某化学小组对卤代烷在不同溶剂中发生反应的情况进行实验探究。
【实验1】取一支试管,滴入15滴溴乙烷,加入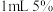 的NaOH溶液,振荡后放入盛有热水的烧杯中水浴加热。片刻后,取分层后的上层水溶液,滴入另一支盛有稀硝酸的试管中,再加入2滴
的NaOH溶液,振荡后放入盛有热水的烧杯中水浴加热。片刻后,取分层后的上层水溶液,滴入另一支盛有稀硝酸的试管中,再加入2滴 溶液。溶液出现浑浊。
溶液。溶液出现浑浊。
【实验2】向圆底烧瓶中加入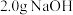 和
和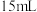 无水乙醇,搅拌,再加入
无水乙醇,搅拌,再加入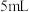 1-溴丁烷和几片碎瓷片,微热(液体沸腾后,移开酒精灯),产生的气体通过试管A后,再通入盛有酸性
1-溴丁烷和几片碎瓷片,微热(液体沸腾后,移开酒精灯),产生的气体通过试管A后,再通入盛有酸性 溶液的B试管。紫红色逐渐褪去。
溶液的B试管。紫红色逐渐褪去。
请回答:
(1)实验1中,溴乙烷发生水解反应的化学方程式是________ 。
(2)实验1中,试管中盛有稀硝酸的目的是________ 。
(3)已知:溴乙烷的沸点: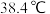 ,1-溴丁烷的沸点:
,1-溴丁烷的沸点:
①由微粒间作用解释溴乙烷和1-溴丁烷沸点差异的原因是________ 。
②有同学用溴乙烷代替1-溴丁烷进行实验2,发现酸性 溶液不褪色。由已知沸点差异分析实验失败的可能原因:
溶液不褪色。由已知沸点差异分析实验失败的可能原因:________ 。
(4)对比实验1和实验2所用试剂,有利于消去反应发生的外部条件,除了碱性试剂外,还要求________ (填“强极性”或“弱极性”)试剂。
(5)实验2检验出反应产物有丁烯,仍不能说明该条件下没有发生取代反应。若进一步检验是否生成1-丁醇,可采用的如下方法是________ (填序号)。
a.对产物进行红外光谱分析
b.对产物进行核磁共振氢谱分析
c.使反应混合物与金属钠反应
(6)研究表明,除了外部条件,卤代烷的自身结构特点也决定了反应的趋向。伯卤代烷(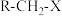 )优先发生取代反应,叔卤代烷(
)优先发生取代反应,叔卤代烷( )优先发生消去反应。写出2-溴-2-甲基丙烷发生消去反应的化学方程式:
)优先发生消去反应。写出2-溴-2-甲基丙烷发生消去反应的化学方程式:________ 。
【实验1】取一支试管,滴入15滴溴乙烷,加入
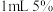 的NaOH溶液,振荡后放入盛有热水的烧杯中水浴加热。片刻后,取分层后的上层水溶液,滴入另一支盛有稀硝酸的试管中,再加入2滴
的NaOH溶液,振荡后放入盛有热水的烧杯中水浴加热。片刻后,取分层后的上层水溶液,滴入另一支盛有稀硝酸的试管中,再加入2滴 溶液。溶液出现浑浊。
溶液。溶液出现浑浊。【实验2】向圆底烧瓶中加入
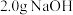 和
和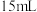 无水乙醇,搅拌,再加入
无水乙醇,搅拌,再加入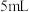 1-溴丁烷和几片碎瓷片,微热(液体沸腾后,移开酒精灯),产生的气体通过试管A后,再通入盛有酸性
1-溴丁烷和几片碎瓷片,微热(液体沸腾后,移开酒精灯),产生的气体通过试管A后,再通入盛有酸性 溶液的B试管。紫红色逐渐褪去。
溶液的B试管。紫红色逐渐褪去。请回答:
(1)实验1中,溴乙烷发生水解反应的化学方程式是
(2)实验1中,试管中盛有稀硝酸的目的是
(3)已知:溴乙烷的沸点:
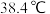 ,1-溴丁烷的沸点:
,1-溴丁烷的沸点:
①由微粒间作用解释溴乙烷和1-溴丁烷沸点差异的原因是
②有同学用溴乙烷代替1-溴丁烷进行实验2,发现酸性
 溶液不褪色。由已知沸点差异分析实验失败的可能原因:
溶液不褪色。由已知沸点差异分析实验失败的可能原因:(4)对比实验1和实验2所用试剂,有利于消去反应发生的外部条件,除了碱性试剂外,还要求
(5)实验2检验出反应产物有丁烯,仍不能说明该条件下没有发生取代反应。若进一步检验是否生成1-丁醇,可采用的如下方法是
a.对产物进行红外光谱分析
b.对产物进行核磁共振氢谱分析
c.使反应混合物与金属钠反应
(6)研究表明,除了外部条件,卤代烷的自身结构特点也决定了反应的趋向。伯卤代烷(
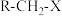 )优先发生取代反应,叔卤代烷(
)优先发生取代反应,叔卤代烷( )优先发生消去反应。写出2-溴-2-甲基丙烷发生消去反应的化学方程式:
)优先发生消去反应。写出2-溴-2-甲基丙烷发生消去反应的化学方程式:
您最近一年使用:0次
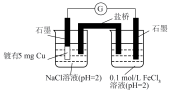
3 . 兴趣小组查阅文献后,设计实验对苯酚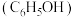 的性质进行探究,回答以下问题。
的性质进行探究,回答以下问题。
已知:ⅰ. 25℃,相关弱酸的电离平衡常数如下:Ka1(H2CO3)=4.2×10−7,Ka2(H2CO3)=5.6×10−11,Ka(C6H5OH)=1.3×10−10。
ⅱ.苯酚与 显色反应的化学方程式为:Fe3++6C6H5OH
显色反应的化学方程式为:Fe3++6C6H5OH [Fe(C6H5O)6]3−(紫色)+6H+。
[Fe(C6H5O)6]3−(紫色)+6H+。
Ⅰ.探究苯酚酸性的强弱
(1)苯酚的电离方程式为___________ 。
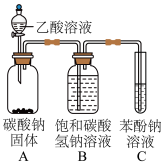
(2)兴趣小组按如图装置进行实验,证明酸性强弱顺序为CH3COOH>H2CO3> C6H5OH,所依据的实验现象为___________ ,C中反应的化学方程式为___________ 。
兴趣小组对以上实验的现象提出猜想。
猜想1: 对铁离子与苯酚的反应有促进作用。
对铁离子与苯酚的反应有促进作用。
猜想2: 对铁离子与苯酚的反应有抑制作用。
对铁离子与苯酚的反应有抑制作用。
(3)向实验1反应后溶液中继续加入 固体,若溶液颜色无变化,则可得出的结论是
固体,若溶液颜色无变化,则可得出的结论是___________ 。
(4)向实验1反应后溶液中加入___________ 固体(填化学式),若溶液颜色变为浅紫色,说明猜想2成立。
(5)兴趣小组同学提出猜想3:溶液的 会影响显色效果,并设计如下实验进行验证。
会影响显色效果,并设计如下实验进行验证。
①实验4中生成的红褐色沉淀是___________ (填化学式)。
②实验5中滴加盐酸至过量,溶液由紫色变为浅黄色,结合平衡移动原理解释原因___________ 。
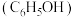 的性质进行探究,回答以下问题。
的性质进行探究,回答以下问题。已知:ⅰ. 25℃,相关弱酸的电离平衡常数如下:Ka1(H2CO3)=4.2×10−7,Ka2(H2CO3)=5.6×10−11,Ka(C6H5OH)=1.3×10−10。
ⅱ.苯酚与
 显色反应的化学方程式为:Fe3++6C6H5OH
显色反应的化学方程式为:Fe3++6C6H5OH [Fe(C6H5O)6]3−(紫色)+6H+。
[Fe(C6H5O)6]3−(紫色)+6H+。Ⅰ.探究苯酚酸性的强弱
(1)苯酚的电离方程式为
(2)兴趣小组按如图装置进行实验,证明酸性强弱顺序为CH3COOH>H2CO3> C6H5OH,所依据的实验现象为
| 实验1 | 实验2 |
|
|
猜想1:
 对铁离子与苯酚的反应有促进作用。
对铁离子与苯酚的反应有促进作用。猜想2:
 对铁离子与苯酚的反应有抑制作用。
对铁离子与苯酚的反应有抑制作用。(3)向实验1反应后溶液中继续加入
 固体,若溶液颜色无变化,则可得出的结论是
固体,若溶液颜色无变化,则可得出的结论是(4)向实验1反应后溶液中加入
(5)兴趣小组同学提出猜想3:溶液的
 会影响显色效果,并设计如下实验进行验证。
会影响显色效果,并设计如下实验进行验证。| 实验 | 操作 | 现象 |
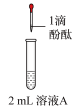
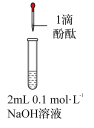
| 3 | 向2mL苯酚溶液(调节 )中滴加0.1mol/LFeCl3溶液 )中滴加0.1mol/LFeCl3溶液 | 溶液显紫色 |
| 4 | 向2mL苯酚溶液(调节 )中滴加0.1mol/LFeCl3溶液 )中滴加0.1mol/LFeCl3溶液 | 生成红褐色沉淀 |
| 5 | 向实验4所得悬浊液中逐滴加入0.1mol/L盐酸至过量 | 沉淀逐渐溶解,溶液变为紫色;继续滴加盐酸,溶液由紫色变为浅黄色 |
②实验5中滴加盐酸至过量,溶液由紫色变为浅黄色,结合平衡移动原理解释原因
您最近一年使用:0次
2024-04-26更新
|
185次组卷
|
2卷引用:北京市北京大学附属中学2023-2024学年高二下学期期中考试化学试题
名校
4 . 某研究小组探究酸碱性对 和
和 反应的影响。
反应的影响。
资料: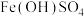 为黄色固体,难溶于水,可溶于酸。
为黄色固体,难溶于水,可溶于酸。
Ⅰ.无外加酸碱时,实验如下。
实验ⅰ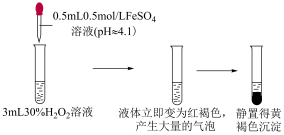
实验ⅱ
(1)根据_____ ,可证实实验ⅰ中红褐色液体为胶体。
(2)已知黄褐色沉淀中有 ,还可能存在
,还可能存在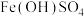 ,设计实验证实
,设计实验证实_____ 。(填操作和现象)
(3)结合化学用语,解释无外加酸碱时反应结束后 降低的原因
降低的原因_____ 。
Ⅱ.外加酸碱条件下,实验如下。
(4)根据实验ⅲ,推测立即产生大量气体的原因。
猜想一: 催化
催化 分解。
分解。
猜想二:_____ 。
设计实验_____ ,证实猜想一不是立即产生大量气体的主要原因。
(5) 是产生氧气的主要微粒。请结合反应机理分析酸性条件下产生气体少的原因
是产生氧气的主要微粒。请结合反应机理分析酸性条件下产生气体少的原因_____ 。
主要反应机理:
注: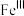 代表
代表 的化合价为+3
的化合价为+3
(6)已知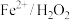 体系在废水净化中,具有一般化学氧化法无法比拟的优势,主要是由于
体系在废水净化中,具有一般化学氧化法无法比拟的优势,主要是由于 有强氧化性,根据以上实验探究,配制该体系最好控制在
有强氧化性,根据以上实验探究,配制该体系最好控制在_____ 条件下。
 和
和 反应的影响。
反应的影响。资料:
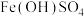 为黄色固体,难溶于水,可溶于酸。
为黄色固体,难溶于水,可溶于酸。Ⅰ.无外加酸碱时,实验如下。
实验ⅰ

实验ⅱ

(1)根据
(2)已知黄褐色沉淀中有
 ,还可能存在
,还可能存在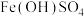 ,设计实验证实
,设计实验证实(3)结合化学用语,解释无外加酸碱时反应结束后
 降低的原因
降低的原因Ⅱ.外加酸碱条件下,实验如下。
| 实验编号 | 实验操作 | 现象 |
| ⅲ | 取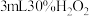 溶液于试管中,滴加 溶液于试管中,滴加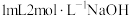 溶液,再滴加 溶液,再滴加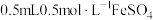 溶液 溶液 | 液体变为红褐色,立即产生大量气体,有液体喷出试管,最终产生大量红褐色沉淀 |
| ⅳ | 取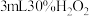 溶液于试管中,滴加 溶液于试管中,滴加 稀硫酸,再滴加 稀硫酸,再滴加 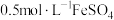 溶液 溶液 | 溶液呈黄色,有少量气泡产生,静置无沉淀产生 |
(4)根据实验ⅲ,推测立即产生大量气体的原因。
猜想一:
 催化
催化 分解。
分解。猜想二:
设计实验
(5)
 是产生氧气的主要微粒。请结合反应机理分析酸性条件下产生气体少的原因
是产生氧气的主要微粒。请结合反应机理分析酸性条件下产生气体少的原因主要反应机理:
①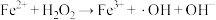 | ② ( ( 的水解) 的水解) |
③ | ④ |
⑤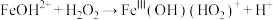 | ⑥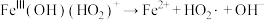 |
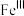 代表
代表 的化合价为+3
的化合价为+3(6)已知
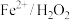 体系在废水净化中,具有一般化学氧化法无法比拟的优势,主要是由于
体系在废水净化中,具有一般化学氧化法无法比拟的优势,主要是由于 有强氧化性,根据以上实验探究,配制该体系最好控制在
有强氧化性,根据以上实验探究,配制该体系最好控制在
您最近一年使用:0次
2024-01-21更新
|
124次组卷
|
2卷引用:北京市丰台区2023-2024学年高二上学期期末考试化学试题
名校
解题方法
5 . 某小组探究Cu与 的反应,进行如下实验。
的反应,进行如下实验。
已知: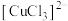 (无色)
(无色) (白色)
(白色)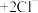
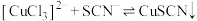 (白色)
(白色)
(1)Ⅰ、Ⅱ中,反应后的溶液均变为蓝色,推测有 生成。分别取少量反应后的溶液,滴加
生成。分别取少量反应后的溶液,滴加 溶液,均产生蓝色沉淀。Ⅰ中反应的离子方程式是
溶液,均产生蓝色沉淀。Ⅰ中反应的离子方程式是_______ 。
(2)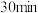 内,Cu被氧化的反应速率:Ⅰ
内,Cu被氧化的反应速率:Ⅰ_______ Ⅱ(填“>”“<”或“=”)。
(3)研究Ⅱ的反应过程,设计如下装置进行实验。不同时间取左侧烧杯中的溶液,滴加 溶液,取样时间与实验现象如下(不考虑
溶液,取样时间与实验现象如下(不考虑 的作用)。
的作用)。
经检验,白色沉淀为 。ⅰ~ⅳ中,分别取右侧烧杯中的溶液,滴加
。ⅰ~ⅳ中,分别取右侧烧杯中的溶液,滴加 溶液,溶液红色依次变浅。
溶液,溶液红色依次变浅。
① 溶液的浓度是
溶液的浓度是_______ 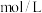 。
。
②根据ⅰ、ⅱ中“产生白色沉淀”“溶液红色变浅”,推测Cu转化为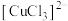 ,Cu与
,Cu与 溶液反应的离子方程式是
溶液反应的离子方程式是_______ 。
③由ⅲ、ⅳ可知,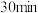 后主要反应的离子方程式是
后主要反应的离子方程式是_______ 。
(4)对比Ⅰ和Ⅱ,结合ⅰ~ⅳ, 在Cu与
在Cu与 反应中的作用是
反应中的作用是_______ 。
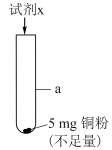
(5)研究 的浓度对铜粉溶解的影响,进行如下实验。
的浓度对铜粉溶解的影响,进行如下实验。
a中加入的试剂x为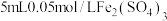 和
和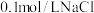 的混合溶液。充分反应后,铜粉有少量剩余,溶液变为蓝色,有少量白色沉淀,经检验白色沉淀是
的混合溶液。充分反应后,铜粉有少量剩余,溶液变为蓝色,有少量白色沉淀,经检验白色沉淀是 。则铜粉未完全溶解的原因是
。则铜粉未完全溶解的原因是_______ 。
 的反应,进行如下实验。
的反应,进行如下实验。已知:
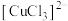 (无色)
(无色) (白色)
(白色)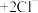
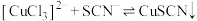 (白色)
(白色)
| 序号 | 试剂x | 实验现象 |
| Ⅰ | 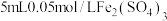 溶液 溶液 | 溶液变为浅蓝色,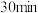 时,铜粉有较多剩余 时,铜粉有较多剩余 | |
| Ⅱ | 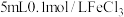 溶液 溶液 | 溶液变为蓝色,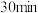 时,铜粉完全溶解 时,铜粉完全溶解 |
(1)Ⅰ、Ⅱ中,反应后的溶液均变为蓝色,推测有
 生成。分别取少量反应后的溶液,滴加
生成。分别取少量反应后的溶液,滴加 溶液,均产生蓝色沉淀。Ⅰ中反应的离子方程式是
溶液,均产生蓝色沉淀。Ⅰ中反应的离子方程式是(2)
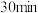 内,Cu被氧化的反应速率:Ⅰ
内,Cu被氧化的反应速率:Ⅰ(3)研究Ⅱ的反应过程,设计如下装置进行实验。不同时间取左侧烧杯中的溶液,滴加
 溶液,取样时间与实验现象如下(不考虑
溶液,取样时间与实验现象如下(不考虑 的作用)。
的作用)。
| 序号 | 取样时间/min | 现象 |
| ⅰ | 1 | 产生白色沉淀 | |
| ⅱ | 10 | 产生白色沉淀,较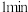 时量多 时量多 | |
| ⅲ | 30 | 产生白色沉淀,较 时量少 时量少 | |
| ⅳ | 40 | 无白色沉淀产生 |
 。ⅰ~ⅳ中,分别取右侧烧杯中的溶液,滴加
。ⅰ~ⅳ中,分别取右侧烧杯中的溶液,滴加 溶液,溶液红色依次变浅。
溶液,溶液红色依次变浅。①
 溶液的浓度是
溶液的浓度是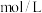 。
。②根据ⅰ、ⅱ中“产生白色沉淀”“溶液红色变浅”,推测Cu转化为
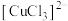 ,Cu与
,Cu与 溶液反应的离子方程式是
溶液反应的离子方程式是③由ⅲ、ⅳ可知,
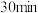 后主要反应的离子方程式是
后主要反应的离子方程式是(4)对比Ⅰ和Ⅱ,结合ⅰ~ⅳ,
 在Cu与
在Cu与 反应中的作用是
反应中的作用是(5)研究
 的浓度对铜粉溶解的影响,进行如下实验。
的浓度对铜粉溶解的影响,进行如下实验。a中加入的试剂x为
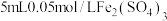 和
和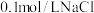 的混合溶液。充分反应后,铜粉有少量剩余,溶液变为蓝色,有少量白色沉淀,经检验白色沉淀是
的混合溶液。充分反应后,铜粉有少量剩余,溶液变为蓝色,有少量白色沉淀,经检验白色沉淀是 。则铜粉未完全溶解的原因是
。则铜粉未完全溶解的原因是
您最近一年使用:0次
2024-01-20更新
|
152次组卷
|
2卷引用:北京市第一七一中学2023-2024学年高二下学期3月月考化学试题
名校
6 . 某小组分别进行如下3组实验研究 与
与 的反应,实验记录如下:
的反应,实验记录如下:
已知:水溶液中, 为白色沉淀,
为白色沉淀,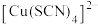 呈黄色。
呈黄色。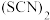 被称为“拟卤素”。
被称为“拟卤素”。
下列说法不正确的是
 与
与 的反应,实验记录如下:
的反应,实验记录如下:| 序号 | 实验 | 试剂 | 现象 |
| ① | 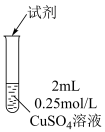 | 1滴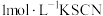 溶液 溶液 | 溶液迅速变绿,未见白色沉淀生成; 静置2小时后底部有少量白色沉淀 |
| ② | 先加入5滴 溶液,再加入1滴 溶液,再加入1滴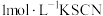 溶液 溶液 | 溶液变红,未见白色沉淀生成 | |
| ③ | 先加入5滴 溶液,再加入1滴 溶液,再加入1滴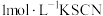 溶液 溶液 | 溶液变红,同时迅速生成白色沉淀,振荡后红色消失 |
 为白色沉淀,
为白色沉淀,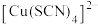 呈黄色。
呈黄色。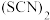 被称为“拟卤素”。
被称为“拟卤素”。下列说法不正确的是
A.①中生成白色沉淀的原因是: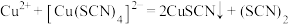 |
| B.由①可推知:①中生成配合物反应的反应速率大于氧化还原反应的 |
C.由②③可推知,结合 的能力: 的能力: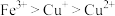 |
D.由①③可推知: 促进了 促进了 转化为 转化为 |
您最近一年使用:0次
2024-01-19更新
|
342次组卷
|
4卷引用:北京市第五中学2023-2024学年高二下学期开学考试化学试题
名校
7 . 某化学小组对卤代烷在不同条件下发生反应的情况进行实验探究。
[实验1]取一支试管,滴入15滴溴乙烷,加入1mL5%的NaOH溶液,振荡后放入盛有热水的烧杯中水浴加热。片刻后,取分层后的上层水溶液,滴入另一支盛有___________的试管中,再加入2滴AgNO3溶液。溶液出现浑浊。
[实验2]向圆底烧瓶中加入2.0gNaOH和15mL无水乙醇,搅拌,再加入5mL1-溴丁烷和几片碎瓷片,微热(液体沸腾后,移开酒精灯),产生的气体通过盛有___________试管A后,再通入盛有酸性KMnO4溶液的B试管。紫红色逐渐褪去。
请回答:
(1)补全试剂:实验1中___________ ,实验2中___________ 。溴乙烷发生水解反应的化学方程式是___________ 。
(2)已知:溴乙烷的沸点:38.4℃,1-溴丁烷的沸点:101.6℃
①由微粒间作用解释溴乙烷和1-溴丁烷沸点差异的原因是___________ 。
②有同学用溴乙烷代替1-溴丁烷进行实验2,发现酸性KMnO4溶液不褪色。由已知沸点差异分析实验失败的可能原因:___________ 。
(3)对比实验1和实验2所用试剂,有利于卤代烃消去反应发生的外部条件,除了弱极性溶剂外,还需要相对较___________ (填“高”或“低”)的温度。
(4)实验2检验出反应产物有丁烯,仍不能说明该条件下没有发生取代反应。若进一步检验是否生成1-丁醇,可采用的如下方法是___________ (填序号)。
a.使反应混合物与金属钠反应
b.对产物进行质谱分析
c.对产物进行核磁共振氢谱分析
(5)研究表明,除了外部条件,卤代烷的自身结构特点也决定了反应的趋向。伯卤代烷(R-CH2-X)优先发生取代反应,叔卤代烷(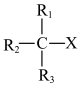 )优先发生消去反应。写出2-甲基-2-溴丙烷发生消去反应的化学方程式:
)优先发生消去反应。写出2-甲基-2-溴丙烷发生消去反应的化学方程式:___________ 。
[实验1]取一支试管,滴入15滴溴乙烷,加入1mL5%的NaOH溶液,振荡后放入盛有热水的烧杯中水浴加热。片刻后,取分层后的上层水溶液,滴入另一支盛有___________的试管中,再加入2滴AgNO3溶液。溶液出现浑浊。
[实验2]向圆底烧瓶中加入2.0gNaOH和15mL无水乙醇,搅拌,再加入5mL1-溴丁烷和几片碎瓷片,微热(液体沸腾后,移开酒精灯),产生的气体通过盛有___________试管A后,再通入盛有酸性KMnO4溶液的B试管。紫红色逐渐褪去。
请回答:
(1)补全试剂:实验1中
(2)已知:溴乙烷的沸点:38.4℃,1-溴丁烷的沸点:101.6℃
①由微粒间作用解释溴乙烷和1-溴丁烷沸点差异的原因是
②有同学用溴乙烷代替1-溴丁烷进行实验2,发现酸性KMnO4溶液不褪色。由已知沸点差异分析实验失败的可能原因:
(3)对比实验1和实验2所用试剂,有利于卤代烃消去反应发生的外部条件,除了弱极性溶剂外,还需要相对较
(4)实验2检验出反应产物有丁烯,仍不能说明该条件下没有发生取代反应。若进一步检验是否生成1-丁醇,可采用的如下方法是
a.使反应混合物与金属钠反应
b.对产物进行质谱分析
c.对产物进行核磁共振氢谱分析
(5)研究表明,除了外部条件,卤代烷的自身结构特点也决定了反应的趋向。伯卤代烷(R-CH2-X)优先发生取代反应,叔卤代烷(
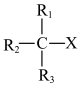 )优先发生消去反应。写出2-甲基-2-溴丙烷发生消去反应的化学方程式:
)优先发生消去反应。写出2-甲基-2-溴丙烷发生消去反应的化学方程式:
您最近一年使用:0次
8 . I.有机物种类繁多,性质多种多样。下列十种物质:①C2H5OH ②CH3CHO ③CH3COOH ④HOCH2CH2OH ⑤HOCH2(CHOH)4CHO⑥蛋白质 ⑦淀粉 ⑧油脂 ⑨酚醛树脂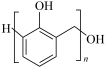 ⑩塑料
⑩塑料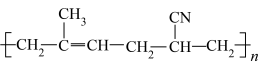
(1)①~③中,沸点最高的是
(2)①~④中能发生缩合聚合反应的是
(3)①~⑤中含有手性碳原子的是
(4)属于天然高分子的是
(5)⑨单体为
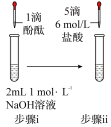
II.某同学为验证酸性:醋酸>碳酸>苯酚,经仔细考虑,设计如下实验装置,请回答下列问题:
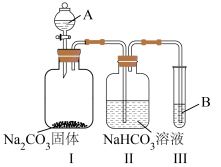
①醋酸溶液 ②CH3COONa溶液 ③苯酚溶液 ④苯酚钠溶液
(7)装置II中饱和NaHCO3溶液的作用
(8)能证明三种酸的酸性强弱的现象
(9)写出装置Ⅲ中发生反应的离子方程式
您最近一年使用:0次
名校
解题方法
9 . 研究小组探究 与水反应。取
与水反应。取 粉末加入到
粉末加入到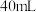 水中,充分反应得溶液A(溶液体积几乎无变化),进行以下实验。
水中,充分反应得溶液A(溶液体积几乎无变化),进行以下实验。
下列说法不正确的是
 与水反应。取
与水反应。取 粉末加入到
粉末加入到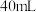 水中,充分反应得溶液A(溶液体积几乎无变化),进行以下实验。
水中,充分反应得溶液A(溶液体积几乎无变化),进行以下实验。编号 | ① | ② | ③ | ④ |
操作 |
|
|
|
|
现象 | 溶液变红色,20秒后褪色 | ⅰ.产生大量能使带火星木条复燃的气体 ⅱ.溶液变红色,10分钟后褪色 | ⅰ.溶液变红色,10分钟后溶液褪色 ⅱ.变红色 | 溶液变红色,2小时后无明显变化 |
A.由②中现象ⅰ可知, 与水反应有 与水反应有 生成 生成 |
B.由③、④可知,②中溶液红色褪去是因为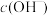 大 大 |
C.由②、③、④可知,①中溶液红色褪去的主要原因不是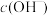 大 大 |
D.向①中褪色后的溶液中滴加5滴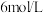 盐酸,溶液最终变成红色 盐酸,溶液最终变成红色 |
您最近一年使用:0次
2023-12-15更新
|
147次组卷
|
21卷引用:北京市第一○一中学2023-2024学年高二上学期12月统练四化学试题
北京市第一○一中学2023-2024学年高二上学期12月统练四化学试题北京市第一○一中学2023-2024学年高二上学期12月统练四化学试题北京市海淀区2021届高三上学期期中考试化学试题北京师范大学附属实验中学2020-2021学年高一上学期期末考试化学试题北京一零一中学2021-2022学年高三上学期 9月开学练习化学试题北京交通大学附属中学2021-2022学年高一上学期期中考试化学试题(已下线)北京市第四中学2022-2023学年高一上学期期中考试化学试题北京市首都师范大学附属中学2022-2023学年高一上学期12月月考化学试题北京师范大学附属实验中学2021-2022学年高一上学期1月期末测试化学试题北京市第八中学2022-2023学年高一下学期期末考试化学试题北京市清华大学附属中学2023-2024学年高三上学期开学考试化学(A)试题北京市第二十中学2023-2024学年高一上学期期中考试化学试题北京市日坛中学2023-2024学年高一上学期期中考试化学试题北京师范大学燕化附属中学2023-2024学年高一上学期期中考试化学试卷北京市第一五九中学2023-2024学年高一上学期期中考试化学试题安徽省示范高中培优联盟2020-2021学年高一上学期冬季联赛化学试题四川省德阳市德阳五中2021-2022学年高一上学期期末考试化学试题福建省厦门外国语学校2023-2024学年高一上学期10月第一次月考化学试题天津市第一中学2023-2024学年高一上学期11月期中化学试题河南省唐河县鸿唐高级中学2023-2024学年高三上学期9月月考化学试题山东省菏泽市郓城县第一中学2023-2024学年高一上学期9月月考化学试题
名校
10 . 实验小组同学探究用新制氢氧化铜检验葡萄糖的适宜条件。
资料:ⅰ.葡萄糖在碱的作用下,可以生成黄色物质;随着温度升高,可聚合为颜色更深(如棕色)的聚合物。
ⅱ.Cu2O、CuO均溶于氨水,生成 、
、 ;Cu不溶于氨水。
;Cu不溶于氨水。
(1)探究NaOH溶液的用量对该反应的影响。
①实验Ⅱ中,葡萄糖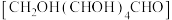 转化为
转化为___________ 。
②分析实验Ⅱ能生成砖红色沉淀但实验Ⅰ不能生成砖红色沉淀的原因:
a.电极反应式:
ⅰ.还原反应:
ⅱ.氧化反应:___________ 。
b.依据电极反应式分析实验Ⅱ有砖红色沉淀生成的可能原因:随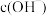 增大,
增大, 氧化性减弱,但是
氧化性减弱,但是___________ 。
(2)探究葡萄糖溶液的用量和水浴温度(加热时间约1min,冷却后过滤)对该反应的影响。
①经检验,实验Ⅳ中产生的黑色沉淀中含有Cu。检验方法是:取实验Ⅳ中70℃时产生的沉淀,洗涤,___________ (填操作和现象)。
②分析实验Ⅲ未产生黑色Cu的原因,同学提出两种假设:
假设a:葡萄糖物质的量少,无法将Cu(Ⅱ)还原为Cu单质。
假设b:___________ (补充完整)。
经定量分析可知假设a不成立。
(3)综合以上实验,用新制氢氧化铜检验葡萄糖时,为了能更好地观察到试管内产生砖红色沉淀,将宜采用的条件填入下表。
资料:ⅰ.葡萄糖在碱的作用下,可以生成黄色物质;随着温度升高,可聚合为颜色更深(如棕色)的聚合物。
ⅱ.Cu2O、CuO均溶于氨水,生成
 、
、 ;Cu不溶于氨水。
;Cu不溶于氨水。(1)探究NaOH溶液的用量对该反应的影响。
编号 | 实验Ⅰ | 实验Ⅱ |
| 实验方案 |
|
|
| 实验现象 | 加热,无明显现象,静置后未见砖红色沉淀 | 加热、静置后,底部有砖红色沉淀 |
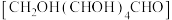 转化为
转化为②分析实验Ⅱ能生成砖红色沉淀但实验Ⅰ不能生成砖红色沉淀的原因:
a.电极反应式:
ⅰ.还原反应:

ⅱ.氧化反应:
b.依据电极反应式分析实验Ⅱ有砖红色沉淀生成的可能原因:随
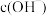 增大,
增大, 氧化性减弱,但是
氧化性减弱,但是(2)探究葡萄糖溶液的用量和水浴温度(加热时间约1min,冷却后过滤)对该反应的影响。
编号 | 实验Ⅲ | 实Ⅳ |
| 实验方案 |
|
|
温度 | 现象 | |
50℃ | 得到较多砖红色沉淀;滤液呈极浅黄色 | 得到大量砖红色沉淀;滤液呈浅橙色 |
70℃ | 得到较多砖红色沉淀;滤液呈棕黄色 | 得到大量砖红色沉淀并伴有少量黑色沉淀;滤液呈棕色 |
100℃ | 得到较多砖红色沉淀;滤液呈红棕色 | 得到大量黑色沉淀;滤液呈深棕色 |
②分析实验Ⅲ未产生黑色Cu的原因,同学提出两种假设:
假设a:葡萄糖物质的量少,无法将Cu(Ⅱ)还原为Cu单质。
假设b:
经定量分析可知假设a不成立。
(3)综合以上实验,用新制氢氧化铜检验葡萄糖时,为了能更好地观察到试管内产生砖红色沉淀,将宜采用的条件填入下表。
| 温度/℃ | NaOH溶液 | 葡萄糖溶液 | |
| 条件 | 2mL10%NaOH溶液 |
您最近一年使用:0次
2023-07-12更新
|
293次组卷
|
7卷引用:北京朝阳区2022-2023学年高二下学期期末考试化学试题
北京朝阳区2022-2023学年高二下学期期末考试化学试题(已下线)高二化学期末押题卷01-【好题汇编】备战2023-2024学年高二化学下学期期末真题分类汇编(北京专用)(已下线)专题04 有机实验-【好题汇编】备战2023-2024学年高二化学下学期期末真题分类汇编(北京专用)(已下线)题型突破02 有机实验(综合题)-【好题汇编】备战2023-2024学年高二化学下学期期末真题分类汇编(北京专用)北京市顺义牛栏山第一中学2023-2024学年高三上学期10月月考化学试题名校期末好题汇编-生物大分子(非选择题)(已下线)题型05 有机实验分析-【好题汇编】备战2023-2024学年高二化学下学期期末真题分类汇编(人教版2019)