名校
解题方法
1 . 某学习小组为验证浓硝酸能将NO氧化成NO2,而稀硝酸不能氧化NO,设计如图装置进行实验(夹持仪器已略去)。【查阅资料】:NO与NaOH溶液不反应,NO2与NaOH溶液能反应(反应的化学方程式为2NO2+2NaOH=NaNO3+NaNO2+H2O)。
备选药品:浓硝酸、3mol·L-1稀硝酸、蒸馏水、浓硫酸、NaOH溶液及CO2气体。回答下列问题。
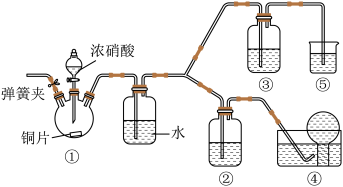
(1)连接好装置,滴加浓硝酸之前的操作依次是:____________ ,加入药品,打开装置①中的弹簧夹后通入CO2一段时间,关闭弹簧夹,将装置④中导管末端伸入倒置的烧瓶内。通入CO2的目的是____________ 。
(2)若用质量分数为70%浓硝酸(密度为1.42g·cm-3)配制250mL3mol·L-1的稀硝酸,除量筒、烧杯、胶头滴管外,还要用到的玻璃仪器有____________ 、____________ 。
(3)装置①中发生反应的化学方程式为____________ 。
(4)装置①中产生的气体通过盛有水的洗气瓶时发生反应的化学方程式为____________ 。
(5)根据实验设计,装置②中盛放的试剂是____________ 。
(6)做实验时应避免有害气体排放到空气中,装置⑤中盛放的药品是____________ 。
(7)验证浓硝酸能将NO氧化成NO2,而稀硝酸不能氧化NO的实验现象是____________ 。
备选药品:浓硝酸、3mol·L-1稀硝酸、蒸馏水、浓硫酸、NaOH溶液及CO2气体。回答下列问题。

(1)连接好装置,滴加浓硝酸之前的操作依次是:
(2)若用质量分数为70%浓硝酸(密度为1.42g·cm-3)配制250mL3mol·L-1的稀硝酸,除量筒、烧杯、胶头滴管外,还要用到的玻璃仪器有
(3)装置①中发生反应的化学方程式为
(4)装置①中产生的气体通过盛有水的洗气瓶时发生反应的化学方程式为
(5)根据实验设计,装置②中盛放的试剂是
(6)做实验时应避免有害气体排放到空气中,装置⑤中盛放的药品是
(7)验证浓硝酸能将NO氧化成NO2,而稀硝酸不能氧化NO的实验现象是
您最近一年使用:0次
2020-05-16更新
|
384次组卷
|
3卷引用:陕西省渭南市蒲城县2021-2022学年高二下学期期末对抗赛化学试题
2 . “84”消毒液的成分是NaClO,某化学研究性学习小组在实验室制备NaClO并探究其性质。
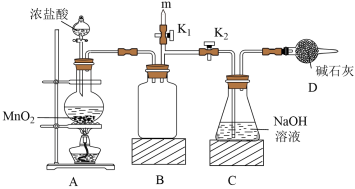
(1)该学习小组用如图装置进行实验(部分夹持装置略去),反应一段时间后,取C瓶中的溶液进行实验,测得溶液的pH=12。
(查阅资料:饱和NaClO溶液pH为11)。
回答下列问题:
①装置A中发生反应的离子方程式为_______________________________ 。
②B装置的作用是__________________ 。
③C瓶溶液中的溶质是NaCl、______________ (填化学式)。
(2)实验结束后,在m处最好连接盛________ (填“NaOH溶液”或“水”)的注射器,然后打开K1关闭K2,最后再拆除装置。
(3)测定C瓶溶液中NaClO含量的实验步骤如下:
步骤1:将C瓶溶液加入硫酸酸化,加入过量KI溶液,塞紧瓶塞并在暗处充分反应后滴入5~6滴淀粉溶液。
步骤2:分两次各取步骤1的溶液20mL于锥形瓶中,用0.1000mol·L-1Na2S2O3标准溶液滴定,滴定终点时两次耗Na2S2O3溶液体积的平均值为16.00mL。(已知:I2+2S2O32-=2I-+S4O62-)
①步骤1的C瓶中发生反应的离子方程式为:___________________________________ 。
②滴定终点的现象为______________________________________________________ 。
③塞紧瓶塞并在暗处反应的原因是_____________________________________ 。
④C瓶溶液中NaClO含量为____________ g·L-1。
⑤若盛Na2S2O3标准溶液的滴定管未用Na2S2O3标准溶液润洗,则测得C瓶溶液中NaClO含量__________ (填“偏大”、“偏小”或“不变”)。
(1)该学习小组用如图装置进行实验(部分夹持装置略去),反应一段时间后,取C瓶中的溶液进行实验,测得溶液的pH=12。

(查阅资料:饱和NaClO溶液pH为11)。
回答下列问题:
①装置A中发生反应的离子方程式为
②B装置的作用是
③C瓶溶液中的溶质是NaCl、
(2)实验结束后,在m处最好连接盛
(3)测定C瓶溶液中NaClO含量的实验步骤如下:
步骤1:将C瓶溶液加入硫酸酸化,加入过量KI溶液,塞紧瓶塞并在暗处充分反应后滴入5~6滴淀粉溶液。
步骤2:分两次各取步骤1的溶液20mL于锥形瓶中,用0.1000mol·L-1Na2S2O3标准溶液滴定,滴定终点时两次耗Na2S2O3溶液体积的平均值为16.00mL。(已知:I2+2S2O32-=2I-+S4O62-)
①步骤1的C瓶中发生反应的离子方程式为:
②滴定终点的现象为
③塞紧瓶塞并在暗处反应的原因是
④C瓶溶液中NaClO含量为
⑤若盛Na2S2O3标准溶液的滴定管未用Na2S2O3标准溶液润洗,则测得C瓶溶液中NaClO含量
您最近一年使用:0次
3 . 小明很喜欢化学实验课,今天要学习“探究铁及其化合物的氧化性或还原性”。
(1)实验前小明预测Fe2+既有还原性又有氧化性。你认为他预测的依据是_______________ 。
(2)小明欲用实验证明他的预测。实验室提供了下列试剂:3%的过氧化氢溶液、锌粒、铜片、0.1 mol·L-1氯化亚铁溶液、硫氰化钾溶液、新制氯水。
①若小明计划在0.1 mol·L-1氯化亚铁溶液滴入新制氯水,探究Fe2+的还原性,你预计可能发生的反应的离子方程式是______________________________ ,可能观察到的现象是溶液由浅绿色变为________ 色。
②实验中,小明发现现象不太明显,老师分析可能是产物的含量太低,建议可以通过检验Fe2+被氧化的产物Fe3+的存在以获取证据。你认为可选_________ 滴入小明所得的混合液中,并通过溶液出现______ 色的现象,证明小明的观点和实验方案都是正确的。
③对于证明Fe2+具有氧化性,小明认为金属单质都具有还原性,并分别将铜片、锌粒投入氯化亚铁溶液中,结果铜片没变化,锌粒逐渐变小。由此说明三种金属的还原性由强至弱的顺序为__________ (填化学式)。
④实际上Fe2+的还原性较强,实验室的氯化亚铁溶液常因氧化而变质,除去杂质的方法是______ ,相关反应的离子方程式是_____________ 。
(1)实验前小明预测Fe2+既有还原性又有氧化性。你认为他预测的依据是
(2)小明欲用实验证明他的预测。实验室提供了下列试剂:3%的过氧化氢溶液、锌粒、铜片、0.1 mol·L-1氯化亚铁溶液、硫氰化钾溶液、新制氯水。
①若小明计划在0.1 mol·L-1氯化亚铁溶液滴入新制氯水,探究Fe2+的还原性,你预计可能发生的反应的离子方程式是
②实验中,小明发现现象不太明显,老师分析可能是产物的含量太低,建议可以通过检验Fe2+被氧化的产物Fe3+的存在以获取证据。你认为可选
③对于证明Fe2+具有氧化性,小明认为金属单质都具有还原性,并分别将铜片、锌粒投入氯化亚铁溶液中,结果铜片没变化,锌粒逐渐变小。由此说明三种金属的还原性由强至弱的顺序为
④实际上Fe2+的还原性较强,实验室的氯化亚铁溶液常因氧化而变质,除去杂质的方法是
您最近一年使用:0次
2018-05-06更新
|
434次组卷
|
7卷引用:陕西省渭南市华州区咸林中学2021-2022学年高一上学期第三阶段质量检测化学试题
陕西省渭南市华州区咸林中学2021-2022学年高一上学期第三阶段质量检测化学试题贵州省遵义航天高级中学2017-2018学年高一下学期期中考试理科综合化学试题云南省彝良县民中2018-2019学年高一上学期12月份考试化学试题(已下线)专题10 性质探究类综合实验-2022年高考化学毕业班二轮热点题型归纳与变式演练(全国通用)陕西省铜川市耀州中学2022-2023学年高一上学期期末考试化学试题作业(十八) 铁盐和亚铁盐河南省南阳市六校2023-2024学年高一上学期12月月考化学试题



