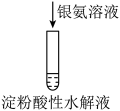
1 . 某小组设计实验探究 性质,如图所示。下列叙述正确的是
性质,如图所示。下列叙述正确的是
 性质,如图所示。下列叙述正确的是
性质,如图所示。下列叙述正确的是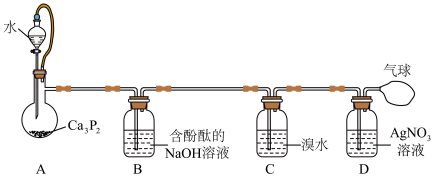
A.装置A中产生 和 和 ,发生了氧化还原反应 ,发生了氧化还原反应 |
B.根据装置B中现象可知, 不能与碱反应 不能与碱反应 |
| C.根据装置C中现象可知,磷的非金属性比溴的强 |
D.装置D中 与 与 反应还原产物只有Ag 反应还原产物只有Ag |
您最近一年使用:0次
解题方法
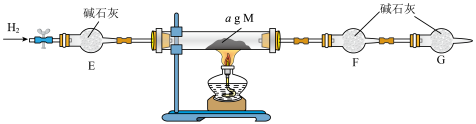
2 . 1777年,卡尔·威廉·舍勒发现了氨气并确定了其化学性质。受此启发,某小组探究 还原
还原 的固体产物。装置如下图所示。
的固体产物。装置如下图所示。
(1)Fe位于元素周期表_______ 区。
(2)导管L的作用是_______ 。装置D中倒置漏斗的作用是_______ 。
(3)装置B中试剂宜选择_______ (填字母)。
a. b.碱石灰 c.
b.碱石灰 c.
(4)写出装置A中反应的化学方程式:_______ 。
(5)实验中观察到装置C中硬质玻璃管中红色粉末变为黑色粉末(M),硬质玻璃管内壁有液珠。小组进一步探究M成分:
[提出假设]
假设1:M是Fe;
假设2:M是FeO和 混合物;
混合物;
假设3:M是Fe、FeO和 混合物。
混合物。
[设计实验]
①甲同学用强磁铁接近黑色粉末,发现能吸附黑色粉末,他认为假设1成立,丁同学认为他的观点不合理,原因是_______ 。
②乙同学取少量黑色粉末溶于稀硫酸,滴加KSCN溶液,未见溶液变红色,他认为假设2、3一定不成立。他的观点是否合理:_______ (填“合理”或“不合理”),并说明理由:_______ 。
③丙同学设计下图装置定量分析M的成分。 ,且
,且 ,则M的成分是
,则M的成分是_____ (填化学式)。
 还原
还原 的固体产物。装置如下图所示。
的固体产物。装置如下图所示。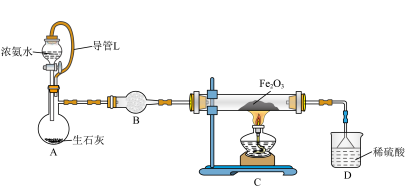
(1)Fe位于元素周期表
(2)导管L的作用是
(3)装置B中试剂宜选择
a.
 b.碱石灰 c.
b.碱石灰 c.
(4)写出装置A中反应的化学方程式:
(5)实验中观察到装置C中硬质玻璃管中红色粉末变为黑色粉末(M),硬质玻璃管内壁有液珠。小组进一步探究M成分:
[提出假设]
假设1:M是Fe;
假设2:M是FeO和
 混合物;
混合物;假设3:M是Fe、FeO和
 混合物。
混合物。[设计实验]
①甲同学用强磁铁接近黑色粉末,发现能吸附黑色粉末,他认为假设1成立,丁同学认为他的观点不合理,原因是
②乙同学取少量黑色粉末溶于稀硫酸,滴加KSCN溶液,未见溶液变红色,他认为假设2、3一定不成立。他的观点是否合理:
③丙同学设计下图装置定量分析M的成分。
 ,且
,且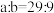 ,则M的成分是
,则M的成分是
您最近一年使用:0次
3 . 某同学在常温下将NH3通入K2Cr2O7饱和溶液(下方有少量K2Cr2O7晶体),装置如图所示(夹持装置省略)。已知常温下K2Cr2O7和K2CrO4的溶解度分别为12.3g和63.7g;该条件下NH3不与K2Cr2O7发生氧化还原反应。下列说法错误的是
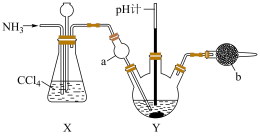
| A.装置X中的长颈漏斗也可换成长玻璃导管 |
| B.实验时装置Y中溶液由黄色逐渐变为橙色 |
| C.装置b中可装入P2O5 |
| D.实验结束后可观察到装置Y中晶体减少或者消失 |
您最近一年使用:0次
4 . 磷化铝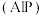 通常可作为一种广谱性熏蒸杀虫剂,粮食仓储常用磷化铝
通常可作为一种广谱性熏蒸杀虫剂,粮食仓储常用磷化铝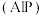 熏蒸杀虫,某化学兴趣小组的同学用下述方法测定粮食中残留磷化铝的含量。C中加入
熏蒸杀虫,某化学兴趣小组的同学用下述方法测定粮食中残留磷化铝的含量。C中加入 原粮,E中加入
原粮,E中加入 一定浓度的
一定浓度的 溶液(
溶液( 酸化)。往C中加入足量水,充分反应后,用亚硫酸钠标准溶液滴定E中过量的
酸化)。往C中加入足量水,充分反应后,用亚硫酸钠标准溶液滴定E中过量的 溶液。
溶液。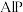 吸水后会立即产生高毒性
吸水后会立即产生高毒性 气体(沸点
气体(沸点 ℃,还原性强)。
℃,还原性强)。
②焦性没食子酸的碱性溶液具有还原性。
回答下列问题:
(1)仪器D中冷凝水从_____ 通入(填“a”或“b”)。
(2)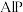 与水反应的化学方程式为
与水反应的化学方程式为_____ 。
(3)装置A中盛装 溶液的作用是除去空气中的还原性气体,装置B中盛有焦性没食子酸的碱性溶液,其作用是
溶液的作用是除去空气中的还原性气体,装置B中盛有焦性没食子酸的碱性溶液,其作用是_____ 。
(4)C中反应完全后继续通入空气的作用是_____ 。
(5)装置E中 被氧化成磷酸,
被氧化成磷酸, 的锰元素被还原为
的锰元素被还原为 ,则装置E中发生反应的还原剂和氧化剂的物质的量之比为
,则装置E中发生反应的还原剂和氧化剂的物质的量之比为_____ 。
(6)收集装置E中的吸收液,加水稀释后用 标准溶液滴定剩余的
标准溶液滴定剩余的 溶液,发生反应的离子方程式为
溶液,发生反应的离子方程式为_____ ,若滴定过程中不慎将锥形瓶中部分液体外溅,则会导致测定出粮食中磷化铝的残留量_____ (填“偏高”或“偏低”)。
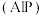 通常可作为一种广谱性熏蒸杀虫剂,粮食仓储常用磷化铝
通常可作为一种广谱性熏蒸杀虫剂,粮食仓储常用磷化铝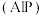 熏蒸杀虫,某化学兴趣小组的同学用下述方法测定粮食中残留磷化铝的含量。C中加入
熏蒸杀虫,某化学兴趣小组的同学用下述方法测定粮食中残留磷化铝的含量。C中加入 原粮,E中加入
原粮,E中加入 一定浓度的
一定浓度的 溶液(
溶液( 酸化)。往C中加入足量水,充分反应后,用亚硫酸钠标准溶液滴定E中过量的
酸化)。往C中加入足量水,充分反应后,用亚硫酸钠标准溶液滴定E中过量的 溶液。
溶液。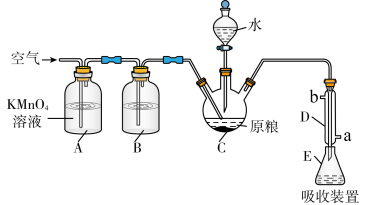
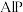 吸水后会立即产生高毒性
吸水后会立即产生高毒性 气体(沸点
气体(沸点 ℃,还原性强)。
℃,还原性强)。②焦性没食子酸的碱性溶液具有还原性。
回答下列问题:
(1)仪器D中冷凝水从
(2)
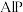 与水反应的化学方程式为
与水反应的化学方程式为(3)装置A中盛装
 溶液的作用是除去空气中的还原性气体,装置B中盛有焦性没食子酸的碱性溶液,其作用是
溶液的作用是除去空气中的还原性气体,装置B中盛有焦性没食子酸的碱性溶液,其作用是(4)C中反应完全后继续通入空气的作用是
(5)装置E中
 被氧化成磷酸,
被氧化成磷酸, 的锰元素被还原为
的锰元素被还原为 ,则装置E中发生反应的还原剂和氧化剂的物质的量之比为
,则装置E中发生反应的还原剂和氧化剂的物质的量之比为(6)收集装置E中的吸收液,加水稀释后用
 标准溶液滴定剩余的
标准溶液滴定剩余的 溶液,发生反应的离子方程式为
溶液,发生反应的离子方程式为
您最近一年使用:0次
名校
解题方法
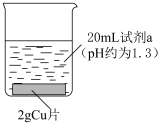
5 . 某研究性学习小组为探究含 的盐溶液与
的盐溶液与 的反应,设计并进行了如下实验。
的反应,设计并进行了如下实验。
已知:ⅰ. 、
、 是难溶于水的白色固体;
是难溶于水的白色固体;
ⅱ.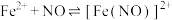 (棕色)。
(棕色)。
(1)Ⅰ、Ⅱ、Ⅲ溶液 均约为1.3,溶液显酸性且
均约为1.3,溶液显酸性且 相近的原因
相近的原因________ 。
(2)小组同学取 实验Ⅰ中反应2天后的溶液于试管中,加入2滴
实验Ⅰ中反应2天后的溶液于试管中,加入2滴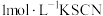 溶液,观察到溶液迅速变红,产生大量白色沉淀。甲同学猜想:实验Ⅰ原溶液中
溶液,观察到溶液迅速变红,产生大量白色沉淀。甲同学猜想:实验Ⅰ原溶液中 可能已反应完,
可能已反应完, 可能在该条件下被
可能在该条件下被 氧化。并通过实验证实了其猜想,其实验方案是:向
氧化。并通过实验证实了其猜想,其实验方案是:向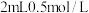
________ (填化学式)和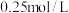
________ 的混合溶液中,加入2滴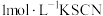 溶液,观察实验现象。该条件下
溶液,观察实验现象。该条件下 能被
能被 氧化的原因可能是
氧化的原因可能是 增强了
增强了 的
的________ 。
(3)实验Ⅱ中 片无剩余,说明实验Ⅱ反应比实验Ⅰ快,实验Ⅱ中产生白色固体
片无剩余,说明实验Ⅱ反应比实验Ⅰ快,实验Ⅱ中产生白色固体 的离子方程式为
的离子方程式为________ ,白色固体消失的离子方程式为________ ,由此对比实验Ⅰ和实验Ⅱ,推测 在实验Ⅱ中的作用是
在实验Ⅱ中的作用是________ 。产生大量红褐色沉淀的原因是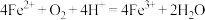 ,导致
,导致 、
、 增大,形成
增大,形成 沉淀。
沉淀。
(4)实验Ⅲ所得溶液的颜色不是蓝色,小组同学猜测反应中生成了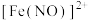 ,设计并实施了以下实验,验证了其猜想。
,设计并实施了以下实验,验证了其猜想。
综合以上实验, 盐溶液与
盐溶液与 反应的多样性与阴离子种类、生成物存在形式等有关。
反应的多样性与阴离子种类、生成物存在形式等有关。
 的盐溶液与
的盐溶液与 的反应,设计并进行了如下实验。
的反应,设计并进行了如下实验。实验装置 | 序号 | 试剂 | 实验现象 |
| Ⅰ | 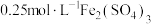 溶液 溶液 | 溶液逐渐变为蓝色。2天后, 片有较大量剩余,溶液仍为蓝色 片有较大量剩余,溶液仍为蓝色 |
Ⅱ | 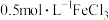 溶液 溶液 | 溶液逐渐变为蓝绿色,铜片表面覆盖有白色固体(经检验为 )。2天后,白色固体消失, )。2天后,白色固体消失, 片无剩余,溶液中产生大量红褐色沉淀 片无剩余,溶液中产生大量红褐色沉淀 | |
Ⅲ | 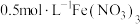 溶液 溶液 | 溶液逐渐变为绿色,实验过程中未见气泡产生。2天后, 片少量剩余,溶液中产生大量红褐色沉淀 片少量剩余,溶液中产生大量红褐色沉淀 |
 、
、 是难溶于水的白色固体;
是难溶于水的白色固体;ⅱ.
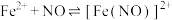 (棕色)。
(棕色)。(1)Ⅰ、Ⅱ、Ⅲ溶液
 均约为1.3,溶液显酸性且
均约为1.3,溶液显酸性且 相近的原因
相近的原因(2)小组同学取
 实验Ⅰ中反应2天后的溶液于试管中,加入2滴
实验Ⅰ中反应2天后的溶液于试管中,加入2滴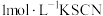 溶液,观察到溶液迅速变红,产生大量白色沉淀。甲同学猜想:实验Ⅰ原溶液中
溶液,观察到溶液迅速变红,产生大量白色沉淀。甲同学猜想:实验Ⅰ原溶液中 可能已反应完,
可能已反应完, 可能在该条件下被
可能在该条件下被 氧化。并通过实验证实了其猜想,其实验方案是:向
氧化。并通过实验证实了其猜想,其实验方案是:向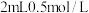
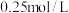
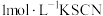 溶液,观察实验现象。该条件下
溶液,观察实验现象。该条件下 能被
能被 氧化的原因可能是
氧化的原因可能是 增强了
增强了 的
的(3)实验Ⅱ中
 片无剩余,说明实验Ⅱ反应比实验Ⅰ快,实验Ⅱ中产生白色固体
片无剩余,说明实验Ⅱ反应比实验Ⅰ快,实验Ⅱ中产生白色固体 的离子方程式为
的离子方程式为 在实验Ⅱ中的作用是
在实验Ⅱ中的作用是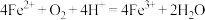 ,导致
,导致 、
、 增大,形成
增大,形成 沉淀。
沉淀。(4)实验Ⅲ所得溶液的颜色不是蓝色,小组同学猜测反应中生成了
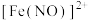 ,设计并实施了以下实验,验证了其猜想。
,设计并实施了以下实验,验证了其猜想。步骤 | 实验操作 | 实验现象 |
① | 向盛有 金属 金属 片的烧杯中加入 片的烧杯中加入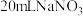 与 与 的混合溶液[ 的混合溶液[ 与约为1.3、 与约为1.3、 ] ] | 2天后溶液颜色无明显变化,铜片表面有细小气泡附着 |
② | 继续加入少量 | 溶液迅速变为浅棕色 |
 盐溶液与
盐溶液与 反应的多样性与阴离子种类、生成物存在形式等有关。
反应的多样性与阴离子种类、生成物存在形式等有关。
您最近一年使用:0次
名校
解题方法
6 . 探究溶液中Ag+与单质S的反应。
资料:Ag2S不溶于6mol/L盐酸,Ag2SO3和Ag2SO4在6mol/L盐酸中均发生沉淀的转化
实验Ⅰ.在注射器中将10mL0.04mol/LAgNO3溶液(pH≈6)与0.01g S粉混合,水浴加热,充分反应后,过滤,得到无色溶液a(pH≈1),沉淀除S、洗涤后得到黑色固体b。
(1)研究黑色固体b的组成
①根据S具有__________ 性,推测b中可能含有Ag2S、Ag、Ag2SO3或Ag2SO4。
②检验黑色固体b的成分______ 。
ⅱ.用滤液c继续实验证明了黑色固体b中不含Ag2SO3,可选择的试剂是______ (填序号)。
a.酸性KMnO4溶液 b.H2O2和BaCl2的混合溶液 c.溴水
ⅲ.进一步实验证实了黑色固体b中不含Ag。根据沉淀e含有Ag、气体含有H2S,写出同时生成Ag和H2S的离子方程式:_________________ 。
(2)研究无色溶液a的组成
结合上述实验结果,分析溶液a中可能存在 或H2SO3,依据是
或H2SO3,依据是_______________ 。___________________ 。
②加入足量稀盐酸的作用是_________________ 。
(3)在注射器中进行实验Ⅳ,探究Ag2SO4溶液与S的反应,所得产物与实验Ⅰ相同。向注射器中加入的物质是__________________ 。
(4)用酸化的NaNO3溶液(pH≈6)与S进行实验Ⅴ,发现二者不反应。综合以上实验,写出溶液中Ag+与S反应的离子方程式并简要说明Ag+的作用:_______________ 。
资料:Ag2S不溶于6mol/L盐酸,Ag2SO3和Ag2SO4在6mol/L盐酸中均发生沉淀的转化
实验Ⅰ.在注射器中将10mL0.04mol/LAgNO3溶液(pH≈6)与0.01g S粉混合,水浴加热,充分反应后,过滤,得到无色溶液a(pH≈1),沉淀除S、洗涤后得到黑色固体b。
(1)研究黑色固体b的组成
①根据S具有
②检验黑色固体b的成分
实验Ⅱ.
ⅱ.用滤液c继续实验证明了黑色固体b中不含Ag2SO3,可选择的试剂是
a.酸性KMnO4溶液 b.H2O2和BaCl2的混合溶液 c.溴水
ⅲ.进一步实验证实了黑色固体b中不含Ag。根据沉淀e含有Ag、气体含有H2S,写出同时生成Ag和H2S的离子方程式:
(2)研究无色溶液a的组成
结合上述实验结果,分析溶液a中可能存在
 或H2SO3,依据是
或H2SO3,依据是实验Ⅲ.
②加入足量稀盐酸的作用是
(3)在注射器中进行实验Ⅳ,探究Ag2SO4溶液与S的反应,所得产物与实验Ⅰ相同。向注射器中加入的物质是
(4)用酸化的NaNO3溶液(pH≈6)与S进行实验Ⅴ,发现二者不反应。综合以上实验,写出溶液中Ag+与S反应的离子方程式并简要说明Ag+的作用:
您最近一年使用:0次
2024-05-31更新
|
318次组卷
|
5卷引用:北京首都师范大学附属中学2023-2024学年高三下学期考前热身化学试题
北京首都师范大学附属中学2023-2024学年高三下学期考前热身化学试题(已下线)T19-实验探究题(已下线)阶段检测卷一 基本概念-2025年高考化学一轮复习考点通关卷(新高考通用)第14讲 硫及其重要化合物考点专练第三章 水溶液中的离子反应与平衡【单元测试B卷】
7 . 三氯化铬是常用的媒染剂和催化剂,易潮解,易升华,高温下易被氧气氧化。实验室可利用下面装置模拟制取三氯化铬( 、
、 为气流控制开关)。
为气流控制开关)。
已知: 气体有毒,遇水发生水解产生两种酸性气体。
气体有毒,遇水发生水解产生两种酸性气体。
下列说法错误的是
 、
、 为气流控制开关)。
为气流控制开关)。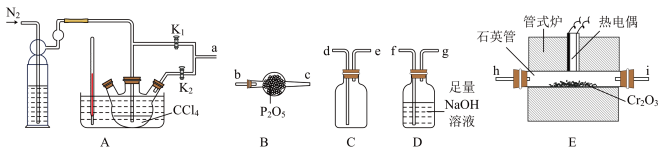

已知:
 气体有毒,遇水发生水解产生两种酸性气体。
气体有毒,遇水发生水解产生两种酸性气体。下列说法错误的是
| A.实验装置合理的连接顺序为a→h→i→d→e→b→c→f→g |
B.装置D中反应的离子方程式为 |
| C.整套装置的不足是升华的三氯化铬易凝华堵塞导管,可加粗导管或导管加保温装置 |
D.实验开始和结束都通一段时间 ,但目的不相同 ,但目的不相同 |
您最近一年使用:0次
2024-05-31更新
|
424次组卷
|
4卷引用:湖北省襄阳四中2024届高三下学期学业水平适应性考试(一模)化学试题
湖北省襄阳四中2024届高三下学期学业水平适应性考试(一模)化学试题(已下线)专题03 化学实验基础-【好题汇编】3年(2022-2024)高考1年模拟化学真题分类汇编(湖北专用)(已下线)暑假作业07 掌握实验仪器的基本操作、实验设计与评价-【暑假分层作业】2024年高二化学暑假培优练(2025届一轮复习通用)第二章 海水中的重要元素——钠和氯【单元测试B卷】
8 . 根据下列实验的操作和现象,可以说明相应结论的是
| 选项 | 操作 | 现象 | 结论 |
| A | 将乙醇和浓硫酸的混合液加热,将生成的气体通入溴水中 | 溴水褪色 | 乙醇发生了消去反应 |
| B | 取一定质量久置的亚硫酸钠固体于试管中,加蒸馏水完全溶解后,滴加BaCl2溶液 | 产生白色沉淀 | 亚硫酸钠变质 |
| C | 常温下,将两块相同的未经打磨的铝片分别投入5.0mL饱和的CuSO4溶液和CuCl2溶液中 | 前者无明显现象,后者迅速反应,现象明显 | Cl-能加速破坏铝片表面的氧化膜 |
| D | 探究氢离子浓度对 、 、 相互转化的影响 相互转化的影响 | 向K2CrO4溶液中缓慢滴加硫酸,黄色变为橙红色 | 增大氢离子浓度,转化平衡向生成 的方向移动 的方向移动 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2024-05-30更新
|
92次组卷
|
2卷引用:湖南省部分校联考2024届高三下学期5月模拟考试化学试题
名校
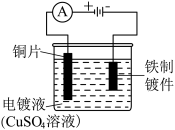
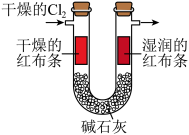
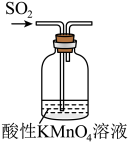
9 . 下列实验中,能够达到实验目的的是
| 在铁制镀件上镀铜 | 验证氯气与水反应后的产物具有漂白性 |
|
|
| A | B |
验证 具有漂白性 具有漂白性 | 检验淀粉在酸性条件下水解的最终产物为葡萄糖 |
|
|
| C | D |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
10 . 锰的化合物用途与性质的探究,有关物质及颜色: (白色)、
(白色)、 (棕黑色)、
(棕黑色)、 (绿色)、
(绿色)、 (紫色)。回答问题:
(紫色)。回答问题:
Ⅰ.用 溶液氧化甲苯制苯甲酸,按如下流程分离苯甲酸和回收甲苯。
溶液氧化甲苯制苯甲酸,按如下流程分离苯甲酸和回收甲苯。
(1)操作Ⅰ为______ ,操作Ⅱ为______ 。
(2)无色液体A是______ ,.定性检验A的试剂是______ ,现象是____________ 。
(3)该同学推测白色固体B是苯甲酸与少量KCl的混合物,简述提纯过程____________ 。
Ⅱ.探究 在一定条件下被
在一定条件下被 或
或 氧化成的产物,实验装置如图(夹持装置略):
氧化成的产物,实验装置如图(夹持装置略): 前产生白色沉淀,在空气中缓慢变成棕黑色沉淀;通入
前产生白色沉淀,在空气中缓慢变成棕黑色沉淀;通入 后棕黑色沉淀增多,放置后溶液变为紫色,仍有沉淀。
后棕黑色沉淀增多,放置后溶液变为紫色,仍有沉淀。
实验ⅱ:物质a为40% KOH溶液,C中通入 前后与实验ⅰ现象一样。
前后与实验ⅰ现象一样。
(4)通入 前,C中沉淀由白色变为黑色的化学方程式为
前,C中沉淀由白色变为黑色的化学方程式为____________ 。
(5) 的氧化性与溶液的酸碱性无关,KClO的氧化性随碱性减弱而增强。取ⅰ中放置后的1 mL悬浊液,再加入4 mL水,溶液紫色缓慢加深,发生的反应是
的氧化性与溶液的酸碱性无关,KClO的氧化性随碱性减弱而增强。取ⅰ中放置后的1 mL悬浊液,再加入4 mL水,溶液紫色缓慢加深,发生的反应是____________ 。
(6)浓碱条件下, 可被
可被 还原为
还原为 。取ⅱ中放置后的1 mL悬浊液,再加4 mL 40% KOH溶液,溶液紫色迅速变为绿色,溶液紫色变为绿色的离子方程式为
。取ⅱ中放置后的1 mL悬浊液,再加4 mL 40% KOH溶液,溶液紫色迅速变为绿色,溶液紫色变为绿色的离子方程式为____________ 。
(7)从反应速率的角度,分析实验ⅱ未得到绿色溶液的可能原因____________ 。
 (白色)、
(白色)、 (棕黑色)、
(棕黑色)、 (绿色)、
(绿色)、 (紫色)。回答问题:
(紫色)。回答问题:Ⅰ.用
 溶液氧化甲苯制苯甲酸,按如下流程分离苯甲酸和回收甲苯。
溶液氧化甲苯制苯甲酸,按如下流程分离苯甲酸和回收甲苯。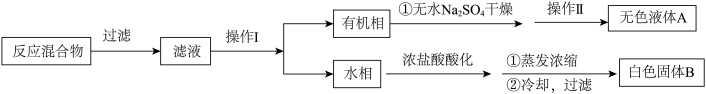
(1)操作Ⅰ为
(2)无色液体A是
(3)该同学推测白色固体B是苯甲酸与少量KCl的混合物,简述提纯过程
Ⅱ.探究
 在一定条件下被
在一定条件下被 或
或 氧化成的产物,实验装置如图(夹持装置略):
氧化成的产物,实验装置如图(夹持装置略):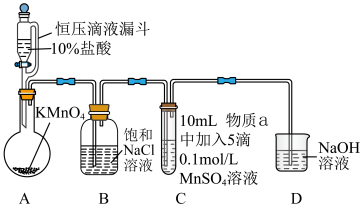
 前产生白色沉淀,在空气中缓慢变成棕黑色沉淀;通入
前产生白色沉淀,在空气中缓慢变成棕黑色沉淀;通入 后棕黑色沉淀增多,放置后溶液变为紫色,仍有沉淀。
后棕黑色沉淀增多,放置后溶液变为紫色,仍有沉淀。实验ⅱ:物质a为40% KOH溶液,C中通入
 前后与实验ⅰ现象一样。
前后与实验ⅰ现象一样。(4)通入
 前,C中沉淀由白色变为黑色的化学方程式为
前,C中沉淀由白色变为黑色的化学方程式为(5)
 的氧化性与溶液的酸碱性无关,KClO的氧化性随碱性减弱而增强。取ⅰ中放置后的1 mL悬浊液,再加入4 mL水,溶液紫色缓慢加深,发生的反应是
的氧化性与溶液的酸碱性无关,KClO的氧化性随碱性减弱而增强。取ⅰ中放置后的1 mL悬浊液,再加入4 mL水,溶液紫色缓慢加深,发生的反应是(6)浓碱条件下,
 可被
可被 还原为
还原为 。取ⅱ中放置后的1 mL悬浊液,再加4 mL 40% KOH溶液,溶液紫色迅速变为绿色,溶液紫色变为绿色的离子方程式为
。取ⅱ中放置后的1 mL悬浊液,再加4 mL 40% KOH溶液,溶液紫色迅速变为绿色,溶液紫色变为绿色的离子方程式为(7)从反应速率的角度,分析实验ⅱ未得到绿色溶液的可能原因
您最近一年使用:0次