名校
1 . 氯气是现代工业和生活中常用的杀菌消毒剂。回答下列问题:
(1)实验室常用 固体和浓盐酸在加热条件下制取
固体和浓盐酸在加热条件下制取 ,反应的离子方程式为
,反应的离子方程式为___________ 。实验室还可用 固体和浓盐酸在室温条件下制取少量氯气,可选用图中的
固体和浓盐酸在室温条件下制取少量氯气,可选用图中的___________ (选填“A”或“B”)作为发生装置。图示装置中橡皮管或玻璃弯管的作用是___________ 。

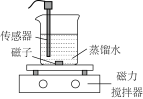
(2)某实验小组同学将上面制得的氯气通入蒸馏水中获得了氯气的水溶液——氯水,并利用如下装置探究氯水的成分及性质:
(说明:试管中溶液均为 ,均滴入氯水5滴;淀粉遇I2变蓝)
,均滴入氯水5滴;淀粉遇I2变蓝)
①实验I中反应的化学方程式为___________ ,由此推断氧化性:Cl2___________ I2(填“>”或“<”)。
②实验II中使溶液褪色的微粒是___________ (填化学式)。
(1)实验室常用
 固体和浓盐酸在加热条件下制取
固体和浓盐酸在加热条件下制取 ,反应的离子方程式为
,反应的离子方程式为 固体和浓盐酸在室温条件下制取少量氯气,可选用图中的
固体和浓盐酸在室温条件下制取少量氯气,可选用图中的
(2)某实验小组同学将上面制得的氯气通入蒸馏水中获得了氯气的水溶液——氯水,并利用如下装置探究氯水的成分及性质:
| 实验I | 实验II | |
| 实验操作 |  |  |
| 实验现象 | 溶液变蓝 | 石蕊溶液先变红,后褪色 |
 ,均滴入氯水5滴;淀粉遇I2变蓝)
,均滴入氯水5滴;淀粉遇I2变蓝)①实验I中反应的化学方程式为
②实验II中使溶液褪色的微粒是
您最近一年使用:0次
2 . 某研究小组同学为探究锌与硫酸反应生成 、
、 的临界浓度(浓硫酸能与锌反应生成
的临界浓度(浓硫酸能与锌反应生成 的最低浓度)设计了如图实验(加热和夹持装置已省略)。
的最低浓度)设计了如图实验(加热和夹持装置已省略)。
已知:锌与浓硫酸开始时反应缓慢,可以适当加热以加速其反应,当有大量气泡生成时,该反应速率会明显加快并伴有大量的热放出。
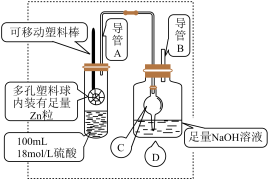
移动塑料棒,使锌浸没到硫酸中充分反应,反应结束后向D装置中加入足量的 溶液,再加入足量的
溶液,再加入足量的 溶液,充分反应后将所得沉淀过滤、洗涤、干燥、称量得到固体质量为a g。
溶液,充分反应后将所得沉淀过滤、洗涤、干燥、称量得到固体质量为a g。
(1)加入H₂O₂溶液发生反应的离子方程式是___________ 。
(2)浓硫酸与锌反应的临界浓度为___________ mol·L-1(用含a的计算式表示,忽略溶液体积变化)。
 、
、 的临界浓度(浓硫酸能与锌反应生成
的临界浓度(浓硫酸能与锌反应生成 的最低浓度)设计了如图实验(加热和夹持装置已省略)。
的最低浓度)设计了如图实验(加热和夹持装置已省略)。已知:锌与浓硫酸开始时反应缓慢,可以适当加热以加速其反应,当有大量气泡生成时,该反应速率会明显加快并伴有大量的热放出。

移动塑料棒,使锌浸没到硫酸中充分反应,反应结束后向D装置中加入足量的
 溶液,再加入足量的
溶液,再加入足量的 溶液,充分反应后将所得沉淀过滤、洗涤、干燥、称量得到固体质量为a g。
溶液,充分反应后将所得沉淀过滤、洗涤、干燥、称量得到固体质量为a g。(1)加入H₂O₂溶液发生反应的离子方程式是
(2)浓硫酸与锌反应的临界浓度为
您最近一年使用:0次
名校
3 . 碘化亚铁 在常温下为灰黑色固体,易升华,可溶于水,具有潮解性,常用于医药,可由碘单质和还原铁粉在加热条件下制备得到。
在常温下为灰黑色固体,易升华,可溶于水,具有潮解性,常用于医药,可由碘单质和还原铁粉在加热条件下制备得到。 )
)
(1)装置中盛碱石灰的仪器名称为_____ 。若无此装置,写出铁粉参与的副反应的化学方程式:_____ 。
(2)收集器浸泡在冷水中的原因是_____ 。
(3)试剂a为_____ ,其作用是_____ 。
Ⅱ、化学兴趣小组为了探究 的还原性,进行了如下实验:取一定量的
的还原性,进行了如下实验:取一定量的 溶液,向其中滴加少量新制的氯水,振荡后溶液呈黄色。同学们对溶液变成黄色的原因提出了不同的看法:
溶液,向其中滴加少量新制的氯水,振荡后溶液呈黄色。同学们对溶液变成黄色的原因提出了不同的看法:
甲同学认为:是因为被 氧化成
氧化成 ;乙同学认为:是因为被
;乙同学认为:是因为被 氧化成
氧化成 。
。
随后化学兴趣小组进行如下实验进行验证。
(4)上述实验②中现象为_____ 。化学兴趣小组得到的结论: 的还原性
的还原性_____  的还原性(填“
的还原性(填“ ”、“
”、“ ”或“
”或“ ”)。
”)。
(5)依据(4)中所得结论,试写出往过量 溶液中通入少量氯气后所发生反应的离子反应方程式:
溶液中通入少量氯气后所发生反应的离子反应方程式:_____ 。
 在常温下为灰黑色固体,易升华,可溶于水,具有潮解性,常用于医药,可由碘单质和还原铁粉在加热条件下制备得到。
在常温下为灰黑色固体,易升华,可溶于水,具有潮解性,常用于医药,可由碘单质和还原铁粉在加热条件下制备得到。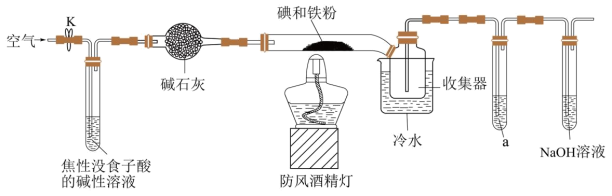
 )
)(1)装置中盛碱石灰的仪器名称为
(2)收集器浸泡在冷水中的原因是
(3)试剂a为
Ⅱ、化学兴趣小组为了探究
 的还原性,进行了如下实验:取一定量的
的还原性,进行了如下实验:取一定量的 溶液,向其中滴加少量新制的氯水,振荡后溶液呈黄色。同学们对溶液变成黄色的原因提出了不同的看法:
溶液,向其中滴加少量新制的氯水,振荡后溶液呈黄色。同学们对溶液变成黄色的原因提出了不同的看法:甲同学认为:是因为被
 氧化成
氧化成 ;乙同学认为:是因为被
;乙同学认为:是因为被 氧化成
氧化成 。
。随后化学兴趣小组进行如下实验进行验证。
| 实验步骤 | 现象 | 结论 |
| ①取少量黄色溶液于试管中,滴加淀粉溶液 | 试管中溶液变蓝色 | 甲同学观点正确 |
②取少量黄色溶液于试管中,滴加 溶液 溶液 | 乙同学观点不正确 |
(4)上述实验②中现象为
 的还原性
的还原性 的还原性(填“
的还原性(填“ ”、“
”、“ ”或“
”或“ ”)。
”)。(5)依据(4)中所得结论,试写出往过量
 溶液中通入少量氯气后所发生反应的离子反应方程式:
溶液中通入少量氯气后所发生反应的离子反应方程式:
您最近一年使用:0次
2024-02-16更新
|
151次组卷
|
3卷引用:湖南省常德市第一中学2023-2024学年高一上学期期末考试化学试题
名校
解题方法
4 . 为了探究元素周期律,设计实验验证卤素单质氧化性的相对强弱,实验如下:
资料:稀溴水呈黄色;浓溴水呈红棕色;碘水呈棕黄色。
(1)a中反应的离子方程式是___________ 。
(2)实验I中b可以得出的氧化性强弱是___________ 。
(3)①甲同学认为:实验Ⅱ观察到___________ 现象,得出氧化性Br2>I2。
②乙同学对上述实验进行反思,认为实验II不能充分证明氧化性Br2>I2,他补做了实验Ⅲ.
补做实验Ⅲ的目的是___________ 。
综合实验I和Ⅲ,得出氧化性Cl2>Br2>I2.由此实验得出的结论:同主族元素从上到下,原子的得电子能力逐渐减弱
资料:稀溴水呈黄色;浓溴水呈红棕色;碘水呈棕黄色。
| 实验I | 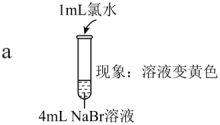 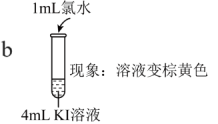 |
| 实验II | 取a中的黄色溶液少许,加入KI溶液,再加入淀粉溶液。 |
(1)a中反应的离子方程式是
(2)实验I中b可以得出的氧化性强弱是
(3)①甲同学认为:实验Ⅱ观察到
②乙同学对上述实验进行反思,认为实验II不能充分证明氧化性Br2>I2,他补做了实验Ⅲ.
| 实验III | 另取a中黄色溶液少许,加入足量NaBr固体,振荡,然后加入KI溶液和淀粉溶液。 |
综合实验I和Ⅲ,得出氧化性Cl2>Br2>I2.由此实验得出的结论:同主族元素从上到下,原子的得电子能力逐渐减弱
您最近一年使用:0次
2024-02-13更新
|
68次组卷
|
2卷引用:宁夏回族自治区石嘴山市第三中学2023-2024学年高一上学期1月期末化学试题
5 . 某化学实验小组为了验证在实验室制备 的过程中有水蒸气和
的过程中有水蒸气和 挥发出来,同时探究氯气的某些性质,设计了如图所示的实验装置(氯气易溶于
挥发出来,同时探究氯气的某些性质,设计了如图所示的实验装置(氯气易溶于 ,
, 不溶于
不溶于 )。
)。
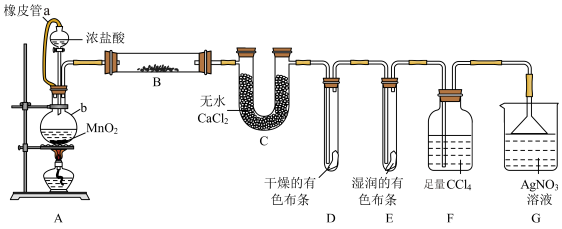
回答下列问题:
(1)装置中仪器b的名称是___________ 。
(2)装置A中发生反应的离子方程式为___________ ,连橡皮管a的作用是___________ 。
(3)一段时间后,根据装置D与E中出现的不同现象可得出的结论是___________ 。
(4)装置B中盛放的药品是___________ 。装置F的作用是___________ ,若有 挥发出来,装置G中的现象为
挥发出来,装置G中的现象为___________ 。
(5)若装置A中用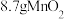 与足量浓盐酸混合加热,则被氧化的
与足量浓盐酸混合加热,则被氧化的 的物质的量是
的物质的量是___________  。
。
 的过程中有水蒸气和
的过程中有水蒸气和 挥发出来,同时探究氯气的某些性质,设计了如图所示的实验装置(氯气易溶于
挥发出来,同时探究氯气的某些性质,设计了如图所示的实验装置(氯气易溶于 ,
, 不溶于
不溶于 )。
)。
回答下列问题:
(1)装置中仪器b的名称是
(2)装置A中发生反应的离子方程式为
(3)一段时间后,根据装置D与E中出现的不同现象可得出的结论是
(4)装置B中盛放的药品是
 挥发出来,装置G中的现象为
挥发出来,装置G中的现象为(5)若装置A中用
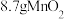 与足量浓盐酸混合加热,则被氧化的
与足量浓盐酸混合加热,则被氧化的 的物质的量是
的物质的量是 。
。
您最近一年使用:0次
解题方法
6 . Ⅰ.实验小组利用传感器探究Na2CO3和NaHCO3的性质。
【查阅资料】pH越小,OH-浓度越小,溶液碱性越弱。
【实验过程】
【分析与解释】
(1)实验①中,溶解时吸收热量的物质是___________ 。
(2)实验②中,Na2CO3溶液和澄清石灰水反应的离子方程式为___________ ,OH-未参与该反应的实验证据是___________ 。
(3)实验②中,滴加NaHCO3溶液的pH变化与滴加Na2CO3溶液的有明显差异,原因是滴加NaHCO3溶液的烧杯中,参与反应的离子有___________ 。
(4)工业上制得的纯碱中常含有一定量的NaHCO3,取质量为a g的纯碱样品,充分加热后,质量减少b g,此样品中Na2CO3的质量分数___________ 。
Ⅱ.可用Cl2和Ca(OH)2制备漂粉精,漂粉精常用于游泳池的消毒,起消毒作用的是HClO,池水的酸碱性对漂粉精的消毒效果影响明显。
(5)写出制备漂粉精的化学方程式___________ 。
(6)若池水碱性过强,消毒作用会___________ (填“增强”或“减弱”)。
(7)若池水酸性过强,会刺激眼睛和皮肤。有时加入Na2CO3、NaHCO3以降低酸性,起到降低酸性作用的离子分别是___________ (填离子符号)。
【查阅资料】pH越小,OH-浓度越小,溶液碱性越弱。
【实验过程】
| 编号 | 实验操作 | 实验数据 |
| 实验① | 测量下述实验过程的温度变化 |  |
| 实验② | 测量下述实验过程的pH变化 | 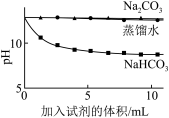 |
(1)实验①中,溶解时吸收热量的物质是
(2)实验②中,Na2CO3溶液和澄清石灰水反应的离子方程式为
(3)实验②中,滴加NaHCO3溶液的pH变化与滴加Na2CO3溶液的有明显差异,原因是滴加NaHCO3溶液的烧杯中,参与反应的离子有
(4)工业上制得的纯碱中常含有一定量的NaHCO3,取质量为a g的纯碱样品,充分加热后,质量减少b g,此样品中Na2CO3的质量分数
Ⅱ.可用Cl2和Ca(OH)2制备漂粉精,漂粉精常用于游泳池的消毒,起消毒作用的是HClO,池水的酸碱性对漂粉精的消毒效果影响明显。
(5)写出制备漂粉精的化学方程式
(6)若池水碱性过强,消毒作用会
(7)若池水酸性过强,会刺激眼睛和皮肤。有时加入Na2CO3、NaHCO3以降低酸性,起到降低酸性作用的离子分别是
您最近一年使用:0次
解题方法
7 . 钠与水反应、铁与水蒸气反应的实验装置图如下。
下列说法不正确 的是
Ⅰ.钠与水反应 | Ⅱ.铁与水蒸气反应 |
|
|
| A.Ⅰ中钠熔化成小球说明反应放热和钠的熔点低 |
B.Ⅰ中钠与水反应的离子方程式: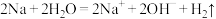 |
| C.Ⅱ中有肥皂泡产生说明有H2生成 |
D.Ⅱ中铁与水蒸气反应的化学方程式: |
您最近一年使用:0次
8 . 实验小组用如图装置探究 、
、 、
、 的氧化性强弱(夹持装置和加热装置已省略,气密性已检验)。
的氧化性强弱(夹持装置和加热装置已省略,气密性已检验)。 遇淀粉溶液变蓝
遇淀粉溶液变蓝
实验过程:
Ⅰ.打开弹簧夹 和
和 ,通入一段时间
,通入一段时间 ,再将导管插入
,再将导管插入 中,继续通入
中,继续通入 一段时间,然后夹紧
一段时间,然后夹紧 ;
;
Ⅱ.打开活塞 ,滴加一定量浓盐酸后关闭活塞
,滴加一定量浓盐酸后关闭活塞 ,给
,给 加热;
加热;
Ⅲ.当 中的溶液变为黄色时,停止加热,夹紧
中的溶液变为黄色时,停止加热,夹紧 ;
;
Ⅳ.打开活塞 ,将少量
,将少量 中溶液滴入
中溶液滴入 中,关闭活塞
中,关闭活塞 。
。
(1) 中发生反应的化学方程式是
中发生反应的化学方程式是______ 。
(2)浸有 溶液的棉花上发生反应的离子方程式是
溶液的棉花上发生反应的离子方程式是______ 。
(3) 中溶液变黄说明氧化性
中溶液变黄说明氧化性 ,反应的离子方程式是
,反应的离子方程式是______ 。
(4)为探究 和
和 的氧化性强弱,甲、乙、丙三位同学分别完成了上述实验,并检测
的氧化性强弱,甲、乙、丙三位同学分别完成了上述实验,并检测 中黄色溶液和
中黄色溶液和 中混合溶液中的
中混合溶液中的部分 微粒,结果如表所示(忽略空气中 的影响)。
的影响)。
①检验 中黄色溶液中含有
中黄色溶液中含有 的试剂是
的试剂是______ 。
②进一步检验 的实验操作及现象是
的实验操作及现象是______ 。
③能证明该实验条件下氧化性 的有
的有______ (填“甲”“乙”或“丙”)。不能证明的请说明理由:______ 。
 、
、 、
、 的氧化性强弱(夹持装置和加热装置已省略,气密性已检验)。
的氧化性强弱(夹持装置和加热装置已省略,气密性已检验)。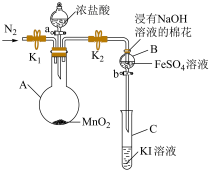
 遇淀粉溶液变蓝
遇淀粉溶液变蓝实验过程:
Ⅰ.打开弹簧夹
 和
和 ,通入一段时间
,通入一段时间 ,再将导管插入
,再将导管插入 中,继续通入
中,继续通入 一段时间,然后夹紧
一段时间,然后夹紧 ;
;Ⅱ.打开活塞
 ,滴加一定量浓盐酸后关闭活塞
,滴加一定量浓盐酸后关闭活塞 ,给
,给 加热;
加热;Ⅲ.当
 中的溶液变为黄色时,停止加热,夹紧
中的溶液变为黄色时,停止加热,夹紧 ;
;Ⅳ.打开活塞
 ,将少量
,将少量 中溶液滴入
中溶液滴入 中,关闭活塞
中,关闭活塞 。
。(1)
 中发生反应的化学方程式是
中发生反应的化学方程式是(2)浸有
 溶液的棉花上发生反应的离子方程式是
溶液的棉花上发生反应的离子方程式是(3)
 中溶液变黄说明氧化性
中溶液变黄说明氧化性 ,反应的离子方程式是
,反应的离子方程式是(4)为探究
 和
和 的氧化性强弱,甲、乙、丙三位同学分别完成了上述实验,并检测
的氧化性强弱,甲、乙、丙三位同学分别完成了上述实验,并检测 中黄色溶液和
中黄色溶液和 中混合溶液中的
中混合溶液中的 的影响)。
的影响)。
|
| |
甲 | 既有 | 有 |
乙 | 有 | 有 |
丙 | 有 | 有 |
 中黄色溶液中含有
中黄色溶液中含有 的试剂是
的试剂是②进一步检验
 的实验操作及现象是
的实验操作及现象是③能证明该实验条件下氧化性
 的有
的有
您最近一年使用:0次
2024-01-20更新
|
150次组卷
|
2卷引用:北京市西城区2023-2024学年高一上学期期末考试化学试卷
9 . 常温下,某小组同学用如下实验探究 的沉淀溶解平衡
的沉淀溶解平衡
已知:酚酞的变色范围:pH<8.2无色;8.2≤pH≤10.0粉红色;pH>10红色
下列说法不正确 的是
 的沉淀溶解平衡
的沉淀溶解平衡实验装置 |
| |
实验序号 | Ⅰ | Ⅱ |
| 传感器种类 | 导电率传感器 | pH传感器 |
| 实验操作 | 向蒸馏水中加入足量的 粉末,一段时间后再加蒸馏水 粉末,一段时间后再加蒸馏水 | 向滴有酚酞的蒸馏水中加入 粉末,隔一段时间后,再向所得悬浊液中加入一定量稀硫酸 粉末,隔一段时间后,再向所得悬浊液中加入一定量稀硫酸 |
| 实验数据 |  | 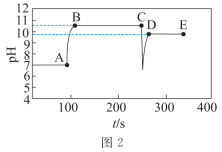 |
下列说法
A.图1中a点导电率不为0的原因是: |
B.图1中d点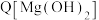 小于 小于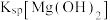 |
| C.实验Ⅱ中,溶液颜色先变红,后变为无色,最后溶液呈粉红色 |
D.实验Ⅱ中:加入 的物质的量小于加入硫酸的物质的量 的物质的量小于加入硫酸的物质的量 |
您最近一年使用:0次
2024-01-20更新
|
76次组卷
|
2卷引用:北京市顺义区2023-2024学年高二上学期期末质量监测化学试题
10 . 某化学小组以铜为阳极、石墨为阴极,研究在不同的电解质溶液中铜被氧化的价态及产物。实验装置如图所示(电源装置略去)。

资料:i.Cu2O为砖红色,CuCl为白色,CuOH为黄色且易分解
ii.[Cu(NH3)2]+为无色,在空气中易被氧化为深蓝色[Cu(NH3)4]2+
iii.25 ℃时,Ksp(CuCl)=1.2×10-6,Ksp(CuOH)= 1.2×10-14
实验记录如下:
(1)I中铜电极的电极反应式是___________ 。
(2)II中沉淀由黄色变为砖红色的化学方程式是___________ 。
(3)将III中所得白色沉淀过滤,充分洗涤,进行下列实验,证实该沉淀为CuCl。

①证明III中所得白色沉淀中有Cu+的证据是___________ 。
②步骤iii的操作是___________ 。
(4)III中下端白色沉淀最终变为砖红色的原因是:白色沉淀为CuCl,___________ ,CuOH不稳定易分解为砖红色的Cu2O。
(5)IV中Cu未被氧化的原因是________ 。
(6)综上,铜被氧化的价态及产物与________ 有关。

资料:i.Cu2O为砖红色,CuCl为白色,CuOH为黄色且易分解
ii.[Cu(NH3)2]+为无色,在空气中易被氧化为深蓝色[Cu(NH3)4]2+
iii.25 ℃时,Ksp(CuCl)=1.2×10-6,Ksp(CuOH)= 1.2×10-14
实验记录如下:
| 实验 | 电解质溶液(3 mol/L) | 现象 | |
| 铜电极附近 | 石墨电极 | ||
| I | H2SO4 | 溶液变蓝 | 产生无色气泡,一段时间后有少量红色金属析出 |
| II | NaOH | 出现黄色浑浊,很快变为砖红色 | 产生无色气泡 |
| III | NaCl | 出现白色浑浊,浑浊向下扩散,一段时间后,下端白色沉淀变黄,最终为砖红色 | 产生无色气泡 |
| IV | KI | 迅速产生棕褐色的物质,滴入1 滴淀粉溶液, 立即变为蓝色;取出铜电极洗净检验,无变化 | 产生无色气泡 |
(2)II中沉淀由黄色变为砖红色的化学方程式是
(3)将III中所得白色沉淀过滤,充分洗涤,进行下列实验,证实该沉淀为CuCl。

①证明III中所得白色沉淀中有Cu+的证据是
②步骤iii的操作是
(4)III中下端白色沉淀最终变为砖红色的原因是:白色沉淀为CuCl,
(5)IV中Cu未被氧化的原因是
(6)综上,铜被氧化的价态及产物与
您最近一年使用:0次