解题方法
1 . 下列关于实验的描述说法错误的是

A.图1:验证 的漂白性 的漂白性 |
| B.图2:做钠在氯气中燃烧性质实验时,先将盛有氯气的集气瓶倒扣在钠块上,后加热 |
| C.图3:用碱石灰和无水醋酸钠固体制取甲烷 |
| D.图4:配制银氨溶液要振荡试管,进行银镜实验时不能振荡试管 |
您最近一年使用:0次
2 . 本实验将氨的制备与性质探究及尾气处理综合在一起进行一体化创新设计,实验使用氢氧化钠固体与浓氨水在常温下反应快速制备少量氨,省时高效。
(1)图中装置用到的玻璃实验仪器有______________ (填字母)。
a.具支试管 b.干燥管 c.试管架 d.烧瓶 e.烧杯 f.铁架台 g.橡胶塞
(2)①本实验改进了氨极易溶于水的喷泉实验,运用自制紫甘蓝溶液替代常规的水加无色酚酞溶液,使喷泉的颜色由_______________ 色变得绚丽多彩。
表1紫甘蓝指示剂变色范围
②本实验将氨的尾气吸收试剂(常规的吸收试剂为水或稀硫酸)改为水与无水乙醇以体积比1:1混合而成的乙醇溶液,其作用为___________________ 。
(3)实验步骤及现象分析
①检查装置气密性。如图所示连接好装置,打开开关__________________ (填“1”或“2”,下同),关闭开关__________________ ,使整个装置密闭。记录小注射器活塞的初始位置,缓慢向下拉大注射器活塞一段距离,松开大注射器活塞,观察,若大、小注射器活塞均回到原来的位置,则说明装置气密性良好。
②装入试剂,准备实验。本实验增设了氨与氯气的反应实验,增设实验中另选装置用高锰酸钾固体与浓盐酸在常温下反应快速制备氯气,写出该反应的离子方程式:__________________ 。
Ⅱ.探究氨气的还原性
已知:Cu2O为红色固体,在酸性溶液中不稳定: 。
。
(4)用装置A制备氨气,仪器接口的连接顺序为_________________ ,装置B的作用为_________________ ,实验开始前应先通一段时间的N2,其目的是_________________ 。_________________ 。

(1)图中装置用到的玻璃实验仪器有
a.具支试管 b.干燥管 c.试管架 d.烧瓶 e.烧杯 f.铁架台 g.橡胶塞
(2)①本实验改进了氨极易溶于水的喷泉实验,运用自制紫甘蓝溶液替代常规的水加无色酚酞溶液,使喷泉的颜色由
表1紫甘蓝指示剂变色范围
| pH | 1 | 2~3 | 4~6 | 7~9 | 10 | 11 | 12~14 |
| 紫甘蓝溶液颜色变化 | 深红 | 紫红 | 浅紫 | 蓝 | 青 | 绿 | 黄 |
(3)实验步骤及现象分析
①检查装置气密性。如图所示连接好装置,打开开关
②装入试剂,准备实验。本实验增设了氨与氯气的反应实验,增设实验中另选装置用高锰酸钾固体与浓盐酸在常温下反应快速制备氯气,写出该反应的离子方程式:
Ⅱ.探究氨气的还原性
已知:Cu2O为红色固体,在酸性溶液中不稳定:
 。
。(4)用装置A制备氨气,仪器接口的连接顺序为
A. 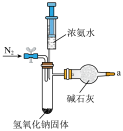 B.
B.  C.
C. 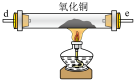 D.
D. 
您最近一年使用:0次
3 . 按照下图进行铜与浓硫酸反应的探究实验,下列说法正确的是
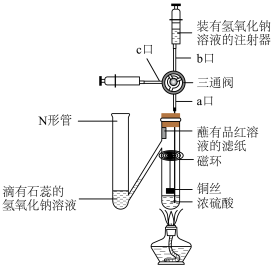
A.蘸有品红溶液的滤纸褪色,说明 具有强氧化性 具有强氧化性 |
| B.N形管溶液变为红色,说明有酸性气体进入N形管 |
| C.反应后,从c口抽取反应液加到足量的氨水中最终产生蓝色沉淀 |
| D.实验结束后从b口注入足量NaOH溶液,会有2种物质与NaOH反应 |
您最近一年使用:0次
解题方法
4 .  用途广泛。某实验小组同学围绕
用途广泛。某实验小组同学围绕 开展如下实验活动。
开展如下实验活动。
 .配制溶液
.配制溶液
(1)配制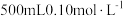 的
的 溶液,需要称量
溶液,需要称量 固体的质量为
固体的质量为___________  。
。
(2)上述配制溶液的过程中,用到的玻璃仪器除玻璃棒、量筒、胶头滴管外,还有___________ (填标号)。 .实验探究
.实验探究
探究温度对 溶液
溶液 的影响,进行如下实验(不考虑水的挥发)。
的影响,进行如下实验(不考虑水的挥发)。
(3) 溶液显碱性的原因是
溶液显碱性的原因是___________ (用离子方程式表示)。
(4)实验1中测得 ,可知当
,可知当 时,
时, 溶液的
溶液的 随温度升高而减小,这主要是
随温度升高而减小,这主要是 改变与水解平衡移动共同作用的结果,其中
改变与水解平衡移动共同作用的结果,其中___________ 发挥主导作用。实验1中测得 ,且当
,且当 时,实验过程中观察到有气泡产生。
时,实验过程中观察到有气泡产生。
(5)针对(4)中实验现象,小组同学继续开展探究。
查阅资料: 溶液中存在平衡:
溶液中存在平衡: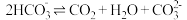 。
。
提出猜想:对于 溶液,当
溶液,当 时,该反应进行程度很小;当
时,该反应进行程度很小;当 时,该反应进行程度明显增大。
时,该反应进行程度明显增大。
实验验证:该小组同学设计如下方案进行实验,进一步验证猜想。补充表格内容。
实验结论:②根据实验1~3的结果,小组同学认为猜想成立,其判断依据是___________ 。
拓展总结:③ 溶液中存在
溶液中存在 的自偶电离平衡:
的自偶电离平衡: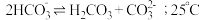 时,
时, 自偶电离的平衡常数为
自偶电离的平衡常数为___________ [保留两位有效数字;已知: 时,
时,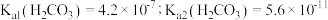 ]。当温度升高时,
]。当温度升高时, 更易分解,
更易分解, 从体系逸出,促进了
从体系逸出,促进了 在溶液中的分解。
在溶液中的分解。
(6)写出 在生产或生活中的一种应用
在生产或生活中的一种应用___________ 。
 用途广泛。某实验小组同学围绕
用途广泛。某实验小组同学围绕 开展如下实验活动。
开展如下实验活动。 .配制溶液
.配制溶液(1)配制
 的
的 溶液,需要称量
溶液,需要称量 固体的质量为
固体的质量为 。
。(2)上述配制溶液的过程中,用到的玻璃仪器除玻璃棒、量筒、胶头滴管外,还有
 .实验探究
.实验探究探究温度对
 溶液
溶液 的影响,进行如下实验(不考虑水的挥发)。
的影响,进行如下实验(不考虑水的挥发)。| 实验序号 | 操作 | 测试温度 |  |
| 1 | 采用水浴加热,将 溶液从 溶液从 持续升温至 持续升温至 ,每隔 ,每隔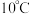 测量并记录溶液 测量并记录溶液 |  |  |
 |  | ||
 |  | ||
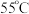 |  | ||
 | 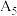 |
 溶液显碱性的原因是
溶液显碱性的原因是(4)实验1中测得
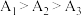 ,可知当
,可知当 时,
时, 溶液的
溶液的 随温度升高而减小,这主要是
随温度升高而减小,这主要是 改变与水解平衡移动共同作用的结果,其中
改变与水解平衡移动共同作用的结果,其中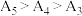 ,且当
,且当 时,实验过程中观察到有气泡产生。
时,实验过程中观察到有气泡产生。(5)针对(4)中实验现象,小组同学继续开展探究。
查阅资料:
 溶液中存在平衡:
溶液中存在平衡: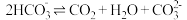 。
。提出猜想:对于
 溶液,当
溶液,当 时,该反应进行程度很小;当
时,该反应进行程度很小;当 时,该反应进行程度明显增大。
时,该反应进行程度明显增大。实验验证:该小组同学设计如下方案进行实验,进一步验证猜想。补充表格内容。
| 实验序号 | 操作 | 测试温度 |  |
| 2 | 采用水浴加热,① ,并记录溶液 ,并记录溶液 |  |  |
| 3 | 采用水浴加热,将 溶液从 溶液从 升温至 升温至 ,然后冷却至 ,然后冷却至 ,并记录溶液 ,并记录溶液 |  |  |
拓展总结:③
 溶液中存在
溶液中存在 的自偶电离平衡:
的自偶电离平衡: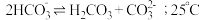 时,
时, 自偶电离的平衡常数为
自偶电离的平衡常数为 时,
时,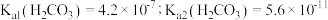 ]。当温度升高时,
]。当温度升高时, 更易分解,
更易分解, 从体系逸出,促进了
从体系逸出,促进了 在溶液中的分解。
在溶液中的分解。(6)写出
 在生产或生活中的一种应用
在生产或生活中的一种应用
您最近一年使用:0次
5 . 某小组利用电解原理探究一系列物质性质,装置如图所示。 呈绿色,能被氯气氧化。实验发现:Ⅱ中溶液先变浑浊,后变澄清;V中溶液由红色变无色。下列叙述正确的是
呈绿色,能被氯气氧化。实验发现:Ⅱ中溶液先变浑浊,后变澄清;V中溶液由红色变无色。下列叙述正确的是
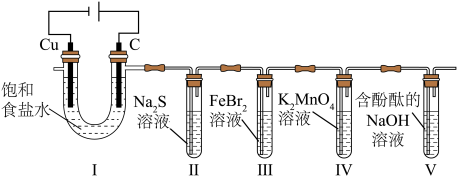
 呈绿色,能被氯气氧化。实验发现:Ⅱ中溶液先变浑浊,后变澄清;V中溶液由红色变无色。下列叙述正确的是
呈绿色,能被氯气氧化。实验发现:Ⅱ中溶液先变浑浊,后变澄清;V中溶液由红色变无色。下列叙述正确的是| A.I中铜电极和石墨电极可以互换 |
B.用 溶液可检验Ⅱ中是否生成了 溶液可检验Ⅱ中是否生成了 |
C.Ⅲ中 最多能消耗 最多能消耗 |
| D.Ⅳ中现象可能是绿色变为无色 |
您最近一年使用:0次
6 . 实验室用如图所示装置检验草酸晶体( )分解生成的含碳气体产物(不考虑草酸蒸气)。已知:常温下,CO通入
)分解生成的含碳气体产物(不考虑草酸蒸气)。已知:常温下,CO通入 的盐酸溶液中生成黑色Pd粉。下列说法错误的是
的盐酸溶液中生成黑色Pd粉。下列说法错误的是
 )分解生成的含碳气体产物(不考虑草酸蒸气)。已知:常温下,CO通入
)分解生成的含碳气体产物(不考虑草酸蒸气)。已知:常温下,CO通入 的盐酸溶液中生成黑色Pd粉。下列说法错误的是
的盐酸溶液中生成黑色Pd粉。下列说法错误的是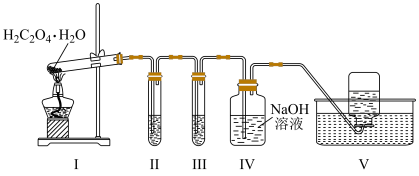
| A.Ⅰ中大试管口向上倾斜,可能因为草酸晶体的熔点低于分解温度 |
| B.由Ⅱ中现象可推断草酸晶体分解生成CO |
| C.Ⅱ、Ⅲ中现象可推断草酸晶体分解反应存在元素化合价变化 |
| D.可用燃烧法代替Ⅴ进行尾气处理 |
您最近一年使用:0次
7 . 某研究性学习小组探究硫的化合物的制备和性质。
Ⅰ.制备二氧化硫
用70%的浓硫酸与 固体反应制备
固体反应制备 气体。
气体。 气体最合适的发生装置是
气体最合适的发生装置是___________ (填写字母)。
Ⅱ.制备硫代硫酸钠
已知:硫代硫酸钠易与酸反应。
反应原理: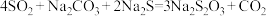
室温时,往 、
、 混合溶液中均匀通入
混合溶液中均匀通入 气体,一段时间后,溶液中有大量黄色浑浊物出现,然后浑浊物开始由黄变浅,当混合溶液pH接近于7时,停止通入
气体,一段时间后,溶液中有大量黄色浑浊物出现,然后浑浊物开始由黄变浅,当混合溶液pH接近于7时,停止通入 气体。
气体。
(2)制备 反应分三步进行
反应分三步进行
反应i: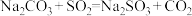 ;
;
反应ii: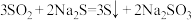 ;
;
反应iii的化学方程式为___________ 。
(3)当pH值接近于7时,停止通入 的原因是
的原因是___________ 。
Ⅲ.探究浓度对反应速率的影响
相同温度下,按下表中的体积将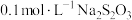 溶液、
溶液、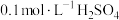 溶液与蒸馏水温合,并采集反应后浑浊度传感器数据。
溶液与蒸馏水温合,并采集反应后浑浊度传感器数据。
通过实验绘制出的浑浊度随时间变化关系如图所示:
___________ (实验标号)探究H2SO4溶液浓度对反应速率的影响。
②请在图中画出实验 对应的曲线
对应的曲线___________ 。
Ⅳ.探究性质
资料:
(5) 在酸性溶液中氧化I-,反应为:
在酸性溶液中氧化I-,反应为:___________ 。
向某浓度的过量 酸性溶液(含淀粉)中通入一定量SO2后,停止通气,刚开始时溶液无明显变化,t秒后溶液突然变蓝。
酸性溶液(含淀粉)中通入一定量SO2后,停止通气,刚开始时溶液无明显变化,t秒后溶液突然变蓝。
某实验小组提出假设:t秒前生成了 ,但
,但 继续与溶液中的
继续与溶液中的 反应,且该反应速率较快,故溶液没有立刻变蓝,是由于
反应,且该反应速率较快,故溶液没有立刻变蓝,是由于 与
与 反应SO2+I2+2H2O=2I—+SO
反应SO2+I2+2H2O=2I—+SO +4H+
+4H+
(6)为验证该实验小组的假设合理,设计下面实验:
操作:向变蓝色的溶液中___________ ;可观察到现象为:蓝色迅速消失,一段时间后再次变蓝。
应用:写出一个SO2相关性质在日常生活生产中的用途___________ 。
Ⅰ.制备二氧化硫
用70%的浓硫酸与
 固体反应制备
固体反应制备 气体。
气体。
 气体最合适的发生装置是
气体最合适的发生装置是Ⅱ.制备硫代硫酸钠
已知:硫代硫酸钠易与酸反应。
反应原理:
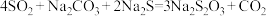
室温时,往
 、
、 混合溶液中均匀通入
混合溶液中均匀通入 气体,一段时间后,溶液中有大量黄色浑浊物出现,然后浑浊物开始由黄变浅,当混合溶液pH接近于7时,停止通入
气体,一段时间后,溶液中有大量黄色浑浊物出现,然后浑浊物开始由黄变浅,当混合溶液pH接近于7时,停止通入 气体。
气体。(2)制备
 反应分三步进行
反应分三步进行反应i:
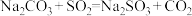 ;
;反应ii:
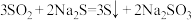 ;
;反应iii的化学方程式为
(3)当pH值接近于7时,停止通入
 的原因是
的原因是Ⅲ.探究浓度对反应速率的影响
相同温度下,按下表中的体积将
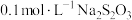 溶液、
溶液、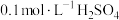 溶液与蒸馏水温合,并采集反应后浑浊度传感器数据。
溶液与蒸馏水温合,并采集反应后浑浊度传感器数据。| 实验标号 | 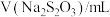 | 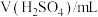 | V(蒸馏水)/mL |
| A | 1.5 | 3.5 | 10 |
| B | 2.5 | 3.5 | 9 |
| C | 3.5 | 3.5 | 8 |
| D | 3.5 | 2.5 | 9 |
| E | 3.5 | 1.5 | 10 |
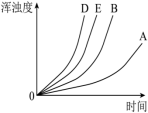
②请在图中画出实验
 对应的曲线
对应的曲线Ⅳ.探究性质
资料:
(5)
 在酸性溶液中氧化I-,反应为:
在酸性溶液中氧化I-,反应为:向某浓度的过量
 酸性溶液(含淀粉)中通入一定量SO2后,停止通气,刚开始时溶液无明显变化,t秒后溶液突然变蓝。
酸性溶液(含淀粉)中通入一定量SO2后,停止通气,刚开始时溶液无明显变化,t秒后溶液突然变蓝。某实验小组提出假设:t秒前生成了
 ,但
,但 继续与溶液中的
继续与溶液中的 反应,且该反应速率较快,故溶液没有立刻变蓝,是由于
反应,且该反应速率较快,故溶液没有立刻变蓝,是由于 与
与 反应SO2+I2+2H2O=2I—+SO
反应SO2+I2+2H2O=2I—+SO +4H+
+4H+(6)为验证该实验小组的假设合理,设计下面实验:
操作:向变蓝色的溶液中
应用:写出一个SO2相关性质在日常生活生产中的用途
您最近一年使用:0次
名校
8 . 某小组在实验室用NaClO溶液和NH3反应制备肼(N2H4),并进行相关性质探究实验。
Ⅰ.实验室制备N2H4___________ 。
(2)装置长颈漏斗的作用___________ 。
(3)制备N2H4的离子方程式___________ 。
Ⅱ.测定产品中水合肼(N2H4·H2O)的含量
(4)称取产品6.0g,加入适量NaHCO3固体(调节溶液的pH保持在6.5左右),加水配成250mL溶液,移取25.00mL置于锥形瓶中,并滴加2~3滴淀粉溶液,用0.3000mol/L的碘标准溶液滴定(已知:N2H4·H2O+2I2=N2↑+4HI+H2O)。
①滴定到达终点的现象是___________ 。
②重复上述滴定实验2~3次,测得消耗碘标准溶液的平均值为20.00mL,产品中水合肼的质量分数为___________ 。
Ⅲ.探究肼的化学性质。将制得的肼分离提纯后,进行如下实验。
【提出假设】黑色固体可能是Ag、Ag2O中的一种或两种。
【实验验证】
(5)设计如下方案,进行实验。
③综合上述实验,肼具有的性质是___________
(6)N2H4是一种二元弱碱,在水中的电离与NH3相似,写出肼的第一步电离方程式___________ 。
Ⅰ.实验室制备N2H4

(2)装置长颈漏斗的作用
(3)制备N2H4的离子方程式
Ⅱ.测定产品中水合肼(N2H4·H2O)的含量
(4)称取产品6.0g,加入适量NaHCO3固体(调节溶液的pH保持在6.5左右),加水配成250mL溶液,移取25.00mL置于锥形瓶中,并滴加2~3滴淀粉溶液,用0.3000mol/L的碘标准溶液滴定(已知:N2H4·H2O+2I2=N2↑+4HI+H2O)。
①滴定到达终点的现象是
②重复上述滴定实验2~3次,测得消耗碘标准溶液的平均值为20.00mL,产品中水合肼的质量分数为
Ⅲ.探究肼的化学性质。将制得的肼分离提纯后,进行如下实验。

【提出假设】黑色固体可能是Ag、Ag2O中的一种或两种。
【实验验证】
(5)设计如下方案,进行实验。
| 操作 | 现象 | 结论 |
| ⅰ.取少量黑色固体于试管中,加入足量① | 黑色固体部分溶解 | 黑色固体有Ag2O |
| ⅱ.取少量黑色固体于试管中,加入足量稀硝酸,振荡。 | ② | 黑色固体是Ag和Ag2O |
(6)N2H4是一种二元弱碱,在水中的电离与NH3相似,写出肼的第一步电离方程式
您最近一年使用:0次
名校
解题方法
9 . 实验小组探究溶液酸碱性对含锰化合物和 氧化还原反应的影响。
氧化还原反应的影响。
资料: .
. 呈绿色,
呈绿色, 为棕黑色沉淀,
为棕黑色沉淀, 几乎无色。
几乎无色。
 .
. 在强碱性溶液中能稳定存在,在酸性、中性或弱碱性溶液中易转化为
在强碱性溶液中能稳定存在,在酸性、中性或弱碱性溶液中易转化为 和
和 。
。
 .
. 的还原产物与溶液酸碱性有关,通常酸性条件下被还原为
的还原产物与溶液酸碱性有关,通常酸性条件下被还原为 ,中性条件下被还原为
,中性条件下被还原为 ,碱性条件下被还原为
,碱性条件下被还原为 。
。
 .
. 为微溶物。
为微溶物。
已知:实验 、
、 、
、 中
中 均被氧化为
均被氧化为 。下列说法不正确的是
。下列说法不正确的是
 氧化还原反应的影响。
氧化还原反应的影响。资料:
 .
. 呈绿色,
呈绿色, 为棕黑色沉淀,
为棕黑色沉淀, 几乎无色。
几乎无色。 .
. 在强碱性溶液中能稳定存在,在酸性、中性或弱碱性溶液中易转化为
在强碱性溶液中能稳定存在,在酸性、中性或弱碱性溶液中易转化为 和
和 。
。 .
. 的还原产物与溶液酸碱性有关,通常酸性条件下被还原为
的还原产物与溶液酸碱性有关,通常酸性条件下被还原为 ,中性条件下被还原为
,中性条件下被还原为 ,碱性条件下被还原为
,碱性条件下被还原为 。
。 .
. 为微溶物。
为微溶物。| 实验 | 序号 | 试剂 | 现象 |
| i.先加试剂a ii.再加试剂b
|  | a:10滴3mol/LH2SO4溶液 b:20滴0.002mol/LNa2S2O3溶液 | 溶液紫色变浅至接近无色,静置一段时间后出现乳白色浑浊 |
 | a:10滴蒸馏水 b:20滴0.002mol/LNa2S2O3溶液 | 产生棕黑色沉淀 | |
 | a:x滴6mol/LNaOH溶液 b:20滴0.002mol/LNa2S2O3溶液 | 溶液变为绿色,无沉淀生成;静置5min,绿色变浅,有棕黑色沉淀生成 |
 、
、 、
、 中
中 均被氧化为
均被氧化为 。下列说法不正确的是
。下列说法不正确的是A.实验 中出现乳白色浑浊发生反应:S2O 中出现乳白色浑浊发生反应:S2O +2H+=SO2↑+S↓+H2O +2H+=SO2↑+S↓+H2O |
B.实验 所得溶液中 所得溶液中 的检验:取少量溶液加入足量 的检验:取少量溶液加入足量 ,若有白色沉淀生成,则说明有 ,若有白色沉淀生成,则说明有 |
| C.x=10 |
D.实验 产生棕黑色沉淀可能原因是 产生棕黑色沉淀可能原因是 碱性减弱后不稳定生成 碱性减弱后不稳定生成 棕黑色沉淀 棕黑色沉淀 |
您最近一年使用:0次
名校
解题方法
10 . 含氮物质是一类常见物质,在人们的生产、生活活动中有重要作用。
(1)实验室中,采用一定浓度的NaNO2溶液和NH4Cl溶液作为反应物,通过加热制备少量N2。_______ ,收集N2的方法是_______ (填标号)。
②实验小组同学设计以下实验探究上述反应的速率与c(NaNO2)的关系
③V1=_______ ,V3=_______ 。
④已知该反应的速率方程为 ,k为反应速率常数。根据上述实验数据,m=
,k为反应速率常数。根据上述实验数据,m=_______ (填整数)。
(2)“侯氏制碱法”是中国人的骄傲,上述实验中需用到的NH4Cl是“侯氏制碱法”的副产物。实验小组模拟“侯氏制碱法”的原理,在实验室中制备少量NaHCO3,使用的装置如下图:_______ ←d(填接口序号);由该装置可知,该实验中制备NH3需用到的试剂是_______ (填化学式)。
(3)实验小组在实验中,将1.0mol·L-1NaNO2溶液滴入pH=0.5的1.0mol·L-1FeSO4溶液中,观察到溶液为棕色,而不是预期的黄色。于是他们进行以下实验探究。
①查阅资料常温下,[Fe(NO)]2+在溶液中能稳定存在,溶液为棕色,受热分解释放出NO。
②提出猜想溶液的棕色来源于[Fe(NO)]2+,且[Fe(NO)]2+的颜色掩盖了Fe3+的黄色。
③设计实验、验证猜想
④实验现象及分析
i.实验5溶液变红色,说明溶液中存在Fe3+,Fe3+的来源是_______ (写出离子方程式);
ii.实验6观察到_______ (填实验现象),证明溶液呈棕色是因为存在[Fe(NO)]2+,且其颜色掩盖了Fe3+的黄色。
(1)实验室中,采用一定浓度的NaNO2溶液和NH4Cl溶液作为反应物,通过加热制备少量N2。

②实验小组同学设计以下实验探究上述反应的速率与c(NaNO2)的关系
| 实验编号 | 溶液体积/mL | 收集1.0mLN2所用时间/s | |||
| NaNO2溶液 | NH4Cl溶液 | 醋酸 | 水 | ||
| 1 | 4.0 | 4.0 | 4.0 | 8.0 | 334 |
| 2 | V1 | 4.0 | 4.0 | V3 | 150 |
| 3 | 8.0 | 4.0 | 4.0 | 4.0 | 83 |
| 4 | 12.0 | 4.0 | 4.0 | 0.0 | 38 |
④已知该反应的速率方程为
 ,k为反应速率常数。根据上述实验数据,m=
,k为反应速率常数。根据上述实验数据,m=(2)“侯氏制碱法”是中国人的骄傲,上述实验中需用到的NH4Cl是“侯氏制碱法”的副产物。实验小组模拟“侯氏制碱法”的原理,在实验室中制备少量NaHCO3,使用的装置如下图:

(3)实验小组在实验中,将1.0mol·L-1NaNO2溶液滴入pH=0.5的1.0mol·L-1FeSO4溶液中,观察到溶液为棕色,而不是预期的黄色。于是他们进行以下实验探究。
①查阅资料常温下,[Fe(NO)]2+在溶液中能稳定存在,溶液为棕色,受热分解释放出NO。
②提出猜想溶液的棕色来源于[Fe(NO)]2+,且[Fe(NO)]2+的颜色掩盖了Fe3+的黄色。
③设计实验、验证猜想
| 实验编号 | 5 | 6 |
| 操作方法 | 取上述滴有NaNO2溶液的棕色混合液,向其中滴加稀KSCN溶液 | 取上述棕色混合液,按下图所示加热
|
i.实验5溶液变红色,说明溶液中存在Fe3+,Fe3+的来源是
ii.实验6观察到
您最近一年使用:0次





