名校
解题方法
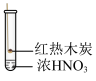
1 . 下述实验中均有红棕色气体产生,对比分析所得结论不正确的是
|
|
|
| ① | ② | ③ |
A.①中发生了反应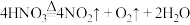 |
| B.由②中产生红棕色气体可推测木炭与浓硝酸发生了反应 |
| C.由③中有红棕色可推测出浓硝酸可能具有挥发性 |
D.③的气体产物中检测出 ,不能得出木炭与浓硝酸发生反应的结论 ,不能得出木炭与浓硝酸发生反应的结论 |
您最近一年使用:0次
2024-05-31更新
|
248次组卷
|
2卷引用:北京市昌平区2023-2024学年高三下学期二模化学试题
解题方法
2 . 煤的化学活性是评价煤气化或燃烧性能的一项重要指标,可用与焦炭(由煤样制得)反应的CO2的转化率 来表示。研究小组设计模拟实验探究煤燃烧产物的转化率装置如下:
来表示。研究小组设计模拟实验探究煤燃烧产物的转化率装置如下:___________ 。
(2)装置Ⅰ中,仪器a的名称是___________ ;b的作用是___________ 。
(3)装置Ⅱ中,CO2从下口通入的原因是___________ 。气体X的成分有:___________ 。
(4)装置Ⅲ中,d中的现象是___________ 。e中生成的固体为Ag,则反应的离子方程式为___________ 。
 来表示。研究小组设计模拟实验探究煤燃烧产物的转化率装置如下:
来表示。研究小组设计模拟实验探究煤燃烧产物的转化率装置如下:
(2)装置Ⅰ中,仪器a的名称是
(3)装置Ⅱ中,CO2从下口通入的原因是
(4)装置Ⅲ中,d中的现象是
您最近一年使用:0次
3 . 根据下列实验的操作和现象,可以说明相应结论的是
| 选项 | 操作 | 现象 | 结论 |
| A | 将乙醇和浓硫酸的混合液加热,将生成的气体通入溴水中 | 溴水褪色 | 乙醇发生了消去反应 |
| B | 取一定质量久置的亚硫酸钠固体于试管中,加蒸馏水完全溶解后,滴加BaCl2溶液 | 产生白色沉淀 | 亚硫酸钠变质 |
| C | 常温下,将两块相同的未经打磨的铝片分别投入5.0mL饱和的CuSO4溶液和CuCl2溶液中 | 前者无明显现象,后者迅速反应,现象明显 | Cl-能加速破坏铝片表面的氧化膜 |
| D | 探究氢离子浓度对 、 、 相互转化的影响 相互转化的影响 | 向K2CrO4溶液中缓慢滴加硫酸,黄色变为橙红色 | 增大氢离子浓度,转化平衡向生成 的方向移动 的方向移动 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
解题方法
4 . 下列各组实验中,实验操作、现象及结论或解释均正确的是
| 选项 | 实验操作 | 实验现象 | 结论或解释 |
| A | 在火焰上灼烧搅拌过某无色溶液的玻璃棒 | 火焰出现黄色 | 溶液中含Na元素 |
| B | 在干冰中央挖一个小穴,撒一些镁粉,用红热的铁棒把镁引燃,盖上另一块干冰 | 镁粉在干冰中继续燃烧,发出耀眼的白光 | CO2不能扑灭金属镁引起的火灾 |
| C | 向K2S溶液中通入足量的CO2,然后将产生的气体导入CuSO4溶液中 | CuSO4溶液中产生黑色沉淀 | Ka1(H2S)>Ka1(H2CO3) |
| D | 向蔗糖中加入适量浓硫酸,搅拌 | 产生黑色“面包” | 浓硫酸具有酸性和吸水性 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2024-05-30更新
|
174次组卷
|
2卷引用:2023-2024学年广东省汕头市汕头金南实验学校三模化学试题
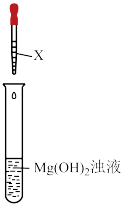
5 . 物质的性质除主要与物质的结构有关外还与外界条件有关。有人提出“ 与干燥的
与干燥的 不反应”和“
不反应”和“ 与潮湿的
与潮湿的 才能反应”,某小组设计如下实验路线。
才能反应”,某小组设计如下实验路线。___________ 。
(2)为了验证 与干燥的
与干燥的 是否反应,连接好装置,X是
是否反应,连接好装置,X是___________ 。打开___________ ,关闭___________ ,打开分液漏斗的活塞加入稀硫酸,产生气体一段时间,再在干燥管中装入干燥的 ,继续通入一段时间气体,点燃酒精灯加热铜丝,观察现象。则加入稀硫酸,产生一段时间气体后再点燃酒精灯的目的是
,继续通入一段时间气体,点燃酒精灯加热铜丝,观察现象。则加入稀硫酸,产生一段时间气体后再点燃酒精灯的目的是___________ 。
(3)若打开 ,关闭
,关闭 ,加入稀硫酸,点燃酒精灯,观察到
,加入稀硫酸,点燃酒精灯,观察到___________ 现象,___________ (选填“能”或“不能”)证明潮湿的 与
与 反应产生了
反应产生了 。请用化学方程式解释产生该现象的原因
。请用化学方程式解释产生该现象的原因___________ 。
(4)为验证第(3)实验产生的现象 是否与
是否与 反应,某小组取球形干燥管中反应后的固体溶于水中。然后向溶液中滴加
反应,某小组取球形干燥管中反应后的固体溶于水中。然后向溶液中滴加___________ ,产生___________ 现象说明 参与反应。
参与反应。
 与干燥的
与干燥的 不反应”和“
不反应”和“ 与潮湿的
与潮湿的 才能反应”,某小组设计如下实验路线。
才能反应”,某小组设计如下实验路线。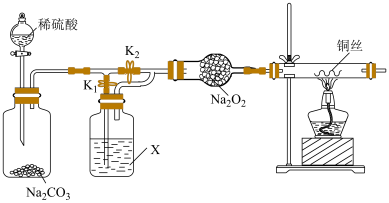
(2)为了验证
 与干燥的
与干燥的 是否反应,连接好装置,X是
是否反应,连接好装置,X是 ,继续通入一段时间气体,点燃酒精灯加热铜丝,观察现象。则加入稀硫酸,产生一段时间气体后再点燃酒精灯的目的是
,继续通入一段时间气体,点燃酒精灯加热铜丝,观察现象。则加入稀硫酸,产生一段时间气体后再点燃酒精灯的目的是(3)若打开
 ,关闭
,关闭 ,加入稀硫酸,点燃酒精灯,观察到
,加入稀硫酸,点燃酒精灯,观察到 与
与 反应产生了
反应产生了 。请用化学方程式解释产生该现象的原因
。请用化学方程式解释产生该现象的原因(4)为验证第(3)实验产生的现象
 是否与
是否与 反应,某小组取球形干燥管中反应后的固体溶于水中。然后向溶液中滴加
反应,某小组取球形干燥管中反应后的固体溶于水中。然后向溶液中滴加 参与反应。
参与反应。
您最近一年使用:0次
2024-05-30更新
|
271次组卷
|
2卷引用:2024届辽宁省部分学校高三下学期联考三模化学试题
解题方法
6 .  用途广泛。某实验小组同学围绕
用途广泛。某实验小组同学围绕 开展如下实验活动。
开展如下实验活动。
 .配制溶液
.配制溶液
(1)配制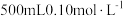 的
的 溶液,需要称量
溶液,需要称量 固体的质量为
固体的质量为___________  。
。
(2)上述配制溶液的过程中,用到的玻璃仪器除玻璃棒、量筒、胶头滴管外,还有___________ (填标号)。 .实验探究
.实验探究
探究温度对 溶液
溶液 的影响,进行如下实验(不考虑水的挥发)。
的影响,进行如下实验(不考虑水的挥发)。
(3) 溶液显碱性的原因是
溶液显碱性的原因是___________ (用离子方程式表示)。
(4)实验1中测得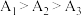 ,可知当
,可知当 时,
时, 溶液的
溶液的 随温度升高而减小,这主要是
随温度升高而减小,这主要是 改变与水解平衡移动共同作用的结果,其中
改变与水解平衡移动共同作用的结果,其中___________ 发挥主导作用。实验1中测得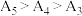 ,且当
,且当 时,实验过程中观察到有气泡产生。
时,实验过程中观察到有气泡产生。
(5)针对(4)中实验现象,小组同学继续开展探究。
查阅资料: 溶液中存在平衡:
溶液中存在平衡: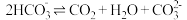 。
。
提出猜想:对于 溶液,当
溶液,当 时,该反应进行程度很小;当
时,该反应进行程度很小;当 时,该反应进行程度明显增大。
时,该反应进行程度明显增大。
实验验证:该小组同学设计如下方案进行实验,进一步验证猜想。补充表格内容。
实验结论:②根据实验1~3的结果,小组同学认为猜想成立,其判断依据是___________ 。
拓展总结:③ 溶液中存在
溶液中存在 的自偶电离平衡:
的自偶电离平衡: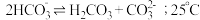 时,
时, 自偶电离的平衡常数为
自偶电离的平衡常数为___________ [保留两位有效数字;已知: 时,
时,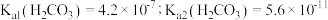 ]。当温度升高时,
]。当温度升高时, 更易分解,
更易分解, 从体系逸出,促进了
从体系逸出,促进了 在溶液中的分解。
在溶液中的分解。
(6)写出 在生产或生活中的一种应用
在生产或生活中的一种应用___________ 。
 用途广泛。某实验小组同学围绕
用途广泛。某实验小组同学围绕 开展如下实验活动。
开展如下实验活动。 .配制溶液
.配制溶液(1)配制
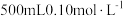 的
的 溶液,需要称量
溶液,需要称量 固体的质量为
固体的质量为 。
。(2)上述配制溶液的过程中,用到的玻璃仪器除玻璃棒、量筒、胶头滴管外,还有
 .实验探究
.实验探究探究温度对
 溶液
溶液 的影响,进行如下实验(不考虑水的挥发)。
的影响,进行如下实验(不考虑水的挥发)。| 实验序号 | 操作 | 测试温度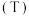 |  |
| 1 | 采用水浴加热,将 溶液从 溶液从 持续升温至 持续升温至 ,每隔 ,每隔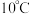 测量并记录溶液 测量并记录溶液 |  |  |
 |  | ||
 |  | ||
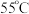 |  | ||
 | 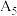 |
(3)
 溶液显碱性的原因是
溶液显碱性的原因是(4)实验1中测得
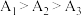 ,可知当
,可知当 时,
时, 溶液的
溶液的 随温度升高而减小,这主要是
随温度升高而减小,这主要是 改变与水解平衡移动共同作用的结果,其中
改变与水解平衡移动共同作用的结果,其中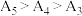 ,且当
,且当 时,实验过程中观察到有气泡产生。
时,实验过程中观察到有气泡产生。(5)针对(4)中实验现象,小组同学继续开展探究。
查阅资料:
 溶液中存在平衡:
溶液中存在平衡: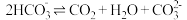 。
。提出猜想:对于
 溶液,当
溶液,当 时,该反应进行程度很小;当
时,该反应进行程度很小;当 时,该反应进行程度明显增大。
时,该反应进行程度明显增大。实验验证:该小组同学设计如下方案进行实验,进一步验证猜想。补充表格内容。
| 实验序号 | 操作 | 测试温度 |  |
| 2 | 采用水浴加热,① ,并记录溶液 ,并记录溶液 |  |  |
| 3 | 采用水浴加热,将 溶液从 溶液从 升温至 升温至 ,然后冷却至 ,然后冷却至 ,并记录溶液 ,并记录溶液 |  |  |
拓展总结:③
 溶液中存在
溶液中存在 的自偶电离平衡:
的自偶电离平衡: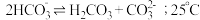 时,
时, 自偶电离的平衡常数为
自偶电离的平衡常数为 时,
时,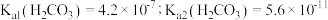 ]。当温度升高时,
]。当温度升高时, 更易分解,
更易分解, 从体系逸出,促进了
从体系逸出,促进了 在溶液中的分解。
在溶液中的分解。(6)写出
 在生产或生活中的一种应用
在生产或生活中的一种应用
您最近一年使用:0次
2024-05-29更新
|
682次组卷
|
2卷引用:广东省深圳市2024届高三二模考试化学试题
7 . 锰的化合物用途与性质的探究,有关物质及颜色: (白色)、
(白色)、 (棕黑色)、
(棕黑色)、 (绿色)、
(绿色)、 (紫色)。回答问题:
(紫色)。回答问题:
Ⅰ.用 溶液氧化甲苯制苯甲酸,按如下流程分离苯甲酸和回收甲苯。
溶液氧化甲苯制苯甲酸,按如下流程分离苯甲酸和回收甲苯。
(1)操作Ⅰ为______ ,操作Ⅱ为______ 。
(2)无色液体A是______ ,.定性检验A的试剂是______ ,现象是____________ 。
(3)该同学推测白色固体B是苯甲酸与少量KCl的混合物,简述提纯过程____________ 。
Ⅱ.探究 在一定条件下被
在一定条件下被 或
或 氧化成的产物,实验装置如图(夹持装置略):
氧化成的产物,实验装置如图(夹持装置略): 前产生白色沉淀,在空气中缓慢变成棕黑色沉淀;通入
前产生白色沉淀,在空气中缓慢变成棕黑色沉淀;通入 后棕黑色沉淀增多,放置后溶液变为紫色,仍有沉淀。
后棕黑色沉淀增多,放置后溶液变为紫色,仍有沉淀。
实验ⅱ:物质a为40% KOH溶液,C中通入 前后与实验ⅰ现象一样。
前后与实验ⅰ现象一样。
(4)通入 前,C中沉淀由白色变为黑色的化学方程式为
前,C中沉淀由白色变为黑色的化学方程式为____________ 。
(5) 的氧化性与溶液的酸碱性无关,KClO的氧化性随碱性减弱而增强。取ⅰ中放置后的1 mL悬浊液,再加入4 mL水,溶液紫色缓慢加深,发生的反应是
的氧化性与溶液的酸碱性无关,KClO的氧化性随碱性减弱而增强。取ⅰ中放置后的1 mL悬浊液,再加入4 mL水,溶液紫色缓慢加深,发生的反应是____________ 。
(6)浓碱条件下, 可被
可被 还原为
还原为 。取ⅱ中放置后的1 mL悬浊液,再加4 mL 40% KOH溶液,溶液紫色迅速变为绿色,溶液紫色变为绿色的离子方程式为
。取ⅱ中放置后的1 mL悬浊液,再加4 mL 40% KOH溶液,溶液紫色迅速变为绿色,溶液紫色变为绿色的离子方程式为____________ 。
(7)从反应速率的角度,分析实验ⅱ未得到绿色溶液的可能原因____________ 。
 (白色)、
(白色)、 (棕黑色)、
(棕黑色)、 (绿色)、
(绿色)、 (紫色)。回答问题:
(紫色)。回答问题:Ⅰ.用
 溶液氧化甲苯制苯甲酸,按如下流程分离苯甲酸和回收甲苯。
溶液氧化甲苯制苯甲酸,按如下流程分离苯甲酸和回收甲苯。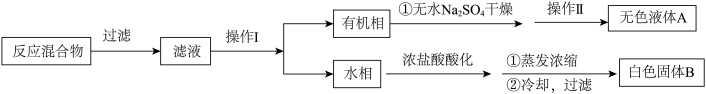
(1)操作Ⅰ为
(2)无色液体A是
(3)该同学推测白色固体B是苯甲酸与少量KCl的混合物,简述提纯过程
Ⅱ.探究
 在一定条件下被
在一定条件下被 或
或 氧化成的产物,实验装置如图(夹持装置略):
氧化成的产物,实验装置如图(夹持装置略):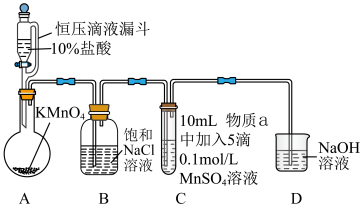
 前产生白色沉淀,在空气中缓慢变成棕黑色沉淀;通入
前产生白色沉淀,在空气中缓慢变成棕黑色沉淀;通入 后棕黑色沉淀增多,放置后溶液变为紫色,仍有沉淀。
后棕黑色沉淀增多,放置后溶液变为紫色,仍有沉淀。实验ⅱ:物质a为40% KOH溶液,C中通入
 前后与实验ⅰ现象一样。
前后与实验ⅰ现象一样。(4)通入
 前,C中沉淀由白色变为黑色的化学方程式为
前,C中沉淀由白色变为黑色的化学方程式为(5)
 的氧化性与溶液的酸碱性无关,KClO的氧化性随碱性减弱而增强。取ⅰ中放置后的1 mL悬浊液,再加入4 mL水,溶液紫色缓慢加深,发生的反应是
的氧化性与溶液的酸碱性无关,KClO的氧化性随碱性减弱而增强。取ⅰ中放置后的1 mL悬浊液,再加入4 mL水,溶液紫色缓慢加深,发生的反应是(6)浓碱条件下,
 可被
可被 还原为
还原为 。取ⅱ中放置后的1 mL悬浊液,再加4 mL 40% KOH溶液,溶液紫色迅速变为绿色,溶液紫色变为绿色的离子方程式为
。取ⅱ中放置后的1 mL悬浊液,再加4 mL 40% KOH溶液,溶液紫色迅速变为绿色,溶液紫色变为绿色的离子方程式为(7)从反应速率的角度,分析实验ⅱ未得到绿色溶液的可能原因
您最近一年使用:0次
8 . 某化学兴趣小组欲探究氢氧化镁固体在氯化铵中溶解的原因,进行了如下实验:
已知:①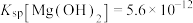 ;②常温下,
;②常温下, 的电离常数
的电离常数 ,
, 的电离常数
的电离常数 。
。
关于以上实验,下列说法错误的是
| 操作 | 实验序号 | 试剂X | 实验现象 |
| 实验一 | 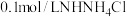 溶液,5.0mL 溶液,5.0mL | 白色浊液逐渐变澄清 |
| 实验二 | 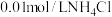 溶液,5.0mL 溶液,5.0mL | 白色浊液变化不明显 | |
| 实验三 | 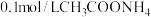 溶液,5.0mL 溶液,5.0mL | 白色浊液逐渐变澄清 | |
| 实验四 | 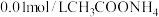 溶液,5.0mL 溶液,5.0mL | 白色浊液变化不明显 | |
| 实验五 | 0.01mol/L蒸馏水,5.0mL | 白色浊液变化不明显 |
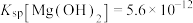 ;②常温下,
;②常温下, 的电离常数
的电离常数 ,
, 的电离常数
的电离常数 。
。关于以上实验,下列说法错误的是
| A.只通过实验一和二,氢氧化镁溶解可能是铵根或者氢离子作用的结果 |
B.若加入试剂X为0.1mol/LHCl溶液5mL,实验现象为白色浊液逐渐变澄清,与实验一形成对照,可以说明 被 被 溶解 溶解 |
C.实验三和四中加入 可以排除 可以排除 的干扰,因为 的干扰,因为 溶液显中性 溶液显中性 |
D.通过以上四个实验证明, 溶解的原因是和 溶解的原因是和 形成了更难电离的 形成了更难电离的 |
您最近一年使用:0次
解题方法
9 . 下列关于实验的描述说法错误的是

A.图1:验证 的漂白性 的漂白性 |
| B.图2:做钠在氯气中燃烧性质实验时,先将盛有氯气的集气瓶倒扣在钠块上,后加热 |
| C.图3:用碱石灰和无水醋酸钠固体制取甲烷 |
| D.图4:配制银氨溶液要振荡试管,进行银镜实验时不能振荡试管 |
您最近一年使用:0次
10 . 本实验将氨的制备与性质探究及尾气处理综合在一起进行一体化创新设计,实验使用氢氧化钠固体与浓氨水在常温下反应快速制备少量氨,省时高效。
(1)图中装置用到的玻璃实验仪器有______________ (填字母)。
a.具支试管 b.干燥管 c.试管架 d.烧瓶 e.烧杯 f.铁架台 g.橡胶塞
(2)①本实验改进了氨极易溶于水的喷泉实验,运用自制紫甘蓝溶液替代常规的水加无色酚酞溶液,使喷泉的颜色由_______________ 色变得绚丽多彩。
表1紫甘蓝指示剂变色范围
②本实验将氨的尾气吸收试剂(常规的吸收试剂为水或稀硫酸)改为水与无水乙醇以体积比1:1混合而成的乙醇溶液,其作用为___________________ 。
(3)实验步骤及现象分析
①检查装置气密性。如图所示连接好装置,打开开关__________________ (填“1”或“2”,下同),关闭开关__________________ ,使整个装置密闭。记录小注射器活塞的初始位置,缓慢向下拉大注射器活塞一段距离,松开大注射器活塞,观察,若大、小注射器活塞均回到原来的位置,则说明装置气密性良好。
②装入试剂,准备实验。本实验增设了氨与氯气的反应实验,增设实验中另选装置用高锰酸钾固体与浓盐酸在常温下反应快速制备氯气,写出该反应的离子方程式:__________________ 。
Ⅱ.探究氨气的还原性
已知:Cu2O为红色固体,在酸性溶液中不稳定: 。
。
(4)用装置A制备氨气,仪器接口的连接顺序为_________________ ,装置B的作用为_________________ ,实验开始前应先通一段时间的N2,其目的是_________________ 。_________________ 。

(1)图中装置用到的玻璃实验仪器有
a.具支试管 b.干燥管 c.试管架 d.烧瓶 e.烧杯 f.铁架台 g.橡胶塞
(2)①本实验改进了氨极易溶于水的喷泉实验,运用自制紫甘蓝溶液替代常规的水加无色酚酞溶液,使喷泉的颜色由
表1紫甘蓝指示剂变色范围
| pH | 1 | 2~3 | 4~6 | 7~9 | 10 | 11 | 12~14 |
| 紫甘蓝溶液颜色变化 | 深红 | 紫红 | 浅紫 | 蓝 | 青 | 绿 | 黄 |
(3)实验步骤及现象分析
①检查装置气密性。如图所示连接好装置,打开开关
②装入试剂,准备实验。本实验增设了氨与氯气的反应实验,增设实验中另选装置用高锰酸钾固体与浓盐酸在常温下反应快速制备氯气,写出该反应的离子方程式:
Ⅱ.探究氨气的还原性
已知:Cu2O为红色固体,在酸性溶液中不稳定:
 。
。(4)用装置A制备氨气,仪器接口的连接顺序为
A. 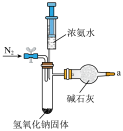 B.
B.  C.
C.  D.
D. 
您最近一年使用:0次