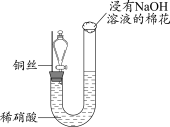
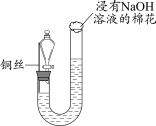
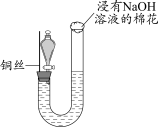
1 . 过二硫酸钠( )也叫高硫酸钠,可用于废气处理及有害物质的氧化降解。用
)也叫高硫酸钠,可用于废气处理及有害物质的氧化降解。用 溶液和一定浓度的NaOH溶液混合可制得
溶液和一定浓度的NaOH溶液混合可制得 晶体。实验室制备
晶体。实验室制备 晶体的装置如下图所示:
晶体的装置如下图所示: 。
。
(1)写出装置中生成 的反应的化学方程式:
的反应的化学方程式:___________ 。
(2)盛装NaOH溶液的仪器名称为___________ ,持续通入氮气的目的是___________ 。
(3)装置中硫酸的作用是___________ 。
(4)某兴趣小组设计实验探究不同环境下 氧化性的强弱。将
氧化性的强弱。将 (1.69g)与过量
(1.69g)与过量 (10g)溶于水中形成的混合溶液煮沸3min,观察并记录加入试剂时和加热过程中的现象(如下表所示)。
(10g)溶于水中形成的混合溶液煮沸3min,观察并记录加入试剂时和加热过程中的现象(如下表所示)。
①在___________ (填“中性”“酸性”或“碱性”)条件下, 的氧化能力最强。
的氧化能力最强。
②若用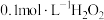 溶液滴定碱性氧化反应后的溶液(先将溶液调至酸性再滴定),滴定终点时的现象为
溶液滴定碱性氧化反应后的溶液(先将溶液调至酸性再滴定),滴定终点时的现象为___________ ;达到滴定终点时,消耗 溶液的体积为
溶液的体积为 。则碱性氧化后的溶液中
。则碱性氧化后的溶液中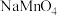 的质量为
的质量为___________ g(用含 的代数式表示,
的代数式表示,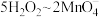 )
)
 )也叫高硫酸钠,可用于废气处理及有害物质的氧化降解。用
)也叫高硫酸钠,可用于废气处理及有害物质的氧化降解。用 溶液和一定浓度的NaOH溶液混合可制得
溶液和一定浓度的NaOH溶液混合可制得 晶体。实验室制备
晶体。实验室制备 晶体的装置如下图所示:
晶体的装置如下图所示: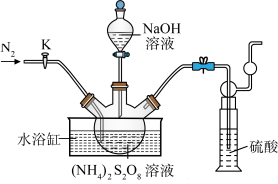
 。
。(1)写出装置中生成
 的反应的化学方程式:
的反应的化学方程式:(2)盛装NaOH溶液的仪器名称为
(3)装置中硫酸的作用是
(4)某兴趣小组设计实验探究不同环境下
 氧化性的强弱。将
氧化性的强弱。将 (1.69g)与过量
(1.69g)与过量 (10g)溶于水中形成的混合溶液煮沸3min,观察并记录加入试剂时和加热过程中的现象(如下表所示)。
(10g)溶于水中形成的混合溶液煮沸3min,观察并记录加入试剂时和加热过程中的现象(如下表所示)。| 环境 | 调节溶液氧化环境时的现象 | 加热煮沸3min期间产生的现象 |
| 中性 | 加入VmL蒸馏水,无明显现象 | 30s时开始有大量气泡冒出,3min后溶液变为深棕色,溶液中有悬浮小颗粒 |
| 碱性 | 加入VmL某浓度的NaOH溶液,瞬间变为棕色( ) ) | 10s后溶液逐渐变为深紫色( ),没有明显冒气泡现象 ),没有明显冒气泡现象 |
| 酸性 | 加入VmL稀硫酸无明显现象 | 煮沸3min后,有气泡冒出 |
 的氧化能力最强。
的氧化能力最强。②若用
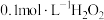 溶液滴定碱性氧化反应后的溶液(先将溶液调至酸性再滴定),滴定终点时的现象为
溶液滴定碱性氧化反应后的溶液(先将溶液调至酸性再滴定),滴定终点时的现象为 溶液的体积为
溶液的体积为 。则碱性氧化后的溶液中
。则碱性氧化后的溶液中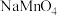 的质量为
的质量为 的代数式表示,
的代数式表示,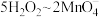 )
)
您最近一年使用:0次
解题方法
2 . 某同学研究铜与稀硝酸的反应,实验如下(夹持装置已略去,气密性良好)。
(1)HNO3中的氮元素为+5价,是氮元素的最高价态,HNO3具有_______ (填“氧化”或“还原”)性。
(2)步骤III中分液漏斗内的红棕色气体是_______ 。
(3)补全铜与稀硝酸反应的化学方程式:_______ 。_______ (写出一条即可)。
| 步骤I | 步骤II | 步骤III |
|
|
|
| 如图组装仪器并加入药品,分液漏斗旋塞关闭,U型管左侧无气体 | 将铜丝下移,一段时间后,U型管左侧产生无色气体,溶液逐渐变蓝,当液面低于铜丝时,反应逐渐停止 | 将铜丝上移,打开分液漏斗旋塞,U型管内气体进入分液漏斗立即变为红棕色,待气体全部进入分液漏斗后关闭旋塞 |
(2)步骤III中分液漏斗内的红棕色气体是
(3)补全铜与稀硝酸反应的化学方程式:
3Cu+8HNO3(稀)=3Cu(NO3)2+ _______↑+4H2O
_______↑+4H2O
您最近一年使用:0次
3 . 某化学小组进行 热稳定性实验,并检验部分分解产物,装置如图所示。
热稳定性实验,并检验部分分解产物,装置如图所示。

回答下列问题:
(1)仪器B的名称是________________ 。
(2)连接装置后,首先应检查装置的________________ 。
(3)加热后,当C中出现________________ 的现象时,证明有 生成。
生成。
(4)持续加热较长时间后,经检验,试管A中残留固体是 ,则
,则 受热分解的化学方程式为
受热分解的化学方程式为________________________________ 。由此可得,热稳定性:
________  (填“>”或“<”) 。
(填“>”或“<”) 。
 热稳定性实验,并检验部分分解产物,装置如图所示。
热稳定性实验,并检验部分分解产物,装置如图所示。
回答下列问题:
(1)仪器B的名称是
(2)连接装置后,首先应检查装置的
(3)加热后,当C中出现
 生成。
生成。(4)持续加热较长时间后,经检验,试管A中残留固体是
 ,则
,则 受热分解的化学方程式为
受热分解的化学方程式为
 (填“>”或“<”) 。
(填“>”或“<”) 。
您最近一年使用:0次
名校
解题方法
4 . 实验小组利用传感器探究Na2CO3和NaHCO3的性质。
【查阅资料】pH越小,c(OH-)越小,溶液碱性越弱
【实验过程】
【分析与解释】
(1)实验I中,溶解时吸收热量的物质是_______ 。
(2)实验II中,Na2CO3溶液和澄清石灰水反应的离子方程式为_______ ,OH-未参与该反应的实验证据是_______ 。
(3)实验II中,滴加NaHCO3溶液的pH变化与滴加Na2CO3溶液的有明显差异,造成这种差异是由于滴加NaHCO3溶液的烧杯中有_______ (填写离子符号)参与反应。
【查阅资料】pH越小,c(OH-)越小,溶液碱性越弱
【实验过程】
| 编号 | 实验操作 | 实验数据 |
| 实验I | 测量下述实验过程的温度变化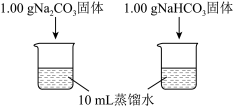 | 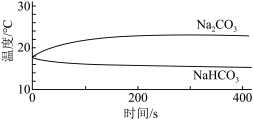 |
| 实验II | 测量下述实验过程的pH变化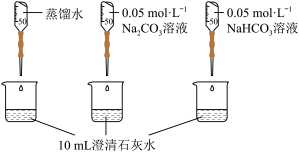 |  |
(1)实验I中,溶解时吸收热量的物质是
(2)实验II中,Na2CO3溶液和澄清石灰水反应的离子方程式为
(3)实验II中,滴加NaHCO3溶液的pH变化与滴加Na2CO3溶液的有明显差异,造成这种差异是由于滴加NaHCO3溶液的烧杯中有
您最近一年使用:0次
2022-11-30更新
|
293次组卷
|
13卷引用:北京市2020年普通高中学业水平合格性模拟考试化学试题
北京市2020年普通高中学业水平合格性模拟考试化学试题2020年北京市第一次普通高中学业水平合格性考试化学试题高一必修第一册(苏教2019)专题3 第二单元 金属钠及钠的化合物4北京市回民学校2020-2021学年高一上学期期中考试化学试题北京市第三十一中学2020—2021学年度高一下学期期中考试化学试题北京第七中学2020-2021学年高一下学期期中考试化学试题天津市红桥区2020-2021学年高一下学期期末考试化学试题(已下线)北京市第四中学2022-2023学年高一上学期期中考试化学试题北京市第四十三中学2022-2023学年高一上学期期中考试化学试题北京市第八中学2022-2023学年高一下学期期末考试化学试题(已下线)专题八 钠及其化合物北京市第十一中学2023-2024学年高一上学期期中考试化学试题北京市月坛中学2023-2024学年高一上学期期中考试化学试题
名校
解题方法
5 . 请选择适当的化学试剂和实验用品,用下图所示的装置(C中盛放的是过氧化钠)进行实验,证明过氧化钠可在呼吸面具和潜水艇中做供氧剂。
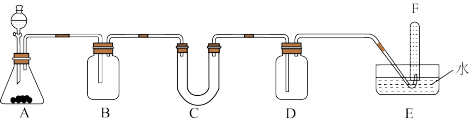
(1)A是实验室中制取 的装置。写出A中发生反应的离子方程式
的装置。写出A中发生反应的离子方程式_______ 。
(2)填写下表中的空白
(3)写出C中发生反应的化学方程式:_______ 。
(4)F中收集到的气体是_______ 。(填化学式)

(1)A是实验室中制取
 的装置。写出A中发生反应的离子方程式
的装置。写出A中发生反应的离子方程式(2)填写下表中的空白
| 装置序号 | 加入的试剂 | 加入该试剂的目的 |
| B | 饱和 溶液 溶液 | ① |
| D | ② | ③ |
(4)F中收集到的气体是
您最近一年使用:0次
2021-12-21更新
|
198次组卷
|
2卷引用:天津市河东区普通高中2022年高二学业水平合格考试模拟化学试题
名校
解题方法
6 . 某同学利用下图所示装置探究SO2的性质。

请回答下列问题:
(1)若X为品红溶液,则可观察到装置①中溶液褪色,说明SO2具有___________ 性;装置②中发生反应的离子方程式是___________ 。
(2)若X为紫色石蕊溶液,则可观察到装置①中溶液变红,说明SO2的水溶液显___________ (填字母代号)。
a.酸性 b.碱性
若X为___________ (填字母代号)溶液,则可观察到装置①中无明显现象。打开活塞a,通入氧气,有白色沉淀生成,说明SO2最终被氧化为SO ,可说明SO2具有
,可说明SO2具有___________ 性。
a.氯化钠 b氯化钡

请回答下列问题:
(1)若X为品红溶液,则可观察到装置①中溶液褪色,说明SO2具有
(2)若X为紫色石蕊溶液,则可观察到装置①中溶液变红,说明SO2的水溶液显
a.酸性 b.碱性
若X为
 ,可说明SO2具有
,可说明SO2具有a.氯化钠 b氯化钡
您最近一年使用:0次
名校
解题方法
7 . 用如图所示装置进行实验,证明过氧化钠(Na2O2)可在呼吸面具和潜水艇中做供氧剂。
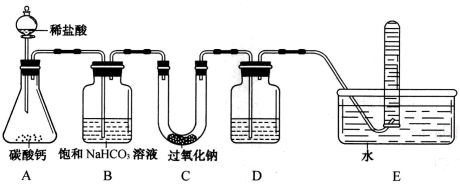
请回答:
(1)装置A中盛放稀盐酸的仪器名称是___ 。
(2)装置B的作用是__ 。
(3)装置C中过氧化钠与二氧化碳反应的化学方程式是__ 。
(4)装置D中盛放的试剂是__ 。
(5)当装置内气流平稳后开始用试管收集气体,该气体能__ ,证明过氧化钠可做供氧剂。

请回答:
(1)装置A中盛放稀盐酸的仪器名称是
(2)装置B的作用是
(3)装置C中过氧化钠与二氧化碳反应的化学方程式是
(4)装置D中盛放的试剂是
(5)当装置内气流平稳后开始用试管收集气体,该气体能
您最近一年使用:0次
2021-08-07更新
|
892次组卷
|
4卷引用:2021年7月浙江省普通高中学业水平考试化学试题
8 . 应用分类的方法可以发现物质及其变化的规律,预测物质的性质及可能发生的变化。某小同学通过实验探究Na2CO3和NaHCO3的性质,请你与他们一起完成实验探究过程,并回答问题。
[观察]
(1)Na2CO3和 NaHCO3均为_______ 色的固体,
(2)从物质的类别来看, Na2CO3和NaHCO3均属于化合物中的_______ 类,能溶于水,可与部分_______ 、_______ 、盐等类别的物质发生反应。
[实验过程]
(3)实验II试管B中的现象为_______ 。
[分析与解释]
(4)实验I所得实验数据证明,溶解时吸收热量的物质是_______ 。
(5)实验II中的现象证明,Na2CO3的热稳定性_______ (填“强”或“弱”)于NaHCO3
(6)实验III中的现象证明,Na2CO3盐酸反应是分步进行的,发生反应的离子方程式为:
第一步:CO + H+=HCO
+ H+=HCO ;第二步:
;第二步:_______ 。
[观察]
(1)Na2CO3和 NaHCO3均为
(2)从物质的类别来看, Na2CO3和NaHCO3均属于化合物中的
[实验过程]
| 编号 | 实验内容 | 实验数据或者现象 |
| 实验I | 利用传感器探究两种物质分别溶水时的温度变化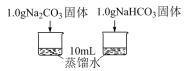 |  |
| 实验II | 探究两种物质得到热稳定性 | 一段时间后,A中无明显现象,B中… |
| 实验III | 探究两种物质分别与盐酸反应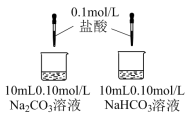 | A中开始无大量气泡,一段时间后产生大量气泡;B中立即产生大量气泡。 |
[分析与解释]
(4)实验I所得实验数据证明,溶解时吸收热量的物质是
(5)实验II中的现象证明,Na2CO3的热稳定性
(6)实验III中的现象证明,Na2CO3盐酸反应是分步进行的,发生反应的离子方程式为:
第一步:CO
 + H+=HCO
+ H+=HCO ;第二步:
;第二步:
您最近一年使用:0次
2021-07-11更新
|
639次组卷
|
5卷引用:云南省2020-2021学年高一下学期普通高中学业水平考试化学试题
9 . 草酸亚铁晶体受热分解的方程式为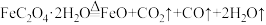 ,下列说法
,下列说法不正确 的是
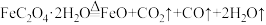 ,下列说法
,下列说法| A.将生成的气体通入澄清石灰水中,可能得到无色溶液 |
| B.将生成的气体通过足量的NaOH溶液和灼热的CuO固体,可检验生成的CO |
| C.分解产物应先检验CO2和CO,再检验H2O |
| D.通过测量反应前后固体的质量,可推出FeC2O4受热是否完全分解 |
您最近一年使用:0次
2021-06-29更新
|
329次组卷
|
3卷引用:2022年1月浙江省普通高中学业水平考试化学仿真模拟试卷B
10 . 某小组同学为验证NaHCO3受热分解的产物,设计如图实验(部分夹持装置已略去,气密性已检验)。

(1)实验Ⅰ中,澄清石灰水变浑浊,说明NaHCO3受热分解的产物中含有___ 。
(2)实验Ⅰ中,加热试管a至不再产生气体,观察到内壁有无色液滴生成,有白色固体剩余。为验证剩余白色固体的成分,小组同学设计并完成了实验Ⅱ,观察到有大量无色气体生成,证明白色固体为Na2CO3。试剂X是___ 。
(3)NaHCO3受热分解的化学方程式为__ 。
(4)依据上述实验,除去Na2CO3固体中的少量NaHCO3,可采用的方法是__ 。

(1)实验Ⅰ中,澄清石灰水变浑浊,说明NaHCO3受热分解的产物中含有
(2)实验Ⅰ中,加热试管a至不再产生气体,观察到内壁有无色液滴生成,有白色固体剩余。为验证剩余白色固体的成分,小组同学设计并完成了实验Ⅱ,观察到有大量无色气体生成,证明白色固体为Na2CO3。试剂X是
(3)NaHCO3受热分解的化学方程式为
(4)依据上述实验,除去Na2CO3固体中的少量NaHCO3,可采用的方法是
您最近一年使用:0次
2021-06-28更新
|
770次组卷
|
6卷引用:北京市2021年第一次普通高中合格性考试化学试题
北京市2021年第一次普通高中合格性考试化学试题(已下线)专题2.1.2 碳酸钠和碳酸氢钠(备作业)-【上好课】2021-2022学年高一化学同步备课系列(人教版2019必修第一册)(已下线)必考点07 钠盐及焰色试验-【对点变式题】2021-2022学年高一化学上学期期中期末必考题精准练(人教版2019)北京教育学院附属中学2022-2023学年高一上学期期中练习化学试题北京市第四十三中学2022-2023学年高一上学期期中考试化学试题北京市第三十一中学2023-2024学年高一上学期期中考试化学试题