名校
解题方法
1 . 某小组同学欲研究SO2及Na2S2O3的性质。
(1)将相关的含硫物质分为如下表所示3组,第2组中物质X的化学式是_______ 。
(2)利用下图所示的装置研究SO2的性质:(熔点:SO2-76.1℃,SO316.8℃;沸点:SO2-10℃,SO345℃)

①装置I模拟工业生产中SO2催化氧化的反应,其化学方程式是_______ 。
②甲同学按I、II、III、IV的顺序连接装置,装置II的作用是_______ ;装置III中溶液逐渐褪色,生成Mn2+,则该反应的离子方程式是_______ 。
③乙同学按I、II、IV的顺序连接装置,若装置IV中有40mL2.5mol•L-1NaOH溶液,反应后增重4.8g,则装置IV中发生总反应的化学方程式_______ 。
(3)已知Na2S2O3溶液与Cl2反应时,1molNa2S2O3转移8mol电子。该反应的离子方程式是_______ 。甲同学设计如下实验流程探究Na2S2O3的化学性质。
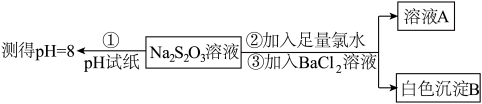
(Ⅰ)甲同学设计实验流程的目的是证明Na2S2O3溶液具有碱性和_______ 性。
(Ⅱ)加入BaCl2溶液生成白色沉淀B的离子方程式是_______ 。
(Ⅲ)乙同学认为应将上述流程中②③所加试剂顺序颠倒,你认为甲、乙两同学的设计更合理的是_______ (填“甲”或“乙”),理由是_______ 。
(1)将相关的含硫物质分为如下表所示3组,第2组中物质X的化学式是
| 第1组 | 第2组 | 第3组 |
| S(单质) | SO2、X、Na2SO3、NaHSO3 | SO3、H2SO4、Na2SO4、NaHSO4 |

①装置I模拟工业生产中SO2催化氧化的反应,其化学方程式是
②甲同学按I、II、III、IV的顺序连接装置,装置II的作用是
③乙同学按I、II、IV的顺序连接装置,若装置IV中有40mL2.5mol•L-1NaOH溶液,反应后增重4.8g,则装置IV中发生总反应的化学方程式
(3)已知Na2S2O3溶液与Cl2反应时,1molNa2S2O3转移8mol电子。该反应的离子方程式是

(Ⅰ)甲同学设计实验流程的目的是证明Na2S2O3溶液具有碱性和
(Ⅱ)加入BaCl2溶液生成白色沉淀B的离子方程式是
(Ⅲ)乙同学认为应将上述流程中②③所加试剂顺序颠倒,你认为甲、乙两同学的设计更合理的是
您最近一年使用:0次
2023-03-18更新
|
1089次组卷
|
3卷引用:第五章 化工生产中的重要非金属元素 单元测试
2 . 某小组设计实验探究 是否能与
是否能与 形成络离子。查阅资料:向难溶电解质中加入具有不同离子的可溶性强电解质溶液,会使难溶电解质溶解度增大,这种现象叫做“盐效应”。实验表明:“盐效应”与离子浓度、离子所带电量有关。分别取等量的纯
形成络离子。查阅资料:向难溶电解质中加入具有不同离子的可溶性强电解质溶液,会使难溶电解质溶解度增大,这种现象叫做“盐效应”。实验表明:“盐效应”与离子浓度、离子所带电量有关。分别取等量的纯 进行实验,实验结果如图所示:
进行实验,实验结果如图所示:
 是否能与
是否能与 形成络离子。查阅资料:向难溶电解质中加入具有不同离子的可溶性强电解质溶液,会使难溶电解质溶解度增大,这种现象叫做“盐效应”。实验表明:“盐效应”与离子浓度、离子所带电量有关。分别取等量的纯
形成络离子。查阅资料:向难溶电解质中加入具有不同离子的可溶性强电解质溶液,会使难溶电解质溶解度增大,这种现象叫做“盐效应”。实验表明:“盐效应”与离子浓度、离子所带电量有关。分别取等量的纯 进行实验,实验结果如图所示:
进行实验,实验结果如图所示: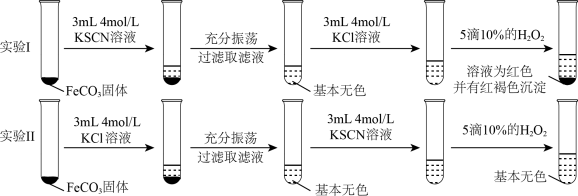
A.实验Ⅱ中,KCl溶液能促进 溶解 溶解 | B.相同浓度下,KSCN溶液盐效应大于KCl溶液 |
| C.滤液中+2价铁离子总浓度:实验Ⅰ=实验Ⅱ | D.实验表明, 和 和 不能形成络离子 不能形成络离子 |
您最近一年使用:0次
2023-01-03更新
|
920次组卷
|
5卷引用:章末检测卷(三) 物质的性质与转化
章末检测卷(三) 物质的性质与转化湖南省长沙市长郡中学2022-2023学年高三上学期月考(四)化学试题山东省沂水县第一中学2022-2023学年高一上学期期末考试化学试题(已下线)专题11 化学实验基础(练)-2023年高考化学二轮复习讲练测(新高考专用)湖南省醴陵市第一中学2023届高三第六次月考化学试题
3 . 久置的 固体会潮解、变质、颜色变黄,某小组欲探究
固体会潮解、变质、颜色变黄,某小组欲探究 变质的产物。
变质的产物。
资料:i. 能与S反应生成
能与S反应生成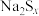 (黄色),
(黄色),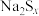 与酸反应生成S和
与酸反应生成S和 ;
;
ii.BaS、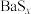 均易溶于水,
均易溶于水, 可溶于水,
可溶于水, (白色)微溶于水;
(白色)微溶于水;
iii.白色的 难溶于水,且易转化为黑色的
难溶于水,且易转化为黑色的 。
。
将久置的 固体溶于水,溶液呈黄色。取黄色溶液,滴加稀硫酸,产生白色沉淀(经检验该沉淀中含S)。
固体溶于水,溶液呈黄色。取黄色溶液,滴加稀硫酸,产生白色沉淀(经检验该沉淀中含S)。
(1)推测 变质的产物含有
变质的产物含有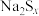 ,实验证据是
,实验证据是_______ 。
(2)研究白色沉淀产生的途径,实验小组同学进行如下假设:
途径一:白色沉淀由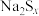 与稀硫酸反应产生。
与稀硫酸反应产生。
途径二: 变质的产物中可能含有
变质的产物中可能含有 ,白色沉淀由
,白色沉淀由 与稀硫酸反应产生。
与稀硫酸反应产生。
途径三: 变质的产物中可能含有
变质的产物中可能含有 ,白色沉淀由……
,白色沉淀由……
① 与稀硫酸反应的化学方程式是
与稀硫酸反应的化学方程式是_______ 。
②请将途径三补充完全:白色沉淀由_______ 。
(3)为检验 变质的产物中是否含有
变质的产物中是否含有 ,设计实验:
,设计实验:
①取黄色溶液,向其中滴加 溶液,产生黑色沉淀。由此得出结论:
溶液,产生黑色沉淀。由此得出结论: 变质的产物中含
变质的产物中含 。有同学认为得出该结论的理由不充分,原因是
。有同学认为得出该结论的理由不充分,原因是_______ 。
②改进实验,方案和现象如下:
实验一: 和
和 混合溶液
混合溶液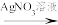 白色沉淀(放置颜色不变)
白色沉淀(放置颜色不变)
实验二:
a.实验一的目的是_______ 。
b.试剂1是_______ ,试剂2是_______ 。
(4)检验 变质的产物中是否含有
变质的产物中是否含有 :取黄色溶液,加入过量稀盐酸,产生白色沉淀。离心沉降(分离固体)后向溶液中滴加
:取黄色溶液,加入过量稀盐酸,产生白色沉淀。离心沉降(分离固体)后向溶液中滴加 溶液,产生白色沉淀。你认为能否根据实验现象得出结论?
溶液,产生白色沉淀。你认为能否根据实验现象得出结论?_______ 。说明理由:_______ 。
 固体会潮解、变质、颜色变黄,某小组欲探究
固体会潮解、变质、颜色变黄,某小组欲探究 变质的产物。
变质的产物。资料:i.
 能与S反应生成
能与S反应生成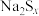 (黄色),
(黄色),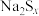 与酸反应生成S和
与酸反应生成S和 ;
;ii.BaS、
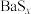 均易溶于水,
均易溶于水, 可溶于水,
可溶于水, (白色)微溶于水;
(白色)微溶于水;iii.白色的
 难溶于水,且易转化为黑色的
难溶于水,且易转化为黑色的 。
。将久置的
 固体溶于水,溶液呈黄色。取黄色溶液,滴加稀硫酸,产生白色沉淀(经检验该沉淀中含S)。
固体溶于水,溶液呈黄色。取黄色溶液,滴加稀硫酸,产生白色沉淀(经检验该沉淀中含S)。(1)推测
 变质的产物含有
变质的产物含有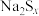 ,实验证据是
,实验证据是(2)研究白色沉淀产生的途径,实验小组同学进行如下假设:
途径一:白色沉淀由
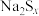 与稀硫酸反应产生。
与稀硫酸反应产生。途径二:
 变质的产物中可能含有
变质的产物中可能含有 ,白色沉淀由
,白色沉淀由 与稀硫酸反应产生。
与稀硫酸反应产生。途径三:
 变质的产物中可能含有
变质的产物中可能含有 ,白色沉淀由……
,白色沉淀由……①
 与稀硫酸反应的化学方程式是
与稀硫酸反应的化学方程式是②请将途径三补充完全:白色沉淀由
(3)为检验
 变质的产物中是否含有
变质的产物中是否含有 ,设计实验:
,设计实验:①取黄色溶液,向其中滴加
 溶液,产生黑色沉淀。由此得出结论:
溶液,产生黑色沉淀。由此得出结论: 变质的产物中含
变质的产物中含 。有同学认为得出该结论的理由不充分,原因是
。有同学认为得出该结论的理由不充分,原因是②改进实验,方案和现象如下:
实验一:
 和
和 混合溶液
混合溶液 白色沉淀(放置颜色不变)
白色沉淀(放置颜色不变)实验二:

a.实验一的目的是
b.试剂1是
(4)检验
 变质的产物中是否含有
变质的产物中是否含有 :取黄色溶液,加入过量稀盐酸,产生白色沉淀。离心沉降(分离固体)后向溶液中滴加
:取黄色溶液,加入过量稀盐酸,产生白色沉淀。离心沉降(分离固体)后向溶液中滴加 溶液,产生白色沉淀。你认为能否根据实验现象得出结论?
溶液,产生白色沉淀。你认为能否根据实验现象得出结论?
您最近一年使用:0次
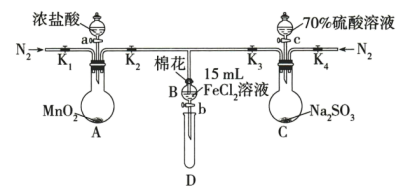
4 . 为验证氧化性 ,某小组用如图所示装置进行实验(夹持仪器和A中加热装置已省略,气密性已检验)。
,某小组用如图所示装置进行实验(夹持仪器和A中加热装置已省略,气密性已检验)。
实验过程:
Ⅰ.打开止水夹K1~K4,通入一段时间N2,再将T型导管插入B中,继续通入N2,然后关闭K1,K3,K4。
Ⅱ.打开活塞a,滴加一定量的浓盐酸,给A加热。
Ⅲ.当B中溶液变黄时,停止加热,关闭K2。
Ⅳ.打开活塞b,使约2mL的溶液流入D试管中,检验其中的离子。
Ⅴ.打开K3和活塞c,加入70%的硫酸溶液,一段时间后关闭K3。
Ⅵ.更换试管D,重复过程Ⅳ,检验B中溶液的离子。
(1)过程Ⅰ的目的是_______ 。
(2)若向过程ⅢB中的黄色溶液中通入H2S气体,会观察到有淡黄色沉淀生成,写出该反应的化学方程式:_______ 。
(3)若将制取的SO2通入硫酸酸化的高锰酸钾溶液可使溶液褪色,其反应的离子方程式为_______ 。
(4)甲、乙、丙三位同学分别完成了上述实验,结论如下表所示。他们的检测结果一定能够证明氧化性 的是
的是_______ (填“甲”“乙”或“丙”)。
(5)将B中的FeCl2溶液换成100mLFeBr2溶液并向其中通入22.4LCl2(标准状况下),若溶液中有1/2的Br-被氧化成单质Br2,则原FeBr2溶液中FeBr2的物质的量浓度为_______ 。
 ,某小组用如图所示装置进行实验(夹持仪器和A中加热装置已省略,气密性已检验)。
,某小组用如图所示装置进行实验(夹持仪器和A中加热装置已省略,气密性已检验)。
实验过程:
Ⅰ.打开止水夹K1~K4,通入一段时间N2,再将T型导管插入B中,继续通入N2,然后关闭K1,K3,K4。
Ⅱ.打开活塞a,滴加一定量的浓盐酸,给A加热。
Ⅲ.当B中溶液变黄时,停止加热,关闭K2。
Ⅳ.打开活塞b,使约2mL的溶液流入D试管中,检验其中的离子。
Ⅴ.打开K3和活塞c,加入70%的硫酸溶液,一段时间后关闭K3。
Ⅵ.更换试管D,重复过程Ⅳ,检验B中溶液的离子。
(1)过程Ⅰ的目的是
(2)若向过程ⅢB中的黄色溶液中通入H2S气体,会观察到有淡黄色沉淀生成,写出该反应的化学方程式:
(3)若将制取的SO2通入硫酸酸化的高锰酸钾溶液可使溶液褪色,其反应的离子方程式为
(4)甲、乙、丙三位同学分别完成了上述实验,结论如下表所示。他们的检测结果一定能够证明氧化性
 的是
的是| 过程为Ⅳ,B溶液中含有的离子 | 过程Ⅵ,B溶液中含有的离子 | |
| 甲 | 有Fe3+无Fe2+ | 有Fe2+ |
| 乙 | 既有Fe3+又有Fe2+ | 有 |
| 丙 | 有Fe3+无Fe2+ | 有 |
您最近一年使用:0次
21-22高一上·黑龙江哈尔滨·期末
名校
解题方法
5 . Ⅰ.某同学为探究元素周期表中元素性质的递变规律,设计了如下系列实验。
(1)将将Na、K、Mg、Al各1mol分别投入到足量的同浓度的盐酸中,试预测实验结果:_______ 与盐酸反应最剧烈,_______ 与盐酸反应产生的气体最多(填元素符号)。
(2)向 溶液中通入氯气出现黄色浑浊,可证明Cl的非金属性比S强,反应的离子方程式为:
溶液中通入氯气出现黄色浑浊,可证明Cl的非金属性比S强,反应的离子方程式为:_______ 。
Ⅱ.利用如图装置可验证同主族元素非金属性的变化规律
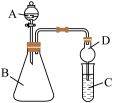
(3)仪器A的名称为_______ 。
(4)实验室中现有药品:①酸稀盐酸;②酸稀硝酸;③ 液溶液;④
液溶液;④ 固体,请选择证合适药品设计实验验证N、C、Si的非金属性的变化规律;装置A、B中所装药品分别为
固体,请选择证合适药品设计实验验证N、C、Si的非金属性的变化规律;装置A、B中所装药品分别为_______ 、_______ (填序号)。但有同学认为该装置有缺陷,如何改进?_______ 。
Ⅲ.完成下列问题
(5)铝是为数不多的能与强碱溶液反应的金属,请书写铝与氢氧化钠溶液反应的化学方程式_______ 。
(6)消除采矿业胶液中的氰化物(如KCN,C为+2价),经以下反应实现: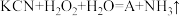 (已配平)。试指出A的化学式
(已配平)。试指出A的化学式_______ ,如此反应中有6.72L(标准状况)气体生成,转移电子数目为_______ 。
(1)将将Na、K、Mg、Al各1mol分别投入到足量的同浓度的盐酸中,试预测实验结果:
(2)向
 溶液中通入氯气出现黄色浑浊,可证明Cl的非金属性比S强,反应的离子方程式为:
溶液中通入氯气出现黄色浑浊,可证明Cl的非金属性比S强,反应的离子方程式为:Ⅱ.利用如图装置可验证同主族元素非金属性的变化规律

(3)仪器A的名称为
(4)实验室中现有药品:①酸稀盐酸;②酸稀硝酸;③
 液溶液;④
液溶液;④ 固体,请选择证合适药品设计实验验证N、C、Si的非金属性的变化规律;装置A、B中所装药品分别为
固体,请选择证合适药品设计实验验证N、C、Si的非金属性的变化规律;装置A、B中所装药品分别为Ⅲ.完成下列问题
(5)铝是为数不多的能与强碱溶液反应的金属,请书写铝与氢氧化钠溶液反应的化学方程式
(6)消除采矿业胶液中的氰化物(如KCN,C为+2价),经以下反应实现:
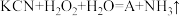 (已配平)。试指出A的化学式
(已配平)。试指出A的化学式
您最近一年使用:0次
6 . 乙醇是生活中常见的有机物。下列有关乙醇的实验操作或现象错误的是( )


A.①中酸性 溶液会褪色,乙醇转化为乙醛 溶液会褪色,乙醇转化为乙醛 |
| B.②中钠会先沉在试管底部,表面有气泡产生,上方的火焰呈淡蓝色 |
| C.③中灼热的铜丝插入乙醇中,铜丝由黑色变为红色 |
| D.要制得无水乙醇应加入生石灰蒸馏 |
您最近一年使用:0次
2022-07-07更新
|
2001次组卷
|
5卷引用:第七章 有机化合物(B卷·能力提升练)-【单元测试】2022-2023学年高一化学分层训练AB卷(人教版2019必修第二册)
7 . 有关Na2O2性质实验如下:
②酚酞褪色原因与溶液的强碱性或强氧化性有关。
根据上述实验可以得出的结论是
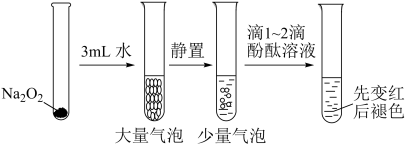
②酚酞褪色原因与溶液的强碱性或强氧化性有关。
根据上述实验可以得出的结论是
| A.双氧水能使酚酞褪色 |
| B.浓氢氧化钠能使酚酞褪色 |
| C.双氧水和浓氢氧化钠都能使酚酞褪色 |
| D.可利用二氧化锰和水来完善实验方案 |
您最近一年使用:0次
2022-06-14更新
|
2174次组卷
|
10卷引用:第二章《海水中的重要元素----钠和氯》能力提升单元检测-【帮课堂】2022-2023学年高一化学同步精品讲义(人教版2019必修第一册)
(已下线)第二章《海水中的重要元素----钠和氯》能力提升单元检测-【帮课堂】2022-2023学年高一化学同步精品讲义(人教版2019必修第一册)上海市浦东新区2021-2022学年高三下学期教学质量检测化学试题上海市川沙中学2021-2022学年高一下学期期末考试化学试题上海市育才中学2022-2023学年高三上学期10月月考化学试题(已下线)易错点05 钠及其化合物-备战2023年高考化学考试易错题内蒙古乌兰浩特第一中学2022-2023学年高一上学期第三次月考化学试题上海市建平中学2022-2023学年高一下学期期中考试化学试题湖北省十堰市郧阳中学2022-2023学年高一上学期10月月考化学试题河北省石家庄市第二十四中学2023-2024学年高一上学期期中考试化学试题江苏省盐城市亭湖高级中学2023-2024学年高一上学期期末考试化学试题
8 . 用如图所示装置进行Fe与水蒸气反应的实验,下列有关说法正确的是

| A.实验时,先点燃酒精喷灯再点燃酒精灯 |
| B.反应中H2O作氧化剂,发生反应的化学方程式为2Fe+3H2O=Fe2O3+3H2 |
| C.干燥管中加入的固体干燥剂可以是无水氯化钙 |
| D.收集反应产生的气体选用装置② |
您最近一年使用:0次
2022-07-18更新
|
1130次组卷
|
13卷引用:第三章 铁 金属材料(B卷·能力提升练)-【单元测试】2022-2023学年高一化学分层训练AB卷(人教版2019必修第一册)
(已下线)第三章 铁 金属材料(B卷·能力提升练)-【单元测试】2022-2023学年高一化学分层训练AB卷(人教版2019必修第一册)湖北省十堰市2020-2021学年高一上学期期末考试化学试题吉林省磐石一中、伊通一中、梅河口五中、四平一中等2020-2021学年高一上学期期末考试化学试题安徽省皖西南联盟2020-2021学年高一上学期期末考试化学试题江西省抚州市2020-2021学年高一上学期学生学业发展水平测试(期末考试) 化学(B卷) 试题(已下线)新人教必修1第3章第一节第1课时铁的单质(课后)(已下线)《新教材变化解读及考法剖析 》(人教版2019必修第一册)第三章河北省衡水市第十四中学2020-2021学年高一下学期摸底考试化学试题黑龙江省哈尔滨师范大学附属中学2021-2022学年高一下学期期末考试化学试题福建省龙岩第一中学2022-2023学年高一上学期第二次月考化学试题(已下线)考点巩固卷03 金属及其化合物(4大考点48题)-2024年高考化学一轮复习考点通关卷(新高考通用)吉林省吉林市第一中学2023-2024学年高一上学期11月期中化学试题(已下线)课时1 铁的单质
9 . 某校化学实验小组为了证明铜与稀硝酸反应产生一氧化氮,用如图所示装置进行实验(加热装置和夹持装置均已略去,装置气密性良好,F是用于鼓入空气的双连打气球)。
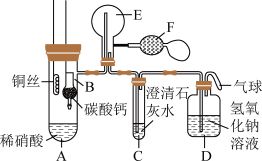
实验操作及现象:
试回答下列问题:
(1)操作I中产生气体的化学式为_______ 。操作I的目的是_______ 。D装置的作用是_______ 。
(2)C装置中白色沉淀的化学式是_______ 。操作II中当C装置中产生白色沉淀时立刻将B装置上提的原因是_______ 。
(3)操作III中A装置中产生无色气体的化学方程式是_______ 。
(4)E装置内气体颜色逐渐加深的原因是_______ 。
(5)操作V现象产生的原因是(用两个化学方程式说明)_______ ,_______ 。

实验操作及现象:
| 实验操作 | 现象 |
| I.将B装置下移,使碳酸钙与稀硝酸接触 | 产生气体 |
| II.当C装置中产生白色沉淀时,立刻将B装置上提 | |
| III.将A装置中铜丝放入稀硝酸中,给A装置微微加热 | A装置中产生无色气体,E装置中开始时出现浅红棕色气体 |
| IV.用F装置向E装置中鼓入空气 | E装置中气体颜色逐渐加深 |
| V.一段时间后 | C装置中白色沉淀溶解 |
(1)操作I中产生气体的化学式为
(2)C装置中白色沉淀的化学式是
(3)操作III中A装置中产生无色气体的化学方程式是
(4)E装置内气体颜色逐渐加深的原因是
(5)操作V现象产生的原因是(用两个化学方程式说明)
您最近一年使用:0次
2021-09-29更新
|
1698次组卷
|
14卷引用:第五章 化工生产中的重要非金属元素(B卷·能力提升练)-【单元测试】2022-2023学年高一化学分层训练AB卷(人教版2019必修第二册)
第五章 化工生产中的重要非金属元素(B卷·能力提升练)-【单元测试】2022-2023学年高一化学分层训练AB卷(人教版2019必修第二册)(已下线)第五章 化工生产中的重要非金属元素【单元测试B卷】广东省广州市仲元中学2020-2021学年高一下学期期中考试化学试题(已下线)章末培优 第5章 化工生产中的重要非金属元素-2021-2022学年高一化学课后培优练(人教版2019必修第二册)广东省揭阳市普宁市华侨中学2021—2022学年高一下学期第一次月考化学科试题安徽省宣城市七校2021-2022学年高一下学期期中联考化学试卷广东省揭阳市惠来县第一中学2021-2022学年高一下学期第一次阶段考试化学试题(已下线)第04练 常见气体的制备与性质实验-2022年【暑假分层作业】高一化学(人教版2019必修第二册)(已下线)第02练 氮及其化合物-2022年【暑假分层作业】高一化学(人教版2019必修第二册)吉林省长春市第二实验中学2022-2023学年高一下学期4月月考化学试题黑龙江省富锦市第一中学2022-2023学年高一下学期第二次考试化学试题(已下线)第02练 氮及其化合物-2023年【暑假分层作业】高一化学(人教版2019必修第二册)广东省兴宁市沐彬中学2021-2022学年高一下学期期中段考化学试题山东省聊城市第二中学2023-2024学年高二上学期开学考试化学试题
10 . 某学习小组在学习了亚铁盐的性质后,欲探究 溶液分别与
溶液分别与 溶液、
溶液、 溶液的反应。已知:
溶液的反应。已知: 和
和 均为白色沉淀,不存在
均为白色沉淀,不存在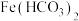 。实验操作及现象记录如下:
。实验操作及现象记录如下:
(1)甲同学认为实验a中白色颗粒状沉淀是 ,写出该反应的离子方程式:
,写出该反应的离子方程式:___________ ;为了证实自己的观点,进行实验:取少量白色颗粒状沉淀,加入___________ ,产生大量气泡。
(2)乙同学推测实验a的白色颗粒状沉淀中还可能含有 ,他将实验a中两种溶液体积均改为15 mL后再进行实验,证实了他的推测。能证明
,他将实验a中两种溶液体积均改为15 mL后再进行实验,证实了他的推测。能证明 存在的实验现象是
存在的实验现象是___________ 。
(3)实验b中白色颗粒状沉淀主要成分也为 ,写出生成
,写出生成 的离子方程式:
的离子方程式:___________ 。
(4)实验b中液面上方试管内壁黏附的白色颗粒状沉淀物变为红褐色,主要原因是潮湿的 被氧气氧化,写出该反应的化学方程式:
被氧气氧化,写出该反应的化学方程式:___________ 。
 溶液分别与
溶液分别与 溶液、
溶液、 溶液的反应。已知:
溶液的反应。已知: 和
和 均为白色沉淀,不存在
均为白色沉淀,不存在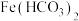 。实验操作及现象记录如下:
。实验操作及现象记录如下:
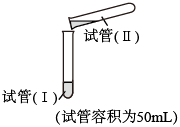
| 试剂 | 操作及现象 | ||
| 实验a | 试管(I) | 试管(II) | |
1.0mol/L 溶液24mL 溶液24mL | 1.0mol/L 溶液24mL 溶液24mL | 倾倒完后,迅速用胶塞塞紧试管(Ⅰ)的试管口,反复上下颠倒摇匀,使反应物充分混合;反应过程中无气泡产生,生成白色絮状沉淀;放置1.5~2h后,白色絮状沉淀转化为白色颗粒沉淀 | |
| 实验b | 1.0mol/L 溶液10mL 溶液10mL | 1.0mol/L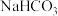 溶液16mL 溶液16mL | 倾倒完后,迅速产生白色颗粒状沉淀和大量气泡。振荡,经2~4min后液面上方试管内壁黏附的白色颗粒状沉淀物变成红褐色 |
 ,写出该反应的离子方程式:
,写出该反应的离子方程式:(2)乙同学推测实验a的白色颗粒状沉淀中还可能含有
 ,他将实验a中两种溶液体积均改为15 mL后再进行实验,证实了他的推测。能证明
,他将实验a中两种溶液体积均改为15 mL后再进行实验,证实了他的推测。能证明 存在的实验现象是
存在的实验现象是(3)实验b中白色颗粒状沉淀主要成分也为
 ,写出生成
,写出生成 的离子方程式:
的离子方程式:(4)实验b中液面上方试管内壁黏附的白色颗粒状沉淀物变为红褐色,主要原因是潮湿的
 被氧气氧化,写出该反应的化学方程式:
被氧气氧化,写出该反应的化学方程式:
您最近一年使用:0次



