2022·北京·高考真题
1 . 某小组同学探究不同条件下氯气与二价锰化合物的反应。
资料:ⅰ、Mn2+在一定条件下被Cl2或ClO-氧化成MnO2(棕黑色)、MnO (绿色)、MnO
(绿色)、MnO (紫色)。
(紫色)。
ⅱ、浓碱条件下,MnO 可被OH-还原为MnO
可被OH-还原为MnO 。
。
ⅲ、Cl2的氧化性与溶液的酸碱性无关,NaClO的氧化性随碱性增强而减弱。
实验装置如图(夹持装置略):
(1)B中试剂是_____ 。
(2)通入Cl2前,实验Ⅱ、Ⅲ中沉淀由白色变为棕黑色的化学方程式为_____ 。
(3)对比实验Ⅰ、Ⅱ通入Cl2后的实验现象,对于二价锰化合物还原性的认识是_____ 。
(4)根据资料ⅱ,实验Ⅲ中应得到绿色溶液,实验中得到紫色溶液,分析现象与资料不符的原因:
原因一:可能是通入Cl2导致溶液的碱性减弱。
原因二:可能是氧化剂过量,氧化剂将MnO 氧化为MnO
氧化为MnO 。
。
①用化学方程式表示可能导致溶液碱性减弱的原因:_____ ,但通过实验测定溶液的碱性变化很小。
②取实验Ⅲ中放置后的1mL悬浊液,加入4mL40%NaOH溶液,溶液紫色迅速变为绿色,且绿色缓慢加深。溶液紫色变为绿色的离子方程式为_____ ,溶液绿色缓慢加深,原因是MnO2被_____ (填化学式)氧化,可证明实验Ⅲ的悬浊液中氧化剂过量。
③取实验Ⅱ中放置后的1mL悬浊液,加入4mL水,溶液紫色缓慢加深,发生反应的离子方程式是_____ 。
④从反应速率的角度,分析实验Ⅲ未得到绿色溶液的可能原因:_____ 。
资料:ⅰ、Mn2+在一定条件下被Cl2或ClO-氧化成MnO2(棕黑色)、MnO
 (绿色)、MnO
(绿色)、MnO (紫色)。
(紫色)。ⅱ、浓碱条件下,MnO
 可被OH-还原为MnO
可被OH-还原为MnO 。
。ⅲ、Cl2的氧化性与溶液的酸碱性无关,NaClO的氧化性随碱性增强而减弱。
实验装置如图(夹持装置略):
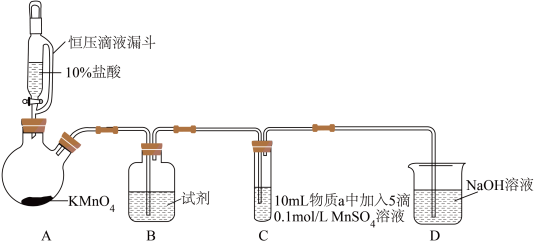
| 实验 | 物质a | C中实验现象 | |
| 通入Cl2前 | 通入Cl2后 | ||
| Ⅰ | 水 | 得到无色溶液 | 产生棕黑色沉淀,且放置后不发生变化 |
| Ⅱ | 5%NaOH溶液 | 产生白色沉淀,在空气中缓慢变成棕黑色沉淀 | 棕黑色沉淀增多,放置后溶液变为紫色,仍有沉淀 |
| Ⅲ | 40%NaOH溶液 | 产生白色沉淀,在空气中缓慢变成棕黑色沉淀 | 棕黑色沉淀增多,放置后溶液变为紫色,仍有沉淀 |
(2)通入Cl2前,实验Ⅱ、Ⅲ中沉淀由白色变为棕黑色的化学方程式为
(3)对比实验Ⅰ、Ⅱ通入Cl2后的实验现象,对于二价锰化合物还原性的认识是
(4)根据资料ⅱ,实验Ⅲ中应得到绿色溶液,实验中得到紫色溶液,分析现象与资料不符的原因:
原因一:可能是通入Cl2导致溶液的碱性减弱。
原因二:可能是氧化剂过量,氧化剂将MnO
 氧化为MnO
氧化为MnO 。
。①用化学方程式表示可能导致溶液碱性减弱的原因:
②取实验Ⅲ中放置后的1mL悬浊液,加入4mL40%NaOH溶液,溶液紫色迅速变为绿色,且绿色缓慢加深。溶液紫色变为绿色的离子方程式为
③取实验Ⅱ中放置后的1mL悬浊液,加入4mL水,溶液紫色缓慢加深,发生反应的离子方程式是
④从反应速率的角度,分析实验Ⅲ未得到绿色溶液的可能原因:
您最近一年使用:0次
2023-11-29更新
|
838次组卷
|
29卷引用:北京一零一中学2023-2024学年高三上学期11月统练五化学试题
北京一零一中学2023-2024学年高三上学期11月统练五化学试题北京市日坛中学2023-2024学年高三上学期10月检测化学试题(已下线)2022年北京市高考真题化学试题(部分试题)2022年北京市高考真题化学试题(已下线)2022年北京高考真题变式题1-14(已下线)2022年北京高考真题化学试题变式题(实验探究题)新疆乌鲁木齐市第101中学2022-2023学年高一上学期12月月考化学试题北京师范大学第二附属中学2023-2024学年高三上学期期中考试化学试题江苏省苏州市工业园区星海实验高级中学2023-2024学年高一上学期12月调研化学试题山东省日照神州天立高级中学高复部2023-2024学年高三上学期12月份阶段性测试化学试题(已下线)考点53 化学实验方案设计与评价-备战2023年高考化学一轮复习考点帮(全国通用)四川省成都市树德中学2022-2023学年高三上学期入学考试理综化学试题(已下线)第28讲 定性、定量实验(讲)-2023年高考化学一轮复习讲练测(新教材新高考)(已下线)易错点09 氯元素及其化合物-备战2023年高考化学考试易错题(已下线)专题三 离子反应-实战高考·二轮复习核心突破突破超重点 高效突破综合实验 实验4 创新探究实验角度1控制变量法探究(已下线)题型46 实验原理探究型综合实验(已下线)专题19 实验综合题(已下线)专题19 实验综合题(已下线)第18练 化学实验综合题 -2023年【暑假分层作业】高二化学(2024届一轮复习通用)(已下线)考点09 氯及其化合物(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)(已下线)第11讲 氯气和卤族元素(已下线)专题15 化学实验综合题-2023年高考化学真题题源解密(新高考专用)(已下线)专题14 化学实验综合题-2023年高考化学真题题源解密(全国通用)(已下线)考点14 氯及其化合物(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)(已下线)考点48 实验方案设计与评价(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)(已下线)考点4 化学实验方案设计与探究 (核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)(已下线)微专题 物质性质综合实验探究
名校
解题方法
2 . 某小组在探究 性质的实验中观察到异常现象。
性质的实验中观察到异常现象。
资料:i. (红色),
(红色), 中S元素的化合价为-2价
中S元素的化合价为-2价
ii. 是不溶于盐酸的白色沉淀
是不溶于盐酸的白色沉淀
(1)实验I体现了 的
的______ 性,补全 与
与 酸性溶液反应的离子方程式:
酸性溶液反应的离子方程式:______ 。
______ ______
______ ______
______ ______
______ ______
______
(2)探究“红色褪去”的原因,进行实验II:将褪色后的溶液分三份分别进行实验。

实验II得出的结论是:红色褪去的原因是______ 。
(3)为进一步探究“红色褪去”的原因,进行了实验III.
分析上述三个实验,下列叙述正确的是______(填字母)。
(4)上述实验探究过程用到的实验方法有______ (写出一条)。
(5)验证 性质的实验还可以选用
性质的实验还可以选用 溶液和酸化的
溶液和酸化的 溶液,二者发生反应的离子方程式是:
溶液,二者发生反应的离子方程式是:______ 。
 性质的实验中观察到异常现象。
性质的实验中观察到异常现象。| 实验I | 现象 |
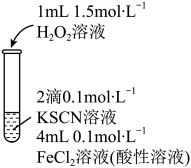 | 溶液变红,片刻红色褪去,有气体生成(经检验为 )。 )。 |
 (红色),
(红色), 中S元素的化合价为-2价
中S元素的化合价为-2价ii.
 是不溶于盐酸的白色沉淀
是不溶于盐酸的白色沉淀(1)实验I体现了
 的
的 与
与 酸性溶液反应的离子方程式:
酸性溶液反应的离子方程式:______
 ______
______ ______
______ ______
______ ______
______
(2)探究“红色褪去”的原因,进行实验II:将褪色后的溶液分三份分别进行实验。

实验II得出的结论是:红色褪去的原因是
(3)为进一步探究“红色褪去”的原因,进行了实验III.
| 实验III | 现象 |
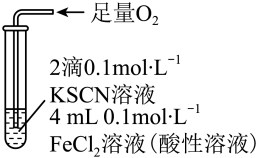 | 溶液变红,一段时间后不褪色。 |
取上述反应后的溶液,滴加盐酸和 溶液 溶液 | 无白色沉淀产生。 |
A.实验III中发生了氧化还原反应: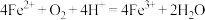 |
B.通过实验III推出实验I中氧化 的只有 的只有 |
C. 在该实验条件下不能使红色溶液褪色 在该实验条件下不能使红色溶液褪色 |
D.实验I中红色褪去与 的氧化性有关 的氧化性有关 |
(5)验证
 性质的实验还可以选用
性质的实验还可以选用 溶液和酸化的
溶液和酸化的 溶液,二者发生反应的离子方程式是:
溶液,二者发生反应的离子方程式是:
您最近一年使用:0次
名校
解题方法
3 . 某小组同学探究FeSO4溶液与NaClO溶液的反应。
实验Ⅰ:向敞口容器中加入一定体积0.1mol·L-1FeSO4溶液,不断搅拌,逐滴加入pH≈13的84消毒液,溶液pH变化曲线如下图所示(从B点开始滴入84消毒液)。

B~C段,开始时产生红褐色沉淀,随后沉淀消失,溶液变为暗红色;
C点之后,逐渐产生大量黄色沉淀,有刺激性气味气体产生,溶液颜色明显变浅。
已知:25℃,饱和NaClO溶液的pH约为11,Fe3+完全沉淀时的pH≈13。
(1)Cl2通入NaOH溶液可得上述84消毒液,该84消毒液中阴离子主要有___________ 。
(2)A~B段,FeSO4溶液在搅拌下pH略有下降,用离子方程式解释原因___________ 。
(3)B~C段,产生红褐色沉淀的离子方程式为___________ 。查阅资料可知,暗红色物质为聚合硫酸铁,是一种无机高分子化合物,其主要阳离子的结构为如下所示,该阳离子中Fe的配位数为___________ 。
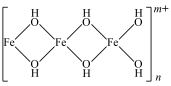
(4)取少量C点溶液,加入___________ (补充试剂和现象),证明溶液中无Fe2+。C点之后产生的黄色沉淀经检验为铁黄(FeOOH),写出暗红色物质转化为黄色沉淀的离子方程式___________ 。
实验Ⅱ:向敞口容器中加入一定体积的pH≈13的84消毒液,不断搅拌,逐滴加入0.1mol·L-1FeSO4溶液,溶液pH变化曲线如下图所示。

E→H段,迅速产生大量红褐色沉淀且逐渐增多,H后开始产生有刺激性气味的气体,最终得到暗红色溶液和大量黄色沉淀。
已知:Cl2、HClO、ClO-在不同pH条件下的百分含量如下图:

(5)G→H段pH骤降的原因是___________ (用离子方程式表示)。
(6)综合以上实验,FeSO4溶液与NaClO溶液的反应产物与___________ 有关。
实验Ⅰ:向敞口容器中加入一定体积0.1mol·L-1FeSO4溶液,不断搅拌,逐滴加入pH≈13的84消毒液,溶液pH变化曲线如下图所示(从B点开始滴入84消毒液)。

B~C段,开始时产生红褐色沉淀,随后沉淀消失,溶液变为暗红色;
C点之后,逐渐产生大量黄色沉淀,有刺激性气味气体产生,溶液颜色明显变浅。
已知:25℃,饱和NaClO溶液的pH约为11,Fe3+完全沉淀时的pH≈13。
(1)Cl2通入NaOH溶液可得上述84消毒液,该84消毒液中阴离子主要有
(2)A~B段,FeSO4溶液在搅拌下pH略有下降,用离子方程式解释原因
(3)B~C段,产生红褐色沉淀的离子方程式为

(4)取少量C点溶液,加入
实验Ⅱ:向敞口容器中加入一定体积的pH≈13的84消毒液,不断搅拌,逐滴加入0.1mol·L-1FeSO4溶液,溶液pH变化曲线如下图所示。

E→H段,迅速产生大量红褐色沉淀且逐渐增多,H后开始产生有刺激性气味的气体,最终得到暗红色溶液和大量黄色沉淀。

已知:Cl2、HClO、ClO-在不同pH条件下的百分含量如下图:

(5)G→H段pH骤降的原因是
(6)综合以上实验,FeSO4溶液与NaClO溶液的反应产物与
您最近一年使用:0次
2023-11-06更新
|
219次组卷
|
3卷引用:北京师范大学附属中学2023-2024学年高三上学期统练七(12月考)化学试题
4 . 兴趣小组在课外实验中意外发现:将镁条放入 溶液中,快速产生较多气泡,有白色沉淀生成,小组同学对此进行了系列探究活动。
溶液中,快速产生较多气泡,有白色沉淀生成,小组同学对此进行了系列探究活动。
探究1:反应产生的气体是什么?
【作出猜想】
(1)小组同学经查阅资料和讨论,根据化学变化过程中元素不变,且反应物中含有___________ 三种元素,作出如下猜想:
①氢气;②二氧化碳;③氢气和二氧化碳。
【实验1】取适量镁条、 溶液于反应装置A中,按如图1所示方案进行实验,B中石灰水不变浑浊;C处气体燃烧,烧杯内壁有水珠。说明猜想①正确。
溶液于反应装置A中,按如图1所示方案进行实验,B中石灰水不变浑浊;C处气体燃烧,烧杯内壁有水珠。说明猜想①正确。
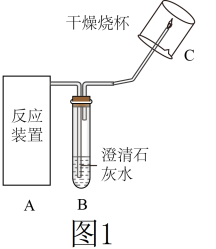
(2)反应装置A应选用图2中的___________ 装置(填写序号)。

(3)小组同学讨论认为,上述实验中“烧杯内壁有水珠”作为“反应产生的气体是氢气”的证据不可靠。为使这一证据可靠,且仍能一次性地验证三个猜想,只需在图1所示方案的基础上加以改进完善。你的改进方案是___________
探究II:快速产生气体的原因是什么?
【查阅资科】镁与水缓慢反应生成氢气: 溶液显碱性,其溶液中除
溶液显碱性,其溶液中除 、
、 外,还有
外,还有 。
。
【作出猜想】可能是 溶液中的某一种离子促进了镁与水的反应。
溶液中的某一种离子促进了镁与水的反应。
【实验2】按图3所示方案进行实验。G、I中缓慢产生气泡,H中快速产生较多气泡,说明是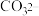 而不是
而不是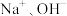 促进了镁与水的反应。
促进了镁与水的反应。
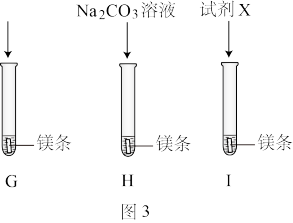
(4)G中实验的作用是___________ 。
(5)试剂X是___________ 溶液。
探究Ⅲ:反应产生的白色沉淀中是否含有 ?
?
【实验3】取实验1反应生成的沉淀于试管中,加入试剂Y,根据实验现象说明白色沉淀中含有 。
。
(6)试剂Y为___________ ,实验操作及现象为___________ ,写出 与试剂Y反应的化学方程式
与试剂Y反应的化学方程式___________ 。
反思交流与结论: 与
与 溶液反应产生氢气,白色沉淀中可能含有
溶液反应产生氢气,白色沉淀中可能含有 ,
, 溶液中
溶液中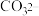 促进了镁与水的反应。
促进了镁与水的反应。
 溶液中,快速产生较多气泡,有白色沉淀生成,小组同学对此进行了系列探究活动。
溶液中,快速产生较多气泡,有白色沉淀生成,小组同学对此进行了系列探究活动。探究1:反应产生的气体是什么?
【作出猜想】
(1)小组同学经查阅资料和讨论,根据化学变化过程中元素不变,且反应物中含有
①氢气;②二氧化碳;③氢气和二氧化碳。
【实验1】取适量镁条、
 溶液于反应装置A中,按如图1所示方案进行实验,B中石灰水不变浑浊;C处气体燃烧,烧杯内壁有水珠。说明猜想①正确。
溶液于反应装置A中,按如图1所示方案进行实验,B中石灰水不变浑浊;C处气体燃烧,烧杯内壁有水珠。说明猜想①正确。
(2)反应装置A应选用图2中的

(3)小组同学讨论认为,上述实验中“烧杯内壁有水珠”作为“反应产生的气体是氢气”的证据不可靠。为使这一证据可靠,且仍能一次性地验证三个猜想,只需在图1所示方案的基础上加以改进完善。你的改进方案是
探究II:快速产生气体的原因是什么?
【查阅资科】镁与水缓慢反应生成氢气:
 溶液显碱性,其溶液中除
溶液显碱性,其溶液中除 、
、 外,还有
外,还有 。
。【作出猜想】可能是
 溶液中的某一种离子促进了镁与水的反应。
溶液中的某一种离子促进了镁与水的反应。【实验2】按图3所示方案进行实验。G、I中缓慢产生气泡,H中快速产生较多气泡,说明是
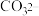 而不是
而不是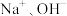 促进了镁与水的反应。
促进了镁与水的反应。
(4)G中实验的作用是
(5)试剂X是
探究Ⅲ:反应产生的白色沉淀中是否含有
 ?
?【实验3】取实验1反应生成的沉淀于试管中,加入试剂Y,根据实验现象说明白色沉淀中含有
 。
。(6)试剂Y为
 与试剂Y反应的化学方程式
与试剂Y反应的化学方程式反思交流与结论:
 与
与 溶液反应产生氢气,白色沉淀中可能含有
溶液反应产生氢气,白色沉淀中可能含有 ,
, 溶液中
溶液中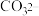 促进了镁与水的反应。
促进了镁与水的反应。
您最近一年使用:0次
名校
解题方法
5 . 某小组欲探究Cl2、Br2、I2氧化性的强弱。设计实验如下:
资料:稀溴水呈黄色;浓溴水呈红棕色;碘水呈棕黄色;NaBr、KI、KCl溶液均无色。
(1)i中反应的离子方程式是___________ 。
(2)实验I可以得出三者的氧化性强弱关系是___________ 。
(3)①甲同学认为:实验Ⅱ观察到___________ 现象,得出氧化性Br2>I2。
②乙同学对上述实验进行反思,认为实验Ⅱ不能充分证明氧化性Br2>I2,他补做了实验Ⅲ,证明了氧化性Br2>I2。
补做实验Ⅲ的目的是___________ 。
(4)综合实验I和Ⅲ,得出氧化性强弱关系为:___________ 。
资料:稀溴水呈黄色;浓溴水呈红棕色;碘水呈棕黄色;NaBr、KI、KCl溶液均无色。
| 实验I | 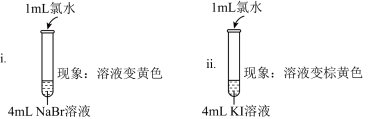 |
| 实验II | 取i中的黄色溶液少许,加入KI溶液,再加入淀粉溶液。 |
(2)实验I可以得出三者的氧化性强弱关系是
(3)①甲同学认为:实验Ⅱ观察到
②乙同学对上述实验进行反思,认为实验Ⅱ不能充分证明氧化性Br2>I2,他补做了实验Ⅲ,证明了氧化性Br2>I2。
| 实验Ⅲ | 另取i中的黄色溶液少许,先加入足量的NaBr固体,充分振荡,然后加入KI溶液和淀粉溶液。 |
(4)综合实验I和Ⅲ,得出氧化性强弱关系为:
您最近一年使用:0次
2023-10-17更新
|
93次组卷
|
2卷引用:北京市第一○一中学(温泉校区)2023-2024学年高一上学期10月月考化学试题
6 . 关于下列实验的说法不正确的是
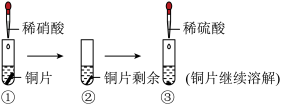
| A.①中溶液呈蓝色,试管口有红棕色气体产生 |
B.②中溶液中的主要离子有 和 和 |
C.③中铜片继续溶解,是由于稀硫酸提供的 增强了溶液的氧化性 增强了溶液的氧化性 |
| D.①和③中铜片溶解时反应的离子方程式相同 |
您最近一年使用:0次
2023-07-12更新
|
273次组卷
|
4卷引用:北京市陈经纶中学2023-2024学年高一下学期3月月考化学试题
北京市陈经纶中学2023-2024学年高一下学期3月月考化学试题北京市东城区2022-2023学年高一下学期期末统一检测化学试题(已下线)专题01 硫、氮及其化合物-【好题汇编】备战2023-2024学年高一化学下学期期末真题分类汇编(北京专用)北京工业大学附属中学2023-2024学年高一下学期期中考试化学试题
名校
7 . 实验小组同学探究用新制氢氧化铜检验葡萄糖的适宜条件。
资料:ⅰ.葡萄糖在碱的作用下,可以生成黄色物质;随着温度升高,可聚合为颜色更深(如棕色)的聚合物。
ⅱ.Cu2O、CuO均溶于氨水,生成 、
、 ;Cu不溶于氨水。
;Cu不溶于氨水。
(1)探究NaOH溶液的用量对该反应的影响。
①实验Ⅱ中,葡萄糖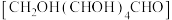 转化为
转化为___________ 。
②分析实验Ⅱ能生成砖红色沉淀但实验Ⅰ不能生成砖红色沉淀的原因:
a.电极反应式:
ⅰ.还原反应:
ⅱ.氧化反应:___________ 。
b.依据电极反应式分析实验Ⅱ有砖红色沉淀生成的可能原因:随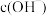 增大,
增大, 氧化性减弱,但是
氧化性减弱,但是___________ 。
(2)探究葡萄糖溶液的用量和水浴温度(加热时间约1min,冷却后过滤)对该反应的影响。
①经检验,实验Ⅳ中产生的黑色沉淀中含有Cu。检验方法是:取实验Ⅳ中70℃时产生的沉淀,洗涤,___________ (填操作和现象)。
②分析实验Ⅲ未产生黑色Cu的原因,同学提出两种假设:
假设a:葡萄糖物质的量少,无法将Cu(Ⅱ)还原为Cu单质。
假设b:___________ (补充完整)。
经定量分析可知假设a不成立。
(3)综合以上实验,用新制氢氧化铜检验葡萄糖时,为了能更好地观察到试管内产生砖红色沉淀,将宜采用的条件填入下表。
资料:ⅰ.葡萄糖在碱的作用下,可以生成黄色物质;随着温度升高,可聚合为颜色更深(如棕色)的聚合物。
ⅱ.Cu2O、CuO均溶于氨水,生成
 、
、 ;Cu不溶于氨水。
;Cu不溶于氨水。(1)探究NaOH溶液的用量对该反应的影响。
编号 | 实验Ⅰ | 实验Ⅱ |
| 实验方案 |
|
|
| 实验现象 | 加热,无明显现象,静置后未见砖红色沉淀 | 加热、静置后,底部有砖红色沉淀 |
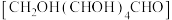 转化为
转化为②分析实验Ⅱ能生成砖红色沉淀但实验Ⅰ不能生成砖红色沉淀的原因:
a.电极反应式:
ⅰ.还原反应:

ⅱ.氧化反应:
b.依据电极反应式分析实验Ⅱ有砖红色沉淀生成的可能原因:随
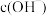 增大,
增大, 氧化性减弱,但是
氧化性减弱,但是(2)探究葡萄糖溶液的用量和水浴温度(加热时间约1min,冷却后过滤)对该反应的影响。
编号 | 实验Ⅲ | 实Ⅳ |
| 实验方案 |
|
|
温度 | 现象 | |
50℃ | 得到较多砖红色沉淀;滤液呈极浅黄色 | 得到大量砖红色沉淀;滤液呈浅橙色 |
70℃ | 得到较多砖红色沉淀;滤液呈棕黄色 | 得到大量砖红色沉淀并伴有少量黑色沉淀;滤液呈棕色 |
100℃ | 得到较多砖红色沉淀;滤液呈红棕色 | 得到大量黑色沉淀;滤液呈深棕色 |
②分析实验Ⅲ未产生黑色Cu的原因,同学提出两种假设:
假设a:葡萄糖物质的量少,无法将Cu(Ⅱ)还原为Cu单质。
假设b:
经定量分析可知假设a不成立。
(3)综合以上实验,用新制氢氧化铜检验葡萄糖时,为了能更好地观察到试管内产生砖红色沉淀,将宜采用的条件填入下表。
| 温度/℃ | NaOH溶液 | 葡萄糖溶液 | |
| 条件 | 2mL10%NaOH溶液 |
您最近一年使用:0次
2023-07-12更新
|
290次组卷
|
7卷引用:北京市顺义牛栏山第一中学2023-2024学年高三上学期10月月考化学试题
北京市顺义牛栏山第一中学2023-2024学年高三上学期10月月考化学试题北京朝阳区2022-2023学年高二下学期期末考试化学试题(已下线)高二化学期末押题卷01-【好题汇编】备战2023-2024学年高二化学下学期期末真题分类汇编(北京专用)(已下线)专题04 有机实验-【好题汇编】备战2023-2024学年高二化学下学期期末真题分类汇编(北京专用)(已下线)题型突破02 有机实验(综合题)-【好题汇编】备战2023-2024学年高二化学下学期期末真题分类汇编(北京专用)名校期末好题汇编-生物大分子(非选择题)(已下线)题型05 有机实验分析-【好题汇编】备战2023-2024学年高二化学下学期期末真题分类汇编(人教版2019)
名校
解题方法
8 . 某科研小组对乙醛与新制Cu(OH)2反应的实验进行探究。文献资料:
a.Cu(OH)2与OH-反应生成[Cu(OH)4]2-(蓝紫色)。
b.Cu2O在碱性条件下稳定,在酸性溶液中不稳定,如:Cu2O Cu+Cu2+。
Cu+Cu2+。
Ⅰ.探究NaOH在乙醛与新制Cu(OH)2浊液反应中的作用
实验记录如下:
(1)实验ⅰ中的浅蓝绿色沉淀的主要成份为Cu2(OH)2SO4,受热不易分解。写出生成Cu2(OH)2SO4的化学方程式___________ 。
(2)实验ⅰ、ⅱ、ⅲ中,实验___________ 的新制Cu(OH)2浊液与乙醛反应生成了Cu2O。
(3)为进一步探究新制Cu(OH)2与乙醛反应的本质,科研小组又进行如下实验:
① 由实验ⅳ的现象推测:实验ⅱ的黑色沉淀是___________ 。
② 实验ⅴ能够产生砖红色沉淀的原因是___________ (结合微粒符号解释),写出实验ⅴ中该微粒与乙醛发生反应的方程式___________ 。
Ⅱ.对“黄绿色浊液→橙黄色浊液”异常现象的探究及产物的分离检验
(4)针对实验ⅲ、ⅴ中“黄绿色浊液→橙黄色浊液”的异常现象,通过实验证明了“橙黄色”与乙醛在碱性条件下发生反应生成的有色物质有关。实验方案为:___________ ,加热,无色溶液先变为亮黄色,逐渐加深为橙黄色。
(5)为分离实验ⅴ中砖红色物质,进行如下操作:取实验ⅴ反应后浊液,加入50%乙醇溶液,过滤,得到砖红色固体W,滤液放置24小时后,底部有几粒黄豆大小的黄色油状物质P。
① 文献表明:黄色油状物质P主要是乙醛在碱性条件下的聚合产物。在碱作用下,乙醛发生羟醛缩合反应生成CH3CH=CHCHO,CH3CH=CHCHO与乙醛继续发生羟醛缩合反应,最终生成多烯醛聚合物。写出由乙醛生成多烯醛聚合物的反应方程式___________ 。
② 为进一步确定砖红色固体W的成分,该小组同学设计以下实验方案:取少量砖红色固体W于试管中,加入过量稀H2SO4,振荡,溶液变为蓝色并有紫红色固体。由实验现象能否得出该砖红色固体W是Cu2O,理由是___________ 。
a.Cu(OH)2与OH-反应生成[Cu(OH)4]2-(蓝紫色)。
b.Cu2O在碱性条件下稳定,在酸性溶液中不稳定,如:Cu2O
 Cu+Cu2+。
Cu+Cu2+。Ⅰ.探究NaOH在乙醛与新制Cu(OH)2浊液反应中的作用
实验记录如下:
| 序号 | 5% CuSO4 溶液体积 | 10% NaOH 溶液的体积 | 振荡后现象 | 加入0.5 mL 40%的乙醛溶液,加热后现象 |
| ⅰ | 2 mL | 5滴 | 浅蓝绿色沉淀 | 仍然为浅蓝绿色沉淀 |
| ⅱ | 2 mL | 0.5 mL | 浅蓝色沉淀 | 浅蓝色沉淀→黑色沉淀 |
| ⅲ | 5滴 | 2 mL | 蓝色浊液 | 蓝色浊液→黄绿色浊液→橙黄色浊液→砖红色浊液 |
(2)实验ⅰ、ⅱ、ⅲ中,实验
(3)为进一步探究新制Cu(OH)2与乙醛反应的本质,科研小组又进行如下实验:
| 序号 | 实验 | 加入试剂 | 加入0.5 mL 40%的乙醛溶液,加热后现象 |
| ⅳ |
| 3 mL H2O | 蓝色沉淀→黑色沉淀 |
| ⅴ | 3 mL 10% NaOH | 蓝色浊液→黄绿色浊液→橙黄色浊液→砖红色浊液 |
② 实验ⅴ能够产生砖红色沉淀的原因是
Ⅱ.对“黄绿色浊液→橙黄色浊液”异常现象的探究及产物的分离检验
(4)针对实验ⅲ、ⅴ中“黄绿色浊液→橙黄色浊液”的异常现象,通过实验证明了“橙黄色”与乙醛在碱性条件下发生反应生成的有色物质有关。实验方案为:
(5)为分离实验ⅴ中砖红色物质,进行如下操作:取实验ⅴ反应后浊液,加入50%乙醇溶液,过滤,得到砖红色固体W,滤液放置24小时后,底部有几粒黄豆大小的黄色油状物质P。
① 文献表明:黄色油状物质P主要是乙醛在碱性条件下的聚合产物。在碱作用下,乙醛发生羟醛缩合反应生成CH3CH=CHCHO,CH3CH=CHCHO与乙醛继续发生羟醛缩合反应,最终生成多烯醛聚合物。写出由乙醛生成多烯醛聚合物的反应方程式
② 为进一步确定砖红色固体W的成分,该小组同学设计以下实验方案:取少量砖红色固体W于试管中,加入过量稀H2SO4,振荡,溶液变为蓝色并有紫红色固体。由实验现象能否得出该砖红色固体W是Cu2O,理由是
您最近一年使用:0次
2023-07-10更新
|
186次组卷
|
4卷引用:北京市顺义区杨镇第一中学2023-2024学年高三上学期第一次月考化学试题
北京市顺义区杨镇第一中学2023-2024学年高三上学期第一次月考化学试题北京市石景山区2022-2023学年高二下学期期末考试化学试题(已下线)题型突破02 有机实验(综合题)-【好题汇编】备战2023-2024学年高二化学下学期期末真题分类汇编(北京专用)名校期末好题汇编-烃的衍生物(非选择题)
真题
名校
9 . 某小组进行实验,向 蒸馏水中加入
蒸馏水中加入 ,充分振荡,溶液呈浅棕色,再加入
,充分振荡,溶液呈浅棕色,再加入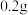 锌粒,溶液颜色加深;最终紫黑色晶体消失,溶液褪色。已知
锌粒,溶液颜色加深;最终紫黑色晶体消失,溶液褪色。已知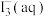 为棕色,下列关于颜色变化的解释错误的是
为棕色,下列关于颜色变化的解释错误的是
 蒸馏水中加入
蒸馏水中加入 ,充分振荡,溶液呈浅棕色,再加入
,充分振荡,溶液呈浅棕色,再加入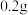 锌粒,溶液颜色加深;最终紫黑色晶体消失,溶液褪色。已知
锌粒,溶液颜色加深;最终紫黑色晶体消失,溶液褪色。已知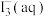 为棕色,下列关于颜色变化的解释错误的是
为棕色,下列关于颜色变化的解释错误的是| 选项 | 颜色变化 | 解释 |
| A | 溶液呈浅棕色 |  在水中溶解度较小 在水中溶解度较小 |
| B | 溶液颜色加深 | 发生了反应: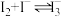 |
| C | 紫黑色晶体消失 |  ( ( )的消耗使溶解平衡 )的消耗使溶解平衡 右移 右移 |
| D | 溶液褪色 |  与有色物质发生了置换反应 与有色物质发生了置换反应 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2023-06-13更新
|
8536次组卷
|
19卷引用:中国人民大学附属中学2023-2024学年高三下学期化学练习6
中国人民大学附属中学2023-2024学年高三下学期化学练习6湖北省鄂东新领先协作体2023-2024学年高二下学期3月联考化学试题2024年中国人民大学附属中学高三下学期高考化学模拟练习试卷(六)2023年高考辽宁卷化学真题(已下线)T13-实验方案的设计与评价(已下线)2023年高考化学真题完全解读(辽宁卷)(已下线)考点09 氯及其化合物(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)(已下线)第11讲 氯气和卤族元素(已下线)专题08 反应速率与化学平衡-2023年高考化学真题题源解密(新高考专用)(已下线)专题05 化学实验基础-2023年高考化学真题题源解密(全国通用)(已下线)考点14 氯及其化合物(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)(已下线)实验03 探究外界条件对化学平衡移动的影响-【同步实验课】2023-2024学年高二化学教材实验大盘点(人教版2019选择性必修1)(已下线)考点48 实验方案设计与评价(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)浙江省杭州第十四中学2023-2024学年高二上学期 期中考试化学试卷(已下线)第3讲 物质制备实验的设计与评价10-2023新东方高二上期中考化学(已下线)FHgkyldyjhx10福建省福州第三中学2023-2024学年高三下学期第十六次检测(三模)化学试题(已下线)测试辽宁化学 请勿下载
名校
解题方法
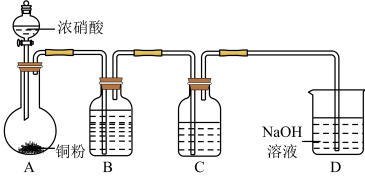
10 . 某学习小组探究稀 、浓
、浓 与铜的反应。
与铜的反应。
(1)试管Ⅰ中Cu与稀 反应的化学方程式是
反应的化学方程式是___________ 。
(2)Ⅱ中反应的速率比Ⅰ中的快,原因是___________ 。
(3)针对Ⅱ中溶液呈绿色的原因,提出假设:
假设1: 的浓度较大所致;
的浓度较大所致;
假设2:溶解了生成的 。
。
探究如下:取Ⅱ中绿色溶液,分为两等份。
①取一份置于如图所示装置中,___________ (填“操作”和“现象”),证实Ⅱ中溶解了 。
。
②向另一份溶液加入___________ (填化学试剂),溶液变为蓝色。证实假设1不成立,假设2成立。
(4)对于稀 与铜生成NO、浓
与铜生成NO、浓 与铜生成
与铜生成 的原因,提出一种解释:推测下列平衡导致了产物的不同,并通过如下实验证实了推测的合理性。
的原因,提出一种解释:推测下列平衡导致了产物的不同,并通过如下实验证实了推测的合理性。
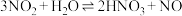
①B中盛放的试剂是___________ 。
②C中盛放 和
和___________ 。
③该小组证实推测的合理性所依据的实验现象是___________ 。
 、浓
、浓 与铜的反应。
与铜的反应。| 装置(尾气处理装置略) | 现象 |
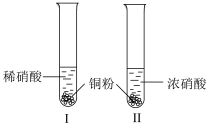 | Ⅰ中开始无明显现象,渐有小气泡生成,越来越剧烈,液面上方出现浅红棕色气体,溶液呈蓝色。 |
| Ⅱ中反应剧烈,迅速生成大量红棕色气体,溶液呈绿色。 |
 反应的化学方程式是
反应的化学方程式是(2)Ⅱ中反应的速率比Ⅰ中的快,原因是
(3)针对Ⅱ中溶液呈绿色的原因,提出假设:
假设1:
 的浓度较大所致;
的浓度较大所致;假设2:溶解了生成的
 。
。探究如下:取Ⅱ中绿色溶液,分为两等份。
①取一份置于如图所示装置中,
 。
。
②向另一份溶液加入
(4)对于稀
 与铜生成NO、浓
与铜生成NO、浓 与铜生成
与铜生成 的原因,提出一种解释:推测下列平衡导致了产物的不同,并通过如下实验证实了推测的合理性。
的原因,提出一种解释:推测下列平衡导致了产物的不同,并通过如下实验证实了推测的合理性。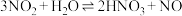

①B中盛放的试剂是
②C中盛放
 和
和③该小组证实推测的合理性所依据的实验现象是
您最近一年使用:0次