名校
1 . 用如图所示实验装置进行相关实验探究,下列说法不合理的是

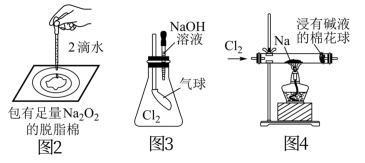


| A.图1若二氧化锰过量,则浓盐酸可全部反应完 |
| B.图2证明Na2O2与水反应放热 |
| C.图3证明Cl2能与烧碱溶液反应 |
| D.图4探究钠与Cl2反应 |
您最近一年使用:0次
2022-01-05更新
|
289次组卷
|
2卷引用:哈尔滨市第六中学校2021-2022学年高一上学期期末考试化学试题
2 . 为证明稀硝酸与铜反应产物中气体为NO,设计如图实验(实验过程中活塞2为打开状态),下列说法中不正确的是
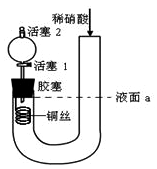

| A.关闭活塞1,加入稀硝酸至液面a处 |
| B.在装置左侧稍加热可以加快稀硝酸与铜的反应速率 |
| C.通过关闭或开启活塞1可以控制反应的进行 |
| D.反应开始后,胶塞下方有无色气体生成,还不能证明该气体为NO |
您最近一年使用:0次
2016-12-09更新
|
1695次组卷
|
19卷引用:2015-2016学年黑龙江省实验中学高二下期末化学试卷
2015-2016学年黑龙江省实验中学高二下期末化学试卷内蒙古赤峰二中2017-2018学年高一上学期期末考试化学试题黑龙江省哈尔滨市第六中学2020-2021学年高一4月月考化学试题(已下线)2011届北京市丰台区高三下学期统一练习(一)(理综)化学部分2014-2015福建省福州市八县高一下学期联考化学试卷上海市格致中学2016-2017学年高一下学期期中考试化学试题(已下线)2019高考备考一轮复习精品资料 第四章 常见的非金属及其化合物 第4讲 氮及其化合物【押题专练】(已下线)2018年12月12日 《每日一题》人教必修1-硝酸的强氧化性上海市嘉定区2016届高三第一次质量调研化学试题四川省成都龙泉第二中学2021届高三上学期九月月考化学试题浙江省浙北G2(嘉兴一中、湖州中学)2020-2021学年高二上学期期中联考化学试题辽宁省六校2021届高三上学期期中联考化学试题广东省佛山市顺德李兆基中学2020-2021学年高一3月月考化学试卷江苏省苏州市相城区黄埭中学2020-2021学年高一下学期3月月考化学试题湖北省部分重点高中2020-2021学年高一下学期4月联考化学试题吉林省延边第二中学2020届高三上学期第一次调研化学试题课中-5.2.3 硝酸 酸雨及防治-人教2019必修第二册江苏省盐城市东台创新高级中学2021-2022学年高一5月份月检测化学试题(已下线)3.2.2 铵盐和硝酸-【帮课堂】2022-2023学年高一化学同步精品讲义(沪科版2020必修第一册)
名校
解题方法
3 . 二氧化硫是硫的重要化合物,在生产、生活中有广泛应用。完成下列填空:
Ⅰ.实验室可用铜和浓硫酸加热或硫酸和亚硫酸钠反应制取二氧化硫。

(1)如果用硫酸和亚硫酸钠反应制取二氧化硫,并希望能控制反应速度,上图中可选用的发生装置是___________ (填写字母)。
(2)若用硫酸和亚硫酸钠反应制取672ml(标准状况)二氧化硫,至少需要用托盘天平称取亚硫酸钠___________ g。
Ⅱ.下图是某化学兴趣小组的同学进行 的一些性质实验(加热装置略):
的一些性质实验(加热装置略):
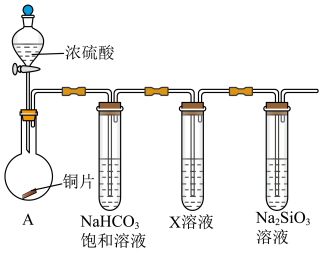
(3)首先,验证碳、硅非金属性的相对强弱。
①连接仪器、检查装置气密性、加药品后,打开分液漏斗活塞,向圆底烧瓶滴入浓硫酸,加热,则圆底烧瓶中发生反应的化学方程式为:___________ 。
②X溶液是___________ 。
③能说明碳的非金属性比硅强的实验现象是:___________ 。
(4)探究亚硫酸与次氯酸的酸性强弱。

①将少量装置A中生成的气体直接通入装置D中,不能根据D中现象判断亚硫酸与次氯酸的酸性强弱,理由是___________ (用离子反应方程式说明)。
②为了验证亚硫酸与次氯酸的酸性强弱,需要制备一种中间酸,装置B中药品是___________ ,通过___________ 现象即可证明亚硫酸的酸性强于次氯酸。
(5)化学兴趣小组的同学设计了如下实验,利用洁净的铜片(0.3mol)和浓硫酸进行反应,实验中无气体生成,Y型管左侧得到 和白色固体a,倾斜Y型管使左侧的物质全部转移到右侧稀硝酸中,反应生成固体单质b、a的溶液和NO。
和白色固体a,倾斜Y型管使左侧的物质全部转移到右侧稀硝酸中,反应生成固体单质b、a的溶液和NO。
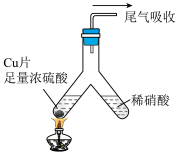
①Y型管左侧发生反应的化学方程式为___________ 。
②NO与b的物质的量之和可能为___________ 。
Ⅰ.实验室可用铜和浓硫酸加热或硫酸和亚硫酸钠反应制取二氧化硫。

(1)如果用硫酸和亚硫酸钠反应制取二氧化硫,并希望能控制反应速度,上图中可选用的发生装置是
(2)若用硫酸和亚硫酸钠反应制取672ml(标准状况)二氧化硫,至少需要用托盘天平称取亚硫酸钠
Ⅱ.下图是某化学兴趣小组的同学进行
 的一些性质实验(加热装置略):
的一些性质实验(加热装置略):
(3)首先,验证碳、硅非金属性的相对强弱。
①连接仪器、检查装置气密性、加药品后,打开分液漏斗活塞,向圆底烧瓶滴入浓硫酸,加热,则圆底烧瓶中发生反应的化学方程式为:
②X溶液是
③能说明碳的非金属性比硅强的实验现象是:
(4)探究亚硫酸与次氯酸的酸性强弱。

①将少量装置A中生成的气体直接通入装置D中,不能根据D中现象判断亚硫酸与次氯酸的酸性强弱,理由是
②为了验证亚硫酸与次氯酸的酸性强弱,需要制备一种中间酸,装置B中药品是
(5)化学兴趣小组的同学设计了如下实验,利用洁净的铜片(0.3mol)和浓硫酸进行反应,实验中无气体生成,Y型管左侧得到
 和白色固体a,倾斜Y型管使左侧的物质全部转移到右侧稀硝酸中,反应生成固体单质b、a的溶液和NO。
和白色固体a,倾斜Y型管使左侧的物质全部转移到右侧稀硝酸中,反应生成固体单质b、a的溶液和NO。
①Y型管左侧发生反应的化学方程式为
②NO与b的物质的量之和可能为
您最近一年使用:0次
4 . 某化学学习小组为了探究铁质材料碳素钢(仅含有C和Fe)和浓硫酸反应的气体产物,利用下列装置(部分夹持仪器已省略)进行了如下实验探究活动:
(1)仪器X的名称为_______ 。
(2)能证明实验生成 的实验现象为
的实验现象为_______ ; 进入装置C中被氧化为
进入装置C中被氧化为 ,
, 被还原为
被还原为 ,写出该反应的离子方程式:
,写出该反应的离子方程式:_______ 。
(3)实验过程中观察到G中无水硫酸铜由白色变成蓝色,F中发生反应的化学方程式为_______ ;产生该气体(F中的反应物)的原因为_______ 。
(4)若装置D中澄清石灰水变浑浊,装置H中澄清石灰水未变浑浊,再结合(3)推知碳素钢与浓硫酸反应产生的气体中除了含有 外,还有
外,还有_______ (填化学式);铁质材料中碳与浓硫酸反应的化学方程式为_______ 。装置H后增加装置I的目的是_______ 。

(1)仪器X的名称为
(2)能证明实验生成
 的实验现象为
的实验现象为 进入装置C中被氧化为
进入装置C中被氧化为 ,
, 被还原为
被还原为 ,写出该反应的离子方程式:
,写出该反应的离子方程式:(3)实验过程中观察到G中无水硫酸铜由白色变成蓝色,F中发生反应的化学方程式为
(4)若装置D中澄清石灰水变浑浊,装置H中澄清石灰水未变浑浊,再结合(3)推知碳素钢与浓硫酸反应产生的气体中除了含有
 外,还有
外,还有
您最近一年使用:0次
2023-04-16更新
|
277次组卷
|
3卷引用:黑龙江省哈尔滨市2022-2023学年高一下学期学业质量检测化学试题
黑龙江省哈尔滨市2022-2023学年高一下学期学业质量检测化学试题(已下线)专题01 硫、氮、硅及其化合物-【好题汇编】备战2023-2024学年高一化学下学期期末真题分类汇编(人教版2019必修第二册)湖北省宜昌市协作体2022-2023学年高一下学期期中考试化学试题
名校
解题方法
5 . Ⅰ.某同学为探究元素周期表中元素性质的递变规律,设计了如下系列实验。
(1)将将Na、K、Mg、Al各1mol分别投入到足量的同浓度的盐酸中,试预测实验结果:_______ 与盐酸反应最剧烈,_______ 与盐酸反应产生的气体最多(填元素符号)。
(2)向 溶液中通入氯气出现黄色浑浊,可证明Cl的非金属性比S强,反应的离子方程式为:
溶液中通入氯气出现黄色浑浊,可证明Cl的非金属性比S强,反应的离子方程式为:_______ 。
Ⅱ.利用如图装置可验证同主族元素非金属性的变化规律
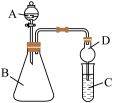
(3)仪器A的名称为_______ 。
(4)实验室中现有药品:①酸稀盐酸;②酸稀硝酸;③ 液溶液;④
液溶液;④ 固体,请选择证合适药品设计实验验证N、C、Si的非金属性的变化规律;装置A、B中所装药品分别为
固体,请选择证合适药品设计实验验证N、C、Si的非金属性的变化规律;装置A、B中所装药品分别为_______ 、_______ (填序号)。但有同学认为该装置有缺陷,如何改进?_______ 。
Ⅲ.完成下列问题
(5)铝是为数不多的能与强碱溶液反应的金属,请书写铝与氢氧化钠溶液反应的化学方程式_______ 。
(6)消除采矿业胶液中的氰化物(如KCN,C为+2价),经以下反应实现: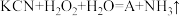 (已配平)。试指出A的化学式
(已配平)。试指出A的化学式_______ ,如此反应中有6.72L(标准状况)气体生成,转移电子数目为_______ 。
(1)将将Na、K、Mg、Al各1mol分别投入到足量的同浓度的盐酸中,试预测实验结果:
(2)向
 溶液中通入氯气出现黄色浑浊,可证明Cl的非金属性比S强,反应的离子方程式为:
溶液中通入氯气出现黄色浑浊,可证明Cl的非金属性比S强,反应的离子方程式为:Ⅱ.利用如图装置可验证同主族元素非金属性的变化规律

(3)仪器A的名称为
(4)实验室中现有药品:①酸稀盐酸;②酸稀硝酸;③
 液溶液;④
液溶液;④ 固体,请选择证合适药品设计实验验证N、C、Si的非金属性的变化规律;装置A、B中所装药品分别为
固体,请选择证合适药品设计实验验证N、C、Si的非金属性的变化规律;装置A、B中所装药品分别为Ⅲ.完成下列问题
(5)铝是为数不多的能与强碱溶液反应的金属,请书写铝与氢氧化钠溶液反应的化学方程式
(6)消除采矿业胶液中的氰化物(如KCN,C为+2价),经以下反应实现:
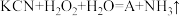 (已配平)。试指出A的化学式
(已配平)。试指出A的化学式
您最近一年使用:0次
6 . I.关于银镜反应的实验操作步骤如下:
A.在试管中先注入少量NaOH溶液,振荡,加热煮沸之后把NaOH溶液倒去,再用蒸馏水洗净试管备用
B.在洗净的试管里配制银氨溶液
C.向银氨溶液中滴入3~4滴乙醛稀溶液
D.加热
请回答下列问题:
(1)步骤A中加NaOH溶液振荡加热煮沸的目的是_______ ;
(2)简述银氨溶液的配制过程:_______ ;
(3)写出乙醛发生银镜反应的化学方程式:_______ ;
II.溴乙烷性质的探究:用如图实验装置(铁架台、酒精灯等未画出)来探究溴乙烷的性质。

(4)在试管中加入10mL6mol/LNaOH水溶液和5mL溴乙烷,振荡,水浴加热,当观察到的现象为____ 时,表明溴乙烷与NaOH水溶液已完全反应,该反应的化学方程式为____________ ;
(5)为证明溴乙烷在NaOH乙醇溶液中发生的是消去反应,将生成的气体通入如图装置。

A试管中水的作用是_________ ,若无A试管,B试管中的试剂应为_________ 。
A.在试管中先注入少量NaOH溶液,振荡,加热煮沸之后把NaOH溶液倒去,再用蒸馏水洗净试管备用
B.在洗净的试管里配制银氨溶液
C.向银氨溶液中滴入3~4滴乙醛稀溶液
D.加热
请回答下列问题:
(1)步骤A中加NaOH溶液振荡加热煮沸的目的是
(2)简述银氨溶液的配制过程:
(3)写出乙醛发生银镜反应的化学方程式:
II.溴乙烷性质的探究:用如图实验装置(铁架台、酒精灯等未画出)来探究溴乙烷的性质。

(4)在试管中加入10mL6mol/LNaOH水溶液和5mL溴乙烷,振荡,水浴加热,当观察到的现象为
(5)为证明溴乙烷在NaOH乙醇溶液中发生的是消去反应,将生成的气体通入如图装置。

A试管中水的作用是
您最近一年使用:0次
名校
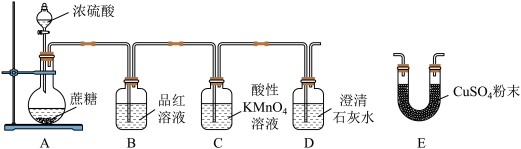
7 . 用下列实验装置进行实验,能达到实验目的的是
| A | B | C | D |
 | 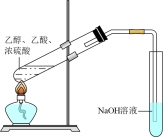 |  |  |
| 检验溴乙烷的消去产物乙烯 | 制取收集乙酸乙酯 | 证明酸性:硫酸>碳酸>苯酚 | 证明C2H2有还原性 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2022-03-16更新
|
450次组卷
|
3卷引用:黑龙江省哈尔滨师范大学附属中学2021-2022学年高二上学期期末考试化学试题
名校
解题方法
8 . 化学实验是研究物质性质的主要手段,某化学兴趣小组做以下实验
I.为研究X单质的性质,特设计如图所示装置进行实验。装置III中夹持装置已略去。其中a为干燥的品红试纸,b为湿润的品红试纸。

(1)写出装置I中发生反应的离子方程式___________ 。
(2)写出IV中发生反应的离子方程式___________ 。
II.证明过氧化钠可在呼吸面具和潜水艇中做供氧剂(C中盛放的是过氧化钠)。

(3)写出过氧化钠与二氧化碳反应的化学方程式___________
(4)D中盛放的试剂是___________
III.验证铝及化合物性质
(5)铝与碱反应的离子方程式:___________ 。
(6)偏铝酸钠中通入过量的二氧化碳方程式:___________ 。
I.为研究X单质的性质,特设计如图所示装置进行实验。装置III中夹持装置已略去。其中a为干燥的品红试纸,b为湿润的品红试纸。

(1)写出装置I中发生反应的离子方程式
(2)写出IV中发生反应的离子方程式
II.证明过氧化钠可在呼吸面具和潜水艇中做供氧剂(C中盛放的是过氧化钠)。

(3)写出过氧化钠与二氧化碳反应的化学方程式
(4)D中盛放的试剂是
III.验证铝及化合物性质
(5)铝与碱反应的离子方程式:
(6)偏铝酸钠中通入过量的二氧化碳方程式:
您最近一年使用:0次
2022-01-05更新
|
183次组卷
|
2卷引用:黑龙江省大庆中学2021-2022学年高一上学期期末考试化学试题
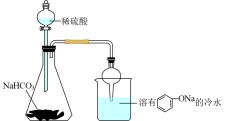
9 . 某学生用如图所示装置做浓硫酸和蔗糖反应的实验。下列有关实验操作或叙述错误的是

| A.打开A中分液漏斗活塞,加入浓硫酸,充分反应后烧瓶内出现黑色膨化固体 |
| B.品红溶液红色褪去,证明有SO2气体生成 |
| C.检验A中产生的气体中含有水蒸气,应将E接在A和B之间 |
| D.D中溶液变浑浊,即可证明反应产生了CO2 |
您最近一年使用:0次
2020-06-24更新
|
567次组卷
|
6卷引用:黑龙江省鹤岗市第一中学2019-2020学年高一下学期期末考试化学试题
黑龙江省鹤岗市第一中学2019-2020学年高一下学期期末考试化学试题河南省焦作市2019-2020学年高一上学期期末学业水平测试化学试题河北省石家庄市元氏县第四中学2019-2020学年高一下学期摸底考试化学试题四川省遂宁市射洪中学2021-2022学年高一下学期第一次月考化学试题(已下线)专题10 常见非金属元素的性质及应用-2023年高考化学毕业班二轮热点题型归纳与变式演练(新高考专用)(已下线)2023年北京卷高考真题变式题(选择题6-10)
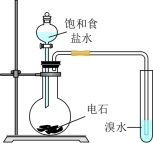
10 . 请用下列装置设计一个实验,证明Cl2的氧化性比I2的氧化性强。

请回答下列问题:
(1)若气流从左到右,则上述仪器的连接顺序为D接E,______ 接_____ ,_____ 接____ 。
(2)圆底烧瓶中发生反应的化学方程式为____________ 。
(3)证明Cl2比I2的氧化性强的实验现象是_____________ ,反应的离子方程式是________ 。
(4)装置②的作用是___________ 。
(5)若要证明Cl2的氧化性比Br2强,则需做的改动是_________ 。

请回答下列问题:
(1)若气流从左到右,则上述仪器的连接顺序为D接E,
(2)圆底烧瓶中发生反应的化学方程式为
(3)证明Cl2比I2的氧化性强的实验现象是
(4)装置②的作用是
(5)若要证明Cl2的氧化性比Br2强,则需做的改动是
您最近一年使用:0次



