解题方法
1 . 下图是元素①~⑤在元素周期表中的位置。
(1)⑤在周期表中的位置是第_______ 周期第_______ 族,其最高价氧化物对应的水化物与②的最高价氧化物对应的水化物反应的离子方程式是_______ 。
(2)③的一种核素的中子数是9,表示该核素的符号是_______ 。
(3)非金属性:④_______ ⑤(填“>”或“<”),从原子结构角度解释其原因:_______ 。
(4)②、⑤两种元素形成的化合物有重要的用途,用电子式表示它的形成过程_______ 。
(5)下列关于①的说法正确的是_______ (填字母)。
a.原子结构示意图为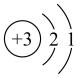
b.其单质可以和水反应生成
c.在同主族的元素中,①的金属性最强
(6)为研究②单质(X)的性质,进行如下实验:
下列说法中,正确的是_______(填字母)。
| ① | ③ | ④ | |||||
| ② | ⑤ | ||||||
(1)⑤在周期表中的位置是第
(2)③的一种核素的中子数是9,表示该核素的符号是
(3)非金属性:④
(4)②、⑤两种元素形成的化合物有重要的用途,用电子式表示它的形成过程
(5)下列关于①的说法正确的是
a.原子结构示意图为

b.其单质可以和水反应生成

c.在同主族的元素中,①的金属性最强
(6)为研究②单质(X)的性质,进行如下实验:
| 实验 | ||
| 装置 | 液体a | 现象 |
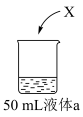 | 蒸馏水 | Ⅰ.X浮在液面上,剧烈反应,产生少量白雾 |
 盐酸 盐酸 | Ⅱ.X浮在液面上,反应比Ⅰ中剧烈,产生白雾 | |
| 浓盐酸 | Ⅲ.X浮在液面上,反应比Ⅰ中缓慢,产生大量白雾,烧杯底部有白色固体 | |
| A.Ⅰ中现象说明X与水反应放热 |
B.Ⅱ中反应的离子方程式为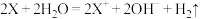 |
| C.Ⅲ中白雾比Ⅱ中多,说明Ⅲ中反应放热比Ⅱ中更多 |
D.推测Ⅲ中反应缓慢可能与 以及生成的白色固体有关 以及生成的白色固体有关 |
您最近一年使用:0次
2 . 某化学兴趣小组欲在实验室探究氯气的性质及模拟工业制取漂白粉,设计了如下装置进行实验。

请按要求回答下列问题:
(1)盛装浓盐酸仪器的名称为_______ ,圆底烧瓶中发生反应的离子方程式为_______
(2)KI溶液中观察到的现象是_______ ,反应的化学方程式为_______ 。
(3)若干燥的有色布条不褪色,湿润的有色布条褪色,则甲中盛放的是_______ (填名称)。
(4)曾有报道,在清洗卫生间时,因混合使用“洁厕灵”(主要成分是稀盐酸)与“84”消毒液(主要成分是NaClO)而发生氯气中毒事件。请写出两者发生反应的离子方程式:_______ 。
(5)该兴趣小组用 与足量的浓盐酸制备氯气,则理论上产生的气体在标况下的体积为
与足量的浓盐酸制备氯气,则理论上产生的气体在标况下的体积为_______ L。

请按要求回答下列问题:
(1)盛装浓盐酸仪器的名称为
(2)KI溶液中观察到的现象是
(3)若干燥的有色布条不褪色,湿润的有色布条褪色,则甲中盛放的是
(4)曾有报道,在清洗卫生间时,因混合使用“洁厕灵”(主要成分是稀盐酸)与“84”消毒液(主要成分是NaClO)而发生氯气中毒事件。请写出两者发生反应的离子方程式:
(5)该兴趣小组用
 与足量的浓盐酸制备氯气,则理论上产生的气体在标况下的体积为
与足量的浓盐酸制备氯气,则理论上产生的气体在标况下的体积为
您最近一年使用:0次
3 . 为验证过氧化钠可在呼吸面具和潜水艇中用作供氧剂,某同学设计了如下实验装置:
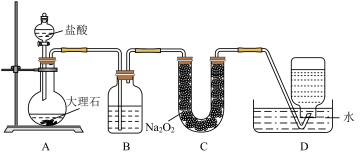
回答下列问题:
(1)装置A中发生反应的离子方程式是_______ 。
(2)B中盛放的试剂是_______ ,目的是为了_______ 。
(3)写出 与
与 反应的化学反应方程式
反应的化学反应方程式_______ 。
(4)有同学认为D中收集到的氧气可能混有 ,于是对该套装置作了改进,具体操作可以是
,于是对该套装置作了改进,具体操作可以是_______ 。
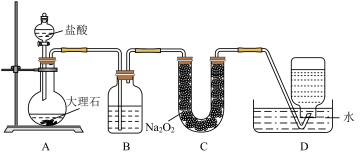
回答下列问题:
(1)装置A中发生反应的离子方程式是
(2)B中盛放的试剂是
(3)写出
 与
与 反应的化学反应方程式
反应的化学反应方程式(4)有同学认为D中收集到的氧气可能混有
 ,于是对该套装置作了改进,具体操作可以是
,于是对该套装置作了改进,具体操作可以是
您最近一年使用:0次
4 . 某校化学兴趣小组为研究氯气的性质,设计用如图所示的装置进行实验,其中a为干燥的红色试纸,b为湿润的红色试纸。

回答下列问题:
(1)装置I中仪器c的名称是______ ,实验室用二氧化锰和浓盐酸制备氯气的化学方程式为_______ 。
(2)装置V的作用是_______ 。
(3)若产生的 足量,实验过程中装置IV中的实验现象是
足量,实验过程中装置IV中的实验现象是________ 。
(4)实验结束后,该组同学在装置III中观察到b的红色褪去,但是并未观察到“装置II中a无明显变化”这一预期现象。为了达到这一实验目的,你认为还需在装置I与II之间添加下图中的装置________ (填序号)。

(5)有一种“地康法”制取氯气的反应原理如图所示:

在450℃条件下,反应II的化学方程式为_________ 。

回答下列问题:
(1)装置I中仪器c的名称是
(2)装置V的作用是
(3)若产生的
 足量,实验过程中装置IV中的实验现象是
足量,实验过程中装置IV中的实验现象是(4)实验结束后,该组同学在装置III中观察到b的红色褪去,但是并未观察到“装置II中a无明显变化”这一预期现象。为了达到这一实验目的,你认为还需在装置I与II之间添加下图中的装置

(5)有一种“地康法”制取氯气的反应原理如图所示:

在450℃条件下,反应II的化学方程式为
您最近一年使用:0次
5 . 实验装置如图所示,关闭A处的弹簧夹时,试管C中的红色布条无明显变化;打开A处的弹簧夹后,试管C中的红色布条逐渐褪色。则B瓶中盛放的试剂可能是

①饱和NaCl溶液 ②KOH溶液 ③H2O ④浓硫酸

①饱和NaCl溶液 ②KOH溶液 ③H2O ④浓硫酸
| A.①② | B.①③ | C.②④ | D.③④ |
您最近一年使用:0次
2021-11-12更新
|
75次组卷
|
2卷引用:贵州省黔东南州2021-2022学年高一上学期期末考试化学试题
解题方法
6 . 某化学兴趣小组为了探究铜与稀硝酸反应产生的气体主要是NO而设计了下列实验,装置如图所示(部分装置已略去)。图中K为止水夹,M是半空的注射器。请回答有关问题:

(1)装置A的目的是利用生成的 将整个装内的空气排尽。避免空气的干扰,装置A中所发生反应的离子方程式为
将整个装内的空气排尽。避免空气的干扰,装置A中所发生反应的离子方程式为_______ ;当装置内空气已经排尽时。可观察到的现象是_______ 。
(2)B装置中稀硝酸发生反应主要表现出的化学性质有_______ 。
(3)为实现装置C的作用,应采用的操作和观察到的现象为_______ 。
(4)将28.8g铜与140mL一定浓度的硝酸反应,铜完全溶解。产生的NO和 混合气体在标准状况下的体积为11.2L,其中NO的体积为
混合气体在标准状况下的体积为11.2L,其中NO的体积为_______ L。

(1)装置A的目的是利用生成的
 将整个装内的空气排尽。避免空气的干扰,装置A中所发生反应的离子方程式为
将整个装内的空气排尽。避免空气的干扰,装置A中所发生反应的离子方程式为(2)B装置中稀硝酸发生反应主要表现出的化学性质有
(3)为实现装置C的作用,应采用的操作和观察到的现象为
(4)将28.8g铜与140mL一定浓度的硝酸反应,铜完全溶解。产生的NO和
 混合气体在标准状况下的体积为11.2L,其中NO的体积为
混合气体在标准状况下的体积为11.2L,其中NO的体积为
您最近一年使用:0次
名校
解题方法
7 . 研究金属与硝酸的反应,实验如下。
(1)Ⅰ中的无色气体是_________ 。
(2)Ⅱ中生成H2的离子方程式是______________ 。
(3)研究Ⅱ中的氧化剂
①甲同学认为该浓度的硝酸中H+的氧化性大于 ,所以
,所以 没有发生反应。乙同学依据Ⅰ和Ⅱ证明了甲的说法不正确,其实验证据是
没有发生反应。乙同学依据Ⅰ和Ⅱ证明了甲的说法不正确,其实验证据是____________ 。
②乙同学通过分析,推测出 也能被还原,依据是
也能被还原,依据是_____________ ,进而他通过实验证实该溶液中含有 ,其实验操作是
,其实验操作是____________ 。
(4)根据实验,金属与硝酸反应时,影响硝酸还原产物不同的因素有__________ ;试推测还可能有哪些因素影响_________ (列举1条)。
| 实验(20°C) | 现象 |
| Ⅰ.过量铜粉、2mL0.5mol/L HNO3 | 无色气体(遇空气变红棕色),溶液变为蓝色 |
| Ⅱ.过量铁粉、2mL0.5mol/ HNO3 | 6mL无色气体(经检测为H2),溶液几乎无色 |
(2)Ⅱ中生成H2的离子方程式是
(3)研究Ⅱ中的氧化剂
①甲同学认为该浓度的硝酸中H+的氧化性大于
 ,所以
,所以 没有发生反应。乙同学依据Ⅰ和Ⅱ证明了甲的说法不正确,其实验证据是
没有发生反应。乙同学依据Ⅰ和Ⅱ证明了甲的说法不正确,其实验证据是②乙同学通过分析,推测出
 也能被还原,依据是
也能被还原,依据是 ,其实验操作是
,其实验操作是(4)根据实验,金属与硝酸反应时,影响硝酸还原产物不同的因素有
您最近一年使用:0次
2020-02-15更新
|
223次组卷
|
6卷引用:贵州省黔南布依族苗族自治州瓮安第二中学2019-2020学年高一上学期期末考试化学试题
名校
8 . 如图是化学教材中常用的喷泉实验装置(夹持仪器已略去),在烧瓶中充满干燥气体,而胶头滴管及烧杯中分别盛有液体。下列气体和液体的组合中不可能形成喷泉的是( )
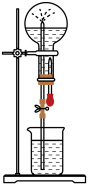

| A.氯化氢和水 |
| B.氧气和水 |
| C.氨气和水 |
| D.二氧化碳和氢氧化钠溶液 |
您最近一年使用:0次
2020-02-15更新
|
338次组卷
|
17卷引用:贵州省独山县第四中学2019-2020学年高一上学期期末考试化学试题
贵州省独山县第四中学2019-2020学年高一上学期期末考试化学试题(已下线)2012-2013学年广东省深圳科学高中高一第一学期期末考试化学试卷A云南省永善县第二中学2019—2020学年高一上学期期末考试化学试题(已下线)4.4.1 氨高中化学人教版 必修1 第四章 非金属及其化合物 4.氨 硫酸 硝酸 氨广东省汕头市金山中学2018-2019学年高一下学期第一次月考化学试题福建省三明第一中学2019-2020学年高一上学期第二次月考化学试题人教版高中化学必修1第四章《非金属及其化合物》测试卷2辽宁省抚顺县高级中学2019-2020学年高一下学期期中网课学习质量检测化学试题四川省三台中学实验学校2020-2021学年高一3月月考化学试题山西省大同市浑源县第七中学2020-2021学年高一下学期第一次月考化学试题四川省南充市白塔中学2021-2022学年高一下学期3月月考化学试题黑龙江省伊春市伊美区第二中学2021-2022学年高一下学期期中考试(会考)化学试题海南省三亚华侨学校南新校区2021-2022学年高一下学期期中考试化学试题(已下线)【走进新高考】(人教版必修一)4.4.1氨、硝酸、硫酸——氨 同步练习02(已下线)专题4.4 氮及其化合物(练)——2020年高考化学一轮复习讲练测吉林省白城市第十四中学2022届高三上学期期中考试化学试题
9 . 某小组设计如图装置(部分夹持装置已略去),以探究潮湿的Cl2与Na2CO3反应得到固体物质的成分。

(1)试剂X的化学式________ 。A中制取Cl2的离子方程式____________________ 。
(2)试剂Y的名称为______________ 。
(3)通入一定量潮湿的Cl2反应后,经检测,D中只有Cl2O一种气体,C中除含一种氯盐外,同时含有NaHCO3等,某同学对C中所得固体残渣的成分进行探究。
①提出合理假设。
假设1:存在两种成分:NaHCO3和____________________________ ;
假设2:存在三种成分:NaHCO3和__________________________ 。
②设计方案,进行实验。写出实验步骤以及预期现象和结论。_______
限选实验试剂和仪器:蒸馏水、稀硝酸、BaCl2溶液、澄清石灰水、AgNO3溶液、试管、小烧杯。
(4)已知Cl2O与水反应生成次氯酸,则D中Cl2O进入E反应的化学方程式为____________ 。

(1)试剂X的化学式
(2)试剂Y的名称为
(3)通入一定量潮湿的Cl2反应后,经检测,D中只有Cl2O一种气体,C中除含一种氯盐外,同时含有NaHCO3等,某同学对C中所得固体残渣的成分进行探究。
①提出合理假设。
假设1:存在两种成分:NaHCO3和
假设2:存在三种成分:NaHCO3和
②设计方案,进行实验。写出实验步骤以及预期现象和结论。
限选实验试剂和仪器:蒸馏水、稀硝酸、BaCl2溶液、澄清石灰水、AgNO3溶液、试管、小烧杯。
| 实验步骤 | 预期现象和结论 |
| 步骤1:取C中的少量固体样品 于试管中,滴加足量蒸馏水至 固体溶解然后将所得溶液分 别置于A、B试管中 | |
| 步骤2:向A试管中滴加BaCl2 溶液 | ———— ———— |
| 步骤3: | ———— ———— |
您最近一年使用:0次
2020-02-06更新
|
85次组卷
|
4卷引用:贵州省天柱县第二中学2019-2020学年高一上学期期末考试化学试题
10 . ClO2与Cl2的氧化性相近。在自来水消毒和果蔬保鲜等方面应用广泛。某兴趣小组通过图1装置(夹持装置略)对其制备、吸收、释放和应用进行了研究。(已知:装置C的作用是吸收Cl2)

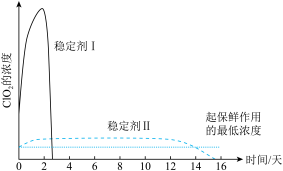
(1)仪器B的名称是________ 。安装F中导管时,应选用图2中的_________________ 。
(2)打开B的活塞,A中发生反应:2NaClO3+4HCl═2ClO2↑+Cl2↑+2NaCl+2H2O.为使ClO2在D中被稳定剂充分吸收,滴加稀盐酸的速度宜_______________ (填“快”或“慢”)。
(3)关闭B的活塞,ClO2在D中被稳定剂完全吸收生成NaClO2,NaClO2中Cl的化合价为______ 。
(4)已知在酸性条件下NaClO2可发生反应生成NaCl并释放出ClO2,该反应的离子方程式为__________ 。
(5)工业上可用KClO3与Na2SO3在H2SO4存在下制得ClO2,该反应离子方程式为___________________ 。(已知:在酸性条件下SO32-被ClO3-氧化为SO42-)
(6)已吸收ClO2气体的稳定剂Ⅰ和稳定剂Ⅱ,加酸后释放ClO2的浓度随时间的变化如图3所示,若将其用于水果保鲜,你认为效果较好的稳定剂是__________ ,原因是________________ 。


(1)仪器B的名称是
(2)打开B的活塞,A中发生反应:2NaClO3+4HCl═2ClO2↑+Cl2↑+2NaCl+2H2O.为使ClO2在D中被稳定剂充分吸收,滴加稀盐酸的速度宜
(3)关闭B的活塞,ClO2在D中被稳定剂完全吸收生成NaClO2,NaClO2中Cl的化合价为
(4)已知在酸性条件下NaClO2可发生反应生成NaCl并释放出ClO2,该反应的离子方程式为
(5)工业上可用KClO3与Na2SO3在H2SO4存在下制得ClO2,该反应离子方程式为
(6)已吸收ClO2气体的稳定剂Ⅰ和稳定剂Ⅱ,加酸后释放ClO2的浓度随时间的变化如图3所示,若将其用于水果保鲜,你认为效果较好的稳定剂是
您最近一年使用:0次



