名校
1 . 高铁酸钾 是一种新型、高效、无毒的绿色环保水处理材料。
是一种新型、高效、无毒的绿色环保水处理材料。 为紫色固体,微溶于
为紫色固体,微溶于 溶液,具有强氧化性,在酸性或中性溶液中快速产生
溶液,具有强氧化性,在酸性或中性溶液中快速产生 ,在碱性溶液中较稳定。
,在碱性溶液中较稳定。
(1) 的制备。
的制备。 的制备装置如图,回答下列问题。
的制备装置如图,回答下列问题。
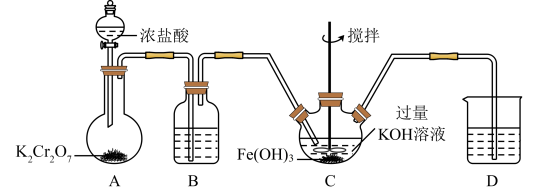
①A装置中盛放 的仪器为
的仪器为_____ (填仪器名称), 装置中反应的化学方程式为
装置中反应的化学方程式为_____ (提示:在酸性条件下, 常被还原为
常被还原为 )。
)。
②B装置中所盛试剂为_____ ;D装置的作用为_____ 。
③ 为制备
为制备 的主体装置,反应分两步进行,第一步为氯气与
的主体装置,反应分两步进行,第一步为氯气与 溶液的反应,第二步为第一步的产物之一氧化
溶液的反应,第二步为第一步的产物之一氧化 的过程。则第二步反应的离子方程式为
的过程。则第二步反应的离子方程式为_____ 。
(2)探究 的性质。取
的性质。取 中紫色溶液,加入稀硫酸,产生黄绿色气体,得溶液
中紫色溶液,加入稀硫酸,产生黄绿色气体,得溶液 ,经检验气体中含有
,经检验气体中含有 。为验证
。为验证 能否将
能否将 氧化从而产生
氧化从而产生 ,设计以下方案:
,设计以下方案:
①方案Ⅰ中溶液变红的原因为_____ (用离子方程式表示)。产生该现象_____ (填“能”或“不能”)判断一定是由 与
与 反应形成
反应形成 所致。如果不能,还可能因为
所致。如果不能,还可能因为_____ (填写离子方程式,如果上一空选“能”则本空不填)。
②方案Ⅱ得出氧化性:
_____  (填“>”或“<”)。
(填“>”或“<”)。
 是一种新型、高效、无毒的绿色环保水处理材料。
是一种新型、高效、无毒的绿色环保水处理材料。 为紫色固体,微溶于
为紫色固体,微溶于 溶液,具有强氧化性,在酸性或中性溶液中快速产生
溶液,具有强氧化性,在酸性或中性溶液中快速产生 ,在碱性溶液中较稳定。
,在碱性溶液中较稳定。(1)
 的制备。
的制备。 的制备装置如图,回答下列问题。
的制备装置如图,回答下列问题。
①A装置中盛放
 的仪器为
的仪器为 装置中反应的化学方程式为
装置中反应的化学方程式为 常被还原为
常被还原为 )。
)。②B装置中所盛试剂为
③
 为制备
为制备 的主体装置,反应分两步进行,第一步为氯气与
的主体装置,反应分两步进行,第一步为氯气与 溶液的反应,第二步为第一步的产物之一氧化
溶液的反应,第二步为第一步的产物之一氧化 的过程。则第二步反应的离子方程式为
的过程。则第二步反应的离子方程式为(2)探究
 的性质。取
的性质。取 中紫色溶液,加入稀硫酸,产生黄绿色气体,得溶液
中紫色溶液,加入稀硫酸,产生黄绿色气体,得溶液 ,经检验气体中含有
,经检验气体中含有 。为验证
。为验证 能否将
能否将 氧化从而产生
氧化从而产生 ,设计以下方案:
,设计以下方案:| 方案Ⅰ | 取少量溶液 ,滴加 ,滴加 溶液至过量,溶液呈红色 溶液至过量,溶液呈红色 |
| 方案Ⅱ | 用 溶液充分洗涤 溶液充分洗涤 中所得固体,再用 中所得固体,再用 溶液将 溶液将 溶出 溶出得到紫色溶液  。取少量 。取少量 ,滴加盐酸,有 ,滴加盐酸,有 产生 产生 |
 与
与 反应形成
反应形成 所致。如果不能,还可能因为
所致。如果不能,还可能因为②方案Ⅱ得出氧化性:

 (填“>”或“<”)。
(填“>”或“<”)。
您最近一年使用:0次
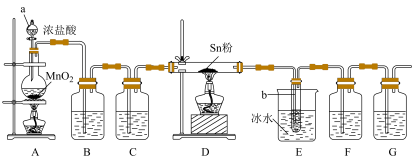
2 . 四氯化锡( )是一种重要的化工原料,主要用于有机锡化合物的制造,可由锡单质与氯气在加热时化合生成,某实验小组用如下装置对其进行制备。
)是一种重要的化工原料,主要用于有机锡化合物的制造,可由锡单质与氯气在加热时化合生成,某实验小组用如下装置对其进行制备。
【相关药品性质】
回答下列问题:
(1)“仪器a”的名称是___________ ,A中反应的离子方程式为___________ 。
(2)实验前应进行的操作是___________ ,实验开始时,应先点燃___________ (填“A”或“D”)处的酒精灯。
(3)若无“洗气瓶B”,可能会导致的问题是___________ 。
(4)“装置E”中使用冰水浴的目的是___________ 。实验结束后,“小试管b”内收集到的液体呈淡黄色,其原因是___________ 。
(5)“洗气瓶F”中所盛放的药品是___________ 。
 )是一种重要的化工原料,主要用于有机锡化合物的制造,可由锡单质与氯气在加热时化合生成,某实验小组用如下装置对其进行制备。
)是一种重要的化工原料,主要用于有机锡化合物的制造,可由锡单质与氯气在加热时化合生成,某实验小组用如下装置对其进行制备。
【相关药品性质】
| 药品 | 颜色、状态 | 熔点(℃) | 沸点(℃) | 其他性质 |
| Sn | 银白色固体 | 231 | 2260 | 较活泼金属能与 、HCl等气体发生反应 、HCl等气体发生反应 |
 | 无色液体 | -33 | 114 | 极易与水反应产生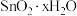 溶胶 溶胶 |
(1)“仪器a”的名称是
(2)实验前应进行的操作是
(3)若无“洗气瓶B”,可能会导致的问题是
(4)“装置E”中使用冰水浴的目的是
(5)“洗气瓶F”中所盛放的药品是
您最近一年使用:0次
名校
3 . 氯气和漂白粉是现代工业和生活中常用的杀菌消毒剂,以下为制备两种消毒剂的方法,请回答下列问题:
(1)实验室制取 的离子方程式为
的离子方程式为___________ ,装置中管f的作用是___________
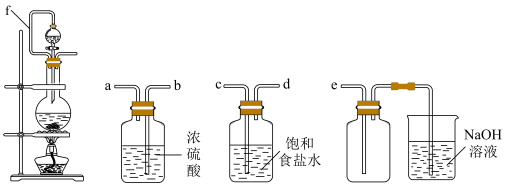
(2)实验室制取干燥、纯净的 ,所需图装置的接口连接顺序为:发生装置→
,所需图装置的接口连接顺序为:发生装置→___________ (填字母).
(3)反应停止后,实验小组检验烧瓶中还有 和盐酸.小组同学探究不继续产生
和盐酸.小组同学探究不继续产生 的原因.
的原因.
查阅资料表明,反应物或生成物浓度会影响氧化剂、还原剂的氧化性、还原性强弱.
【提出猜想】
猜想1: 降低,氧化剂氧化性减弱.
降低,氧化剂氧化性减弱.
猜想2:______________________________ 减弱
猜想3: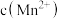 增大,氧化剂氧化性减弱.
增大,氧化剂氧化性减弱.
【实验过程】向反应后剩余物质中加入以下物质,请补充表格:
【实验拓展】经过探究,小组同学认为浓硫酸、 固体和
固体和 混合加热也可制取
混合加热也可制取 .请写出该反应的方程式:
.请写出该反应的方程式:___________________________
(1)实验室制取
 的离子方程式为
的离子方程式为
(2)实验室制取干燥、纯净的
 ,所需图装置的接口连接顺序为:发生装置→
,所需图装置的接口连接顺序为:发生装置→(3)反应停止后,实验小组检验烧瓶中还有
 和盐酸.小组同学探究不继续产生
和盐酸.小组同学探究不继续产生 的原因.
的原因.查阅资料表明,反应物或生成物浓度会影响氧化剂、还原剂的氧化性、还原性强弱.
【提出猜想】
猜想1:
 降低,氧化剂氧化性减弱.
降低,氧化剂氧化性减弱.猜想2:
猜想3:
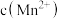 增大,氧化剂氧化性减弱.
增大,氧化剂氧化性减弱.【实验过程】向反应后剩余物质中加入以下物质,请补充表格:
| 序号 | 实验操作 | 有、无氯气 | 结论 |
| 1 | 加入浓硫酸,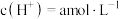 , , | 有氯气 | 猜想1正确 |
| 2 | 加入氯化钠固体,使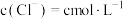 | 有氯气 | 猜想2正确 |
| 3 | 加入浓硫酸和 固体,使 固体,使 | 猜想3正确 |
 固体和
固体和 混合加热也可制取
混合加热也可制取 .请写出该反应的方程式:
.请写出该反应的方程式:
您最近一年使用:0次
解题方法
4 . I.氮元素对动植物有重要作用,研究氮的循环和转化对生产、生活有重要的价值。
(1)在实验室中由固体物质制取并收集一瓶干燥的氨气,选择图中的装置,其连接顺序为___________
__________→___________→___________→___________→___________→i(按气流方向表示导管连接顺序);仪器E中的碱石灰___________ (填“能”或“不能”)用无水 替代。
替代。

Ⅱ.氨催化氧化法是制硝酸的重要步骤,探究氨催化氧化反应的装置如下图所示:
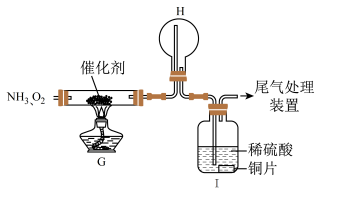
(2)一段时间后,观察到装置H中有白烟生成,该白烟成分是___________ (写化学式)。
(3)再经过一段时间观察到装置Ⅰ中溶液变成蓝色,用离子方程式解释装置Ⅰ中溶液变成蓝色的原因是___________ 。
(4)工业生产中为了盛装大量浓硝酸,可以用___________ (填标号)作为罐体材料;
A.镁 B.铁 C.锌 D.铜
此罐体材料的金属在工业上常采用冶炼的方法为___________ 。
Ⅲ.将反应 设计成原电池,其装置示意图如下(A、B为铂电极)。
设计成原电池,其装置示意图如下(A、B为铂电极)。

(5)该电池的正极为___________ (填“A”或B)电极,负极的电极反应式为___________ ,反应进行一段时间,溶液的碱性___________ (填“增强”、“减弱”或“不变”)。
(6)下列含氮物质参与的变化中属于吸热反应的是___________ (填标号)。
①氢氧化钡与氯化铵混合后搅拌 ②氨的催化氧化
③铜与浓硝酸的反应 ④硝酸铵固体投入水中
(1)在实验室中由固体物质制取并收集一瓶干燥的氨气,选择图中的装置,其连接顺序为
__________→___________→___________→___________→___________→i(按气流方向表示导管连接顺序);仪器E中的碱石灰
 替代。
替代。
Ⅱ.氨催化氧化法是制硝酸的重要步骤,探究氨催化氧化反应的装置如下图所示:

(2)一段时间后,观察到装置H中有白烟生成,该白烟成分是
(3)再经过一段时间观察到装置Ⅰ中溶液变成蓝色,用离子方程式解释装置Ⅰ中溶液变成蓝色的原因是
(4)工业生产中为了盛装大量浓硝酸,可以用
A.镁 B.铁 C.锌 D.铜
此罐体材料的金属在工业上常采用冶炼的方法为
Ⅲ.将反应
 设计成原电池,其装置示意图如下(A、B为铂电极)。
设计成原电池,其装置示意图如下(A、B为铂电极)。
(5)该电池的正极为
(6)下列含氮物质参与的变化中属于吸热反应的是
①氢氧化钡与氯化铵混合后搅拌 ②氨的催化氧化
③铜与浓硝酸的反应 ④硝酸铵固体投入水中
您最近一年使用:0次
解题方法
5 . 某兴趣小组设计如图所示装置制取SO2,研究其性质,并进一步探究在适当温度和催化剂的条件下,SO2与O2反应后混合气体的成分。

(1)仪器G的名称是_____ 。
(2)装置B、C、D分别用于检验SO2的漂白性、还原性和氧化性。则装置D中反应的化学方程式为_____ 。证明SO2具有漂白性的实验现象是_____ 。
(3)为了实现绿色化学的目标,某同学设计装置F来代替装置A,若选用装置F制取O2可选用的物质是_____ 。
(4)该小组同学设计如下装置来检验SO2与O2反应后混合气体的成分。
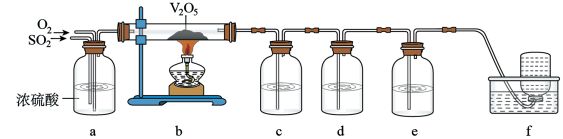
供选择试剂:品红溶液、蒸馏水、0.5mol/LBaCl2溶液、酸性KMnO4溶液。
①c中应选用的试剂是_____ ,e中试剂的作用是_____ ,f中收集的气体是_____ 。
②若b中反应已充分进行,c,d,e,f都有预期的现象,写出b中发生反应的化学方程式:_____ 。

(1)仪器G的名称是
(2)装置B、C、D分别用于检验SO2的漂白性、还原性和氧化性。则装置D中反应的化学方程式为
(3)为了实现绿色化学的目标,某同学设计装置F来代替装置A,若选用装置F制取O2可选用的物质是
(4)该小组同学设计如下装置来检验SO2与O2反应后混合气体的成分。

供选择试剂:品红溶液、蒸馏水、0.5mol/LBaCl2溶液、酸性KMnO4溶液。
①c中应选用的试剂是
②若b中反应已充分进行,c,d,e,f都有预期的现象,写出b中发生反应的化学方程式:
您最近一年使用:0次
6 . 某化学兴趣小组同学采用如图所示装置来制备氯气并检验其性质,仪器a中反应的化学方程式为 (未配平),下列说法正确的是(忽略空气对反应的影响)
(未配平),下列说法正确的是(忽略空气对反应的影响)

 (未配平),下列说法正确的是(忽略空气对反应的影响)
(未配平),下列说法正确的是(忽略空气对反应的影响)
| A.该反应中,浓盐酸只体现了还原性 |
B.生成的氯气中的氯全部来自 |
| C.随着反应进行,烧杯中溶液颜色由绿色变为黄色再变为蓝色 |
D.由该实验可判断出氧化性: |
您最近一年使用:0次
解题方法
7 . 下列关于实验的叙述中,正确的是。
| 选项 | 实验操作 | 实验现象或结论 |
| A | 用洁净铂丝蘸取溶液,在酒精喷灯外焰上灼烧,观察到火焰呈黄色 | 溶液中一定存在 ,不存在 ,不存在 |
| B | 将氯水滴加到KBr溶液中,溶液变为橙黄色 | 氧化性 |
| C | 将有色鲜花放放盛有干燥氯气的集气瓶中,盖上玻璃片 | 鲜花褪色,证明氯气具有漂白性 |
| D | 把小块钾放放到滴有紫色石蕊试液的冷水中 | 钾熔化成光亮的小球,在水面上四处游动,有“嘶嘶”的响声发出,反应后溶液变红 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
解题方法
8 .  与
与 的氧化性相近。
的氧化性相近。 在自来水消毒和果蔬保鲜等方面应用广泛。某化学兴趣小组通过如图所示装置(夹持装置已略去)对其制备、吸收、释放和应用进行了研究。
在自来水消毒和果蔬保鲜等方面应用广泛。某化学兴趣小组通过如图所示装置(夹持装置已略去)对其制备、吸收、释放和应用进行了研究。

已知:①仪器a中发生的反应为 (未配平);
(未配平);
②仪器b中盛装的粉末的作用是除去生成的 ;
;
③ 被稳定剂完全吸收生成
被稳定剂完全吸收生成 ;
;
④酸性条件下, 可发生反应生成
可发生反应生成 并释放出
并释放出 ;
;
⑤淀粉遇碘会变蓝。
回答下列问题:
(1)仪器a的名称为_______ 。
(2)打开 、关闭
、关闭 ,仪器a中发生反应的离子方程式为
,仪器a中发生反应的离子方程式为_______ 。
(3)一段时间后,关闭 、打开
、打开 ,此时仪器c中释放出的气体为
,此时仪器c中释放出的气体为_______ (填化学名称),仪器d中观察到的现象为_______ 。请写出仪器d中 与
与 发生反应的化学方程式:
发生反应的化学方程式:_______ 。
(4)仪器e中可能发生的反应:
ⅰ.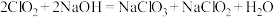 ;
;
ⅱ. 。
。
①反应ⅰ中,氧化产物为_______ (填化学式)。
②若反应ⅰ和ⅱ同时发生,当通入1mol 时,恰好被2L未知浓度的
时,恰好被2L未知浓度的 溶液完全吸收,当此时
溶液完全吸收,当此时 ,则反应后的溶液中
,则反应后的溶液中
_______ (填具体数字) (不考虑气体逸出和溶液体积的变化)。
(不考虑气体逸出和溶液体积的变化)。
 与
与 的氧化性相近。
的氧化性相近。 在自来水消毒和果蔬保鲜等方面应用广泛。某化学兴趣小组通过如图所示装置(夹持装置已略去)对其制备、吸收、释放和应用进行了研究。
在自来水消毒和果蔬保鲜等方面应用广泛。某化学兴趣小组通过如图所示装置(夹持装置已略去)对其制备、吸收、释放和应用进行了研究。
已知:①仪器a中发生的反应为
 (未配平);
(未配平);②仪器b中盛装的粉末的作用是除去生成的
 ;
;③
 被稳定剂完全吸收生成
被稳定剂完全吸收生成 ;
;④酸性条件下,
 可发生反应生成
可发生反应生成 并释放出
并释放出 ;
;⑤淀粉遇碘会变蓝。
回答下列问题:
(1)仪器a的名称为
(2)打开
 、关闭
、关闭 ,仪器a中发生反应的离子方程式为
,仪器a中发生反应的离子方程式为(3)一段时间后,关闭
 、打开
、打开 ,此时仪器c中释放出的气体为
,此时仪器c中释放出的气体为 与
与 发生反应的化学方程式:
发生反应的化学方程式:(4)仪器e中可能发生的反应:
ⅰ.
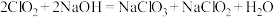 ;
;ⅱ.
 。
。①反应ⅰ中,氧化产物为
②若反应ⅰ和ⅱ同时发生,当通入1mol
 时,恰好被2L未知浓度的
时,恰好被2L未知浓度的 溶液完全吸收,当此时
溶液完全吸收,当此时 ,则反应后的溶液中
,则反应后的溶液中
 (不考虑气体逸出和溶液体积的变化)。
(不考虑气体逸出和溶液体积的变化)。
您最近一年使用:0次
2023-01-14更新
|
228次组卷
|
2卷引用:湖北省襄阳市2022-2023学年高一上学期期末统考化学试题
解题方法
9 . 某兴趣小组的同学拟采用以下装置制备氯气并进行一系列相关探究实验的装置。请回答下列问题:

(1)装置A中a仪器的名称:______ ,用装置A制氯气所发生反应的离子方程式为______ ,反应中氧化剂与还原剂的物质的量之比为______ 。
(2)装置C的实验目的是验证氯气是否具有漂白性,为此装置C中I、II、III处依次放入______ (填字母)。
(3)设计装置D、E的目的是比较氯、溴、碘的非金属性。实验过程:
I.打开弹簧夹,打开a的活塞,滴加浓盐酸。
II.当D和F中的溶液都变为黄色时,夹紧弹簧夹。
III.当D中溶液由黄色变为红棕色时,关闭a的活塞。
IV.打开活塞b,将少量F中溶液滴入E中,关闭活塞b,取下E振荡,静置后CCl4层变为紫红色
①过程IV的现象能证明溴的氧化性强于碘,反应的离子方程式是______ 。
②过程III实验的目的是_____ 。
③氯、溴、碘单质的氧化性逐渐减弱的原因:同主族元素从上到下______ ,得电子能力逐渐减弱。

(1)装置A中a仪器的名称:
(2)装置C的实验目的是验证氯气是否具有漂白性,为此装置C中I、II、III处依次放入
| a | b | c | d | |
| I | 干燥的有色布条 | 干燥的有色布条 | 湿润的有色布条 | 湿润的有色布条 |
| II | 碱石灰 | 硅胶 | 浓硫酸 | 无水氯化钙 |
| III | 湿润的有色布条 | 湿润的有色布条 | 干燥的有色布条 | 干燥的有色布条 |
I.打开弹簧夹,打开a的活塞,滴加浓盐酸。
II.当D和F中的溶液都变为黄色时,夹紧弹簧夹。
III.当D中溶液由黄色变为红棕色时,关闭a的活塞。
IV.打开活塞b,将少量F中溶液滴入E中,关闭活塞b,取下E振荡,静置后CCl4层变为紫红色
①过程IV的现象能证明溴的氧化性强于碘,反应的离子方程式是
②过程III实验的目的是
③氯、溴、碘单质的氧化性逐渐减弱的原因:同主族元素从上到下
您最近一年使用:0次
10 . 用如图所示装置进行Fe与水蒸气反应的实验,下列有关说法正确的是

| A.实验时,先点燃酒精喷灯再点燃酒精灯 |
| B.反应中H2O作氧化剂,发生反应的化学方程式为2Fe+3H2O=Fe2O3+3H2 |
| C.干燥管中加入的固体干燥剂可以是无水氯化钙 |
| D.收集反应产生的气体选用装置② |
您最近一年使用:0次
2022-07-18更新
|
1165次组卷
|
13卷引用:湖北省十堰市2020-2021学年高一上学期期末考试化学试题
湖北省十堰市2020-2021学年高一上学期期末考试化学试题吉林省磐石一中、伊通一中、梅河口五中、四平一中等2020-2021学年高一上学期期末考试化学试题安徽省皖西南联盟2020-2021学年高一上学期期末考试化学试题江西省抚州市2020-2021学年高一上学期学生学业发展水平测试(期末考试) 化学(B卷) 试题黑龙江省哈尔滨师范大学附属中学2021-2022学年高一下学期期末考试化学试题(已下线)新人教必修1第3章第一节第1课时铁的单质(课后)(已下线)《新教材变化解读及考法剖析 》(人教版2019必修第一册)第三章河北省衡水市第十四中学2020-2021学年高一下学期摸底考试化学试题(已下线)第三章 铁 金属材料(B卷·能力提升练)-【单元测试】2022-2023学年高一化学分层训练AB卷(人教版2019必修第一册)福建省龙岩第一中学2022-2023学年高一上学期第二次月考化学试题吉林省吉林市第一中学2023-2024学年高一上学期11月期中化学试题(已下线)【定心卷】3.1.1 铁的单质随堂练习-人教版2023-2024学年必修第一册(已下线)考点巩固卷03 金属及其化合物(4大考点48题)-2024年高考化学一轮复习考点通关卷(新高考通用)



