名校
解题方法
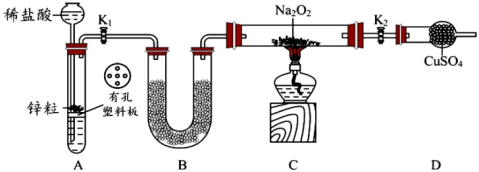
1 . I.某化学自主实验小组利用如图所示装置探究 能否被
能否被 还原
还原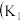 、
、 为止水夹,夹持固定装置略去)。
为止水夹,夹持固定装置略去)。________ 。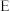 装置发生的化学反应方程式为
装置发生的化学反应方程式为_________ 。
(2)甲、乙分别是___________  填标号
填标号 。
。
a.硫酸、浓硫酸 b.碱石灰、无水氯化钙 c.碱石灰、碱石灰 d.五氧化二磷、五氧化二磷
(3)若 能够被
能够被 还原,写出发生反应的化学方程式:
还原,写出发生反应的化学方程式:___________ 。
(4)此实验装置存在一个明显的缺陷是___________ 。
II.硫酸可用于生产化肥、农药、炸药、染料和盐类等。工业生产硫酸的流程图如下: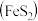 为原料来制备SO2,将黄铁矿粉碎的原因是:
为原料来制备SO2,将黄铁矿粉碎的原因是:___________ 。
(6)写出催化反应室中SO2被氧化为SO3的化学方程式___________ 。
(7)硫酸工业的尾气中含有少量SO2,若直接排放会污染空气,并导致硫酸型酸雨,可用___________ 吸收。
 能否被
能否被 还原
还原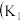 、
、 为止水夹,夹持固定装置略去)。
为止水夹,夹持固定装置略去)。
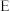 装置发生的化学反应方程式为
装置发生的化学反应方程式为(2)甲、乙分别是
 填标号
填标号 。
。a.硫酸、浓硫酸 b.碱石灰、无水氯化钙 c.碱石灰、碱石灰 d.五氧化二磷、五氧化二磷
(3)若
 能够被
能够被 还原,写出发生反应的化学方程式:
还原,写出发生反应的化学方程式:(4)此实验装置存在一个明显的缺陷是
II.硫酸可用于生产化肥、农药、炸药、染料和盐类等。工业生产硫酸的流程图如下:
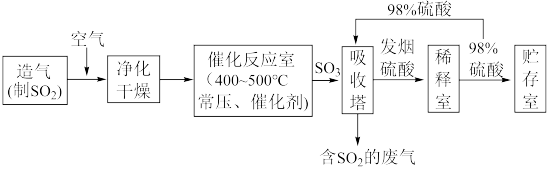
 为原料来制备SO2,将黄铁矿粉碎的原因是:
为原料来制备SO2,将黄铁矿粉碎的原因是:(6)写出催化反应室中SO2被氧化为SO3的化学方程式
(7)硫酸工业的尾气中含有少量SO2,若直接排放会污染空气,并导致硫酸型酸雨,可用
您最近一年使用:0次
2024-02-24更新
|
752次组卷
|
5卷引用:新疆克孜勒苏柯尔克孜自治州第二中学2022-2023学年高一下学期期末考试化学试题
新疆克孜勒苏柯尔克孜自治州第二中学2022-2023学年高一下学期期末考试化学试题(已下线)期末押题卷01-【好题汇编】备战2023-2024学年高一化学下学期期末真题分类汇编(天津专用)安徽省合肥市第一中学2023-2024学年高一下学期月考化学试题(一)广东省广州市黄广中学2023-2024学年高一下学期3月月考化学试题河南省三门峡市渑池县第二高级中学2023-2024学年高一下学期4月期中考试化学试题
2 . 磺酰氯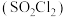 是重要的有机合成试剂,实验室可利用
是重要的有机合成试剂,实验室可利用 与
与 在活性炭作用下反应制取少量
在活性炭作用下反应制取少量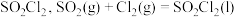 ,该反应放热,装置如图所示(部分夹持装置省略)。已知
,该反应放热,装置如图所示(部分夹持装置省略)。已知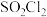 的熔点为
的熔点为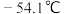 ,沸点为
,沸点为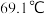 ,遇水能发生剧烈的水解反应,并产生白雾。
,遇水能发生剧烈的水解反应,并产生白雾。
回答下列问题。 ,则下列试剂组合中合适的是___________。
,则下列试剂组合中合适的是___________。
(2)导管a的作用是___________ ;仪器b中的试剂是___________ 。
(3)实验结束时,关闭分液漏斗活塞和止水夹k,此时装置戊的作用是___________ 。
(4)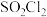 遇水发生反应生成两种酸,该反应的化学方程式为
遇水发生反应生成两种酸,该反应的化学方程式为___________ 。
(5)若反应中消耗的氯气体积为 (标准状况下),最后经过分离提纯得到
(标准状况下),最后经过分离提纯得到 纯净的磺酰氯,则磺酰氯的产率为
纯净的磺酰氯,则磺酰氯的产率为___________ (产率:实际产量/理论产量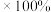 )。
)。
(6)已知酸性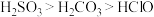 ,借助该酸性排序,使用以下装置设计实验证明
,借助该酸性排序,使用以下装置设计实验证明 的酸性强于
的酸性强于 ,其连接顺序应为
,其连接顺序应为
___________ 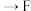 ;能证明
;能证明 的酸性强于
的酸性强于 的实验现象为
的实验现象为___________ 。
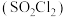 是重要的有机合成试剂,实验室可利用
是重要的有机合成试剂,实验室可利用 与
与 在活性炭作用下反应制取少量
在活性炭作用下反应制取少量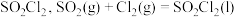 ,该反应放热,装置如图所示(部分夹持装置省略)。已知
,该反应放热,装置如图所示(部分夹持装置省略)。已知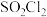 的熔点为
的熔点为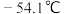 ,沸点为
,沸点为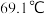 ,遇水能发生剧烈的水解反应,并产生白雾。
,遇水能发生剧烈的水解反应,并产生白雾。回答下列问题。

 ,则下列试剂组合中合适的是___________。
,则下列试剂组合中合适的是___________。A. 的硫酸和 的硫酸和 | B. 的硝酸和 的硝酸和 固体 固体 |
C.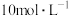 的硫酸和 的硫酸和 固体 固体 | D. 的硫酸和 的硫酸和 固体 固体 |
(2)导管a的作用是
(3)实验结束时,关闭分液漏斗活塞和止水夹k,此时装置戊的作用是
(4)
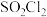 遇水发生反应生成两种酸,该反应的化学方程式为
遇水发生反应生成两种酸,该反应的化学方程式为(5)若反应中消耗的氯气体积为
 (标准状况下),最后经过分离提纯得到
(标准状况下),最后经过分离提纯得到 纯净的磺酰氯,则磺酰氯的产率为
纯净的磺酰氯,则磺酰氯的产率为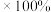 )。
)。(6)已知酸性
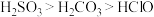 ,借助该酸性排序,使用以下装置设计实验证明
,借助该酸性排序,使用以下装置设计实验证明 的酸性强于
的酸性强于 ,其连接顺序应为
,其连接顺序应为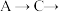
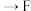 ;能证明
;能证明 的酸性强于
的酸性强于 的实验现象为
的实验现象为
您最近一年使用:0次
2024-02-23更新
|
157次组卷
|
2卷引用:广东省深圳实验学校高中部2023-2024学年高一上学期第三阶段考试化学试题
名校
3 . 已知: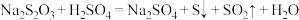 .按如图装置,进行实验.下列说法
.按如图装置,进行实验.下列说法错误 的是
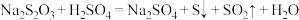 .按如图装置,进行实验.下列说法
.按如图装置,进行实验.下列说法
A.Ⅰ中试管内的反应,体现 的酸性 的酸性 | B.Ⅱ中品红溶液褪色,体现 的漂白性 的漂白性 |
C.Ⅲ中出现浑浊现象,体现 的氧化性 的氧化性 | D.在Ⅰ和Ⅳ试管中,都发生氧化还原反应 |
您最近一年使用:0次
2024-02-22更新
|
906次组卷
|
5卷引用:福建省龙岩市龙岩市一级校联盟2023-2024学年高一上学期1月期末化学试题
福建省龙岩市龙岩市一级校联盟2023-2024学年高一上学期1月期末化学试题河南省驻马店市新蔡县第一高级中学2023-2024学年高一下学期3月月考化学试题(已下线)专题01 硫及其化合物(考题猜想)(8大题型)-2023-2024学年高一化学下学期期中考点大串讲(人教版2019必修第二册)河南省郑州市宇华实验学校2023-2024学年高一下学期3月月考化学试题广东省广州市黄广中学2023-2024学年高一下学期3月月考化学试题
名校
解题方法
4 . 化合物(YW4)2X2Z4·W2Z为无色柱状晶体,受热易分解,已知W、X、Y、Z的原子序数依次增大,其和为22,X、Y、Z为同一周期相邻元素。可利用下图装置检验该化合物分解出的相同元素组成的不同产物。
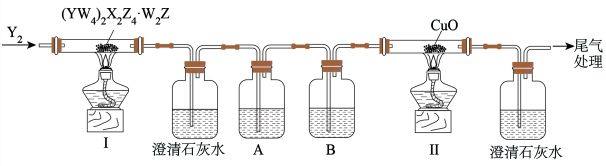
| A.(YW4)2X2Z4的物质类别为正盐 |
| B.装置B中盛装的试剂是氢氧化钠溶液 |
| C.反应开始前通入Y2,可以避免装置中的空气干扰产物的检验 |
| D.装置中两处澄清石灰水都变浑浊,证明分解产物中含有两种由X、Z组成的物质 |
您最近一年使用:0次
2024-02-19更新
|
274次组卷
|
2卷引用:陕西省西安交通大学附属中学2023-2024学年高一上学期期末考试化学试卷
名校
5 . 碘化亚铁 在常温下为灰黑色固体,易升华,可溶于水,具有潮解性,常用于医药,可由碘单质和还原铁粉在加热条件下制备得到。
在常温下为灰黑色固体,易升华,可溶于水,具有潮解性,常用于医药,可由碘单质和还原铁粉在加热条件下制备得到。 )
)
(1)装置中盛碱石灰的仪器名称为_____ 。若无此装置,写出铁粉参与的副反应的化学方程式:_____ 。
(2)收集器浸泡在冷水中的原因是_____ 。
(3)试剂a为_____ ,其作用是_____ 。
Ⅱ、化学兴趣小组为了探究 的还原性,进行了如下实验:取一定量的
的还原性,进行了如下实验:取一定量的 溶液,向其中滴加少量新制的氯水,振荡后溶液呈黄色。同学们对溶液变成黄色的原因提出了不同的看法:
溶液,向其中滴加少量新制的氯水,振荡后溶液呈黄色。同学们对溶液变成黄色的原因提出了不同的看法:
甲同学认为:是因为被 氧化成
氧化成 ;乙同学认为:是因为被
;乙同学认为:是因为被 氧化成
氧化成 。
。
随后化学兴趣小组进行如下实验进行验证。
(4)上述实验②中现象为_____ 。化学兴趣小组得到的结论: 的还原性
的还原性_____  的还原性(填“
的还原性(填“ ”、“
”、“ ”或“
”或“ ”)。
”)。
(5)依据(4)中所得结论,试写出往过量 溶液中通入少量氯气后所发生反应的离子反应方程式:
溶液中通入少量氯气后所发生反应的离子反应方程式:_____ 。
 在常温下为灰黑色固体,易升华,可溶于水,具有潮解性,常用于医药,可由碘单质和还原铁粉在加热条件下制备得到。
在常温下为灰黑色固体,易升华,可溶于水,具有潮解性,常用于医药,可由碘单质和还原铁粉在加热条件下制备得到。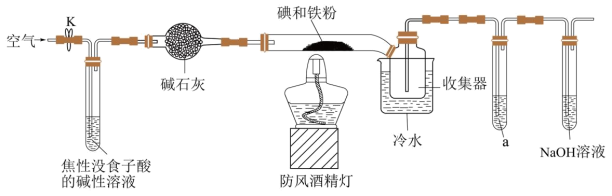
 )
)(1)装置中盛碱石灰的仪器名称为
(2)收集器浸泡在冷水中的原因是
(3)试剂a为
Ⅱ、化学兴趣小组为了探究
 的还原性,进行了如下实验:取一定量的
的还原性,进行了如下实验:取一定量的 溶液,向其中滴加少量新制的氯水,振荡后溶液呈黄色。同学们对溶液变成黄色的原因提出了不同的看法:
溶液,向其中滴加少量新制的氯水,振荡后溶液呈黄色。同学们对溶液变成黄色的原因提出了不同的看法:甲同学认为:是因为被
 氧化成
氧化成 ;乙同学认为:是因为被
;乙同学认为:是因为被 氧化成
氧化成 。
。随后化学兴趣小组进行如下实验进行验证。
| 实验步骤 | 现象 | 结论 |
| ①取少量黄色溶液于试管中,滴加淀粉溶液 | 试管中溶液变蓝色 | 甲同学观点正确 |
②取少量黄色溶液于试管中,滴加 溶液 溶液 | 乙同学观点不正确 |
(4)上述实验②中现象为
 的还原性
的还原性 的还原性(填“
的还原性(填“ ”、“
”、“ ”或“
”或“ ”)。
”)。(5)依据(4)中所得结论,试写出往过量
 溶液中通入少量氯气后所发生反应的离子反应方程式:
溶液中通入少量氯气后所发生反应的离子反应方程式:
您最近一年使用:0次
2024-02-16更新
|
155次组卷
|
3卷引用:湖南省常德市第一中学2023-2024学年高一上学期期末考试化学试题
名校
解题方法
6 . 为了探究元素周期律,设计实验验证卤素单质氧化性的相对强弱,实验如下:
资料:稀溴水呈黄色;浓溴水呈红棕色;碘水呈棕黄色。
(1)a中反应的离子方程式是___________ 。
(2)实验I中b可以得出的氧化性强弱是___________ 。
(3)①甲同学认为:实验Ⅱ观察到___________ 现象,得出氧化性Br2>I2。
②乙同学对上述实验进行反思,认为实验II不能充分证明氧化性Br2>I2,他补做了实验Ⅲ.
补做实验Ⅲ的目的是___________ 。
综合实验I和Ⅲ,得出氧化性Cl2>Br2>I2.由此实验得出的结论:同主族元素从上到下,原子的得电子能力逐渐减弱
资料:稀溴水呈黄色;浓溴水呈红棕色;碘水呈棕黄色。
| 实验I | 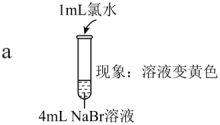 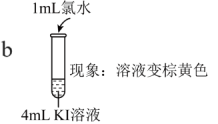 |
| 实验II | 取a中的黄色溶液少许,加入KI溶液,再加入淀粉溶液。 |
(1)a中反应的离子方程式是
(2)实验I中b可以得出的氧化性强弱是
(3)①甲同学认为:实验Ⅱ观察到
②乙同学对上述实验进行反思,认为实验II不能充分证明氧化性Br2>I2,他补做了实验Ⅲ.
| 实验III | 另取a中黄色溶液少许,加入足量NaBr固体,振荡,然后加入KI溶液和淀粉溶液。 |
综合实验I和Ⅲ,得出氧化性Cl2>Br2>I2.由此实验得出的结论:同主族元素从上到下,原子的得电子能力逐渐减弱
您最近一年使用:0次
2024-02-13更新
|
75次组卷
|
2卷引用:宁夏回族自治区石嘴山市第三中学2023-2024学年高一上学期1月期末化学试题
名校
解题方法
7 . 硫氰化钾(KSCN)在有机合成中具有重要应用,但会污染环境。预测浓硝酸能与KSCN反应以消除污染,现通过如下实验进行探究。
已知: 能被氧化为黄色的
能被氧化为黄色的 ,
, 可聚合为红色的
可聚合为红色的 。
。
【实验一】
取2 mL浓硝酸于试管中,向其中滴加5滴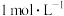 的KSCN溶液,溶液立即变红,静置一段时间后,试管内突然剧烈反应,红色退去,放出大量红棕色气体。
的KSCN溶液,溶液立即变红,静置一段时间后,试管内突然剧烈反应,红色退去,放出大量红棕色气体。
(1)向浓硝酸中滴加KSCN溶液,溶液立即变红是因为生成了______ (填化学式)。KSCN中S元素的化合价为-2,预测剧烈反应后含硫产物可能是______ 。
【实验二】
将实验一放出的气体通入 和NaOH的混合溶液中,有白色沉淀生成。将过滤、洗涤后的白色沉淀置于试管中,加入过量稀硝酸,沉淀完全溶解。
和NaOH的混合溶液中,有白色沉淀生成。将过滤、洗涤后的白色沉淀置于试管中,加入过量稀硝酸,沉淀完全溶解。
(2)该实验证实了红棕色气体中不含SO2,证据是______ ,白色沉淀为______ 。
【实验三】
(3)另取少量实验一最终所得溶液,______ (填操作和现象),证明溶液中含有 。
。
(4)经检验实验一放出的红棕色气体中含NO2,但NO2不一定是 的氧化产物,理由是
的氧化产物,理由是______ 。
【实验四】
(5)某同学向待测溶液中加入KSCN溶液,再加入浓硝酸,最终未得红色溶液,由此得出结论:待测液中不含 。
。
你认为该同学的结论是否正确:______ (填“是”或“否”),理由是______ 。
已知:
 能被氧化为黄色的
能被氧化为黄色的 ,
, 可聚合为红色的
可聚合为红色的 。
。【实验一】
取2 mL浓硝酸于试管中,向其中滴加5滴
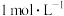 的KSCN溶液,溶液立即变红,静置一段时间后,试管内突然剧烈反应,红色退去,放出大量红棕色气体。
的KSCN溶液,溶液立即变红,静置一段时间后,试管内突然剧烈反应,红色退去,放出大量红棕色气体。(1)向浓硝酸中滴加KSCN溶液,溶液立即变红是因为生成了
【实验二】
将实验一放出的气体通入
 和NaOH的混合溶液中,有白色沉淀生成。将过滤、洗涤后的白色沉淀置于试管中,加入过量稀硝酸,沉淀完全溶解。
和NaOH的混合溶液中,有白色沉淀生成。将过滤、洗涤后的白色沉淀置于试管中,加入过量稀硝酸,沉淀完全溶解。(2)该实验证实了红棕色气体中不含SO2,证据是
【实验三】
(3)另取少量实验一最终所得溶液,
 。
。(4)经检验实验一放出的红棕色气体中含NO2,但NO2不一定是
 的氧化产物,理由是
的氧化产物,理由是【实验四】
(5)某同学向待测溶液中加入KSCN溶液,再加入浓硝酸,最终未得红色溶液,由此得出结论:待测液中不含
 。
。你认为该同学的结论是否正确:
您最近一年使用:0次
2024-02-04更新
|
162次组卷
|
2卷引用:山东省济南市2023-2024学年高一上学期1月期末考试化学试题
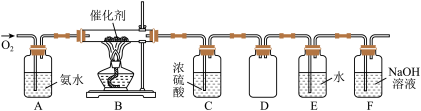
8 . 结合所学知识探究Na2O2与H2能否反应,实验装置设计如下。下列说法正确的是
| A.装置A还可以用于H2O2与MnO2粉末反应制取氧气 |
| B.装置B中盛装浓硫酸,目的是除去装置A中挥发出来的少量水蒸气 |
C.装置 中固体若由淡黄色变为白色,推测最终产物为Na2O 中固体若由淡黄色变为白色,推测最终产物为Na2O |
| D.若装置D中无水硫酸铜变蓝,无法说明Na2O2与H2反应生成水 |
您最近一年使用:0次
2024-02-03更新
|
92次组卷
|
2卷引用:广东省深圳市罗湖区2023-2024学年高一上学期期末考试化学试题
名校
解题方法
9 . 某实验小组用如下实验装置模拟工业上制取硝酸:
(1)控制氧气的流速是制硝酸的关键,该实验可通过观察氨水中_________ 控制氧气的流速。
(2)写出装置B中发生反应的化学方程式:__________________ 。
(3)由于水的比热容较大,A中挥发的水蒸气会影响B中的反应温度,所以在AB之间插入装有_________ 的干燥装置。
A.浓 B.碱石灰 C.
B.碱石灰 C.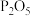
(4)实验后装置 中
中 和
和 物质的量浓度较大的是
物质的量浓度较大的是_________ (填化学名称)。(装置 中发生的主要反应为:
中发生的主要反应为: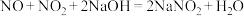 ;
;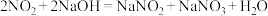 )
)
(5)工业上要获得浓度较大的硝酸,往往在稀硝酸中加入吸水剂硝酸镁,然后在较低温度下进行蒸馏,但不能采用较高温度的原因是___________________ 。
(6)请从环境保护角度设计制备硝酸铜的方案,实验室可提供新制硝酸、Cu粉,写出方案中涉及到的化学方程式___________________ ;___________________ 。

(1)控制氧气的流速是制硝酸的关键,该实验可通过观察氨水中
(2)写出装置B中发生反应的化学方程式:
(3)由于水的比热容较大,A中挥发的水蒸气会影响B中的反应温度,所以在AB之间插入装有
A.浓
 B.碱石灰 C.
B.碱石灰 C.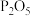
(4)实验后装置
 中
中 和
和 物质的量浓度较大的是
物质的量浓度较大的是 中发生的主要反应为:
中发生的主要反应为: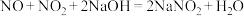 ;
;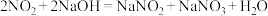 )
)(5)工业上要获得浓度较大的硝酸,往往在稀硝酸中加入吸水剂硝酸镁,然后在较低温度下进行蒸馏,但不能采用较高温度的原因是
(6)请从环境保护角度设计制备硝酸铜的方案,实验室可提供新制硝酸、Cu粉,写出方案中涉及到的化学方程式
您最近一年使用:0次
2024-01-27更新
|
541次组卷
|
2卷引用:湖南省岳阳市岳阳楼区2022-2023学年高一下学期期末考试化学试题
解题方法
10 . 某学习小组对 与
与 的反应进行了研究。
的反应进行了研究。___________ 。
(2)利用如图装置完成 与
与 制取氮氧化物的反应。实验过程中可观察到装置B中液面上方为无色气体,C中液面上方为红棕色气体。
制取氮氧化物的反应。实验过程中可观察到装置B中液面上方为无色气体,C中液面上方为红棕色气体。
①为排尽整套装置内的空气,先打开弹簧夹,通入_______ (填化学式),一段时间后关闭弹簧夹。
②C中液面上方为红棕色气体,其原因是________ (用化学方程式表示)。
(3)学习小组在做铜与硝酸反应的实验时观察到了以下现象:实验Ⅰ中蓝色溶液A遇铜片立即产生气泡,而相同条件下实验Ⅱ中 硝酸遇铜片短时间内无明显变化,一段时间后才有少量气泡产生。实验操作如下:
硝酸遇铜片短时间内无明显变化,一段时间后才有少量气泡产生。实验操作如下:
①假设1:___________ (填化学式)对该反应有催化作用。
实验验证:向 硝酸中加入少量硝酸铜固体,溶液呈蓝色,放入铜片,无明显变化。
硝酸中加入少量硝酸铜固体,溶液呈蓝色,放入铜片,无明显变化。
结论:假设1不成立。
②假设2: 对该反应有催化作用。
对该反应有催化作用。
向A中鼓入 数分钟得溶液C,相同条件下,铜片与A、C溶液的反应速率:
数分钟得溶液C,相同条件下,铜片与A、C溶液的反应速率: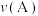
______ 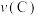 (填“
(填“ ”“
”“ ”“
”“ ”)。实验证明假设2成立。
”)。实验证明假设2成立。
③经检验,蓝色溶液A中还含有少量亚硝酸 。
。
设计实验证明 也对该反应有催化作用。操作和预期的现象是:
也对该反应有催化作用。操作和预期的现象是:___________ 。向含有铜片的溶液B中___________ 。
实验总结: 和
和 对铜与硝酸的反应都有催化作用。
对铜与硝酸的反应都有催化作用。
(4)请推测 与浓硝酸反应中
与浓硝酸反应中 和
和 参与的可能的催化过程:
参与的可能的催化过程:
①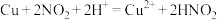 ②
②___________ 。
 与
与 的反应进行了研究。
的反应进行了研究。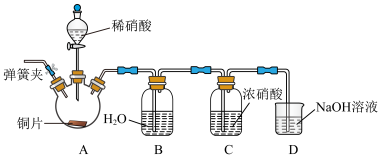
(2)利用如图装置完成
 与
与 制取氮氧化物的反应。实验过程中可观察到装置B中液面上方为无色气体,C中液面上方为红棕色气体。
制取氮氧化物的反应。实验过程中可观察到装置B中液面上方为无色气体,C中液面上方为红棕色气体。①为排尽整套装置内的空气,先打开弹簧夹,通入
②C中液面上方为红棕色气体,其原因是
(3)学习小组在做铜与硝酸反应的实验时观察到了以下现象:实验Ⅰ中蓝色溶液A遇铜片立即产生气泡,而相同条件下实验Ⅱ中
 硝酸遇铜片短时间内无明显变化,一段时间后才有少量气泡产生。实验操作如下:
硝酸遇铜片短时间内无明显变化,一段时间后才有少量气泡产生。实验操作如下:实验Ⅰ: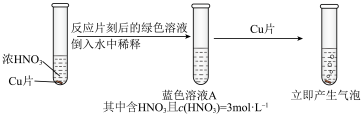
实验Ⅱ: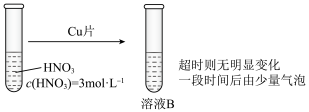
①假设1:
实验验证:向
 硝酸中加入少量硝酸铜固体,溶液呈蓝色,放入铜片,无明显变化。
硝酸中加入少量硝酸铜固体,溶液呈蓝色,放入铜片,无明显变化。结论:假设1不成立。
②假设2:
 对该反应有催化作用。
对该反应有催化作用。向A中鼓入
 数分钟得溶液C,相同条件下,铜片与A、C溶液的反应速率:
数分钟得溶液C,相同条件下,铜片与A、C溶液的反应速率: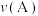
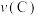 (填“
(填“ ”“
”“ ”“
”“ ”)。实验证明假设2成立。
”)。实验证明假设2成立。③经检验,蓝色溶液A中还含有少量亚硝酸
 。
。设计实验证明
 也对该反应有催化作用。操作和预期的现象是:
也对该反应有催化作用。操作和预期的现象是:实验总结:
 和
和 对铜与硝酸的反应都有催化作用。
对铜与硝酸的反应都有催化作用。(4)请推测
 与浓硝酸反应中
与浓硝酸反应中 和
和 参与的可能的催化过程:
参与的可能的催化过程:①
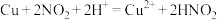 ②
②
您最近一年使用:0次



