名校
解题方法
1 . 节日期间因燃放鞭炮会引起空气中SO2含量增大,造成大气污染。某实验小组同学欲探究SO2的性质并测定空气中SO2的含量。
(1)他们设计如下实验装置,请你参与探究,并回答下列问题:
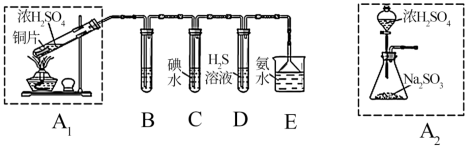
①装置A1中发生反应的化学方程式为_______ ;
②装置B用于SO2检验的漂白性,其中所盛试剂为_______ ,装置D中发生反应的化学方程式为_______ ,说明SO2具有_______ 性;
③C中发生的离子方程式为:_______ ;
④为了实现绿色环保的目标,甲同学欲用装置A2代替装置A1你认为装置A2的优点是_______ 。
(2)拟用以下两装置测定空气中SO2含量(忽略空气中其他还原性气体的干扰)。

①通过讨论,不能采用装置b,其原因是_____________ ;
②若通入V L(标准状况下)空气(M=29g/mol),恰好与145 mL0.25 mol/L酸性高锰酸钾溶液完全反应,则空气中SO2的质量分数为_______ %。(写出含V的表达式)
(1)他们设计如下实验装置,请你参与探究,并回答下列问题:

①装置A1中发生反应的化学方程式为
②装置B用于SO2检验的漂白性,其中所盛试剂为
③C中发生的离子方程式为:
④为了实现绿色环保的目标,甲同学欲用装置A2代替装置A1你认为装置A2的优点是
(2)拟用以下两装置测定空气中SO2含量(忽略空气中其他还原性气体的干扰)。

①通过讨论,不能采用装置b,其原因是
②若通入V L(标准状况下)空气(M=29g/mol),恰好与145 mL0.25 mol/L酸性高锰酸钾溶液完全反应,则空气中SO2的质量分数为
您最近一年使用:0次
解题方法
2 . 在众多的化学反应现象中,化学振荡现象最为令人惊奇,化学振荡实验很多,其中酸与铁丝的反应就是其中一例。某合作小组的同学查阅文献资料后,拟做铁丝与酸的化学振荡实验并进行探究。
实验步骤:
①将2 cm左右的铁丝夹成多段,放在培养皿中,先用热的碳酸钠溶液除去铁丝表面的油污,用蒸馏水冲洗后,再用某种试剂X浸泡到有大量气泡时取出,用蒸馏水冲洗干净。
②在细口瓶中加入30 mL 1.0 mol·L-1的H2SO4、3 mL 30%的H2O2溶液,将处理后的铁丝放入其中。
③观察现象:铁丝表面产生气泡,随后消失,再产生气泡,再消失的周而往复的化学振荡现象出现,振荡周期约20秒,可维持数小时。
试回答下列问题:
(1)步骤①中,用试剂X可除去铁钉表面的铁的氧化物或镀层,所用的试剂X可能是___________ (填序号)。
A.NaOH B.盐酸 C.酒精
(2)对振荡中产生的气体的成分,甲、乙两同学分别提出了假设,丙同学进行了验证。
甲同学认为是H2,其可能的理由是_______________________________________________ 。
乙同学认为是O2,其可能的理由是______________________________________________ 。
丙同学在细口瓶中插入数据采集器氧气传感器,密封进行实验一小时,结果发现瓶中氧气的百分含量呈现逐渐减小的趋势,从而证明产生的气体是_________________ 。
(3)丁同学猜想酸与铁丝振荡体系中的反应机理及过程:
(a)Fe+2H+=Fe2++H2
(b)2Fe2++H2O2+H2O=Fe2O3+4H+
(c)Fe2O3+6H+=2Fe3++3H2O
(d)2Fe3++H2=2Fe2++2H+
依据过程:(a)→(b)→(c)→(d)→(a)…周而复始。
依据此机理,四步反应总的反应方程式为________________________________________ 。
(4)戊同学对本次实验中的所用铁钉中单质铁的含量进行测定,他们先配制一定物质的量浓度的硫酸,然后将一定质量的铁与硫酸(加入适量的铜粉)充分反应,并收集产生的气体,有关数据如下表:
所配硫酸的物质的量浓度为________ mol·L-1;铁钉中单质铁的质量分数为____________ 。
实验步骤:
①将2 cm左右的铁丝夹成多段,放在培养皿中,先用热的碳酸钠溶液除去铁丝表面的油污,用蒸馏水冲洗后,再用某种试剂X浸泡到有大量气泡时取出,用蒸馏水冲洗干净。
②在细口瓶中加入30 mL 1.0 mol·L-1的H2SO4、3 mL 30%的H2O2溶液,将处理后的铁丝放入其中。
③观察现象:铁丝表面产生气泡,随后消失,再产生气泡,再消失的周而往复的化学振荡现象出现,振荡周期约20秒,可维持数小时。
试回答下列问题:
(1)步骤①中,用试剂X可除去铁钉表面的铁的氧化物或镀层,所用的试剂X可能是
A.NaOH B.盐酸 C.酒精
(2)对振荡中产生的气体的成分,甲、乙两同学分别提出了假设,丙同学进行了验证。
甲同学认为是H2,其可能的理由是
乙同学认为是O2,其可能的理由是
丙同学在细口瓶中插入数据采集器氧气传感器,密封进行实验一小时,结果发现瓶中氧气的百分含量呈现逐渐减小的趋势,从而证明产生的气体是
(3)丁同学猜想酸与铁丝振荡体系中的反应机理及过程:
(a)Fe+2H+=Fe2++H2
(b)2Fe2++H2O2+H2O=Fe2O3+4H+
(c)Fe2O3+6H+=2Fe3++3H2O
(d)2Fe3++H2=2Fe2++2H+
依据过程:(a)→(b)→(c)→(d)→(a)…周而复始。
依据此机理,四步反应总的反应方程式为
(4)戊同学对本次实验中的所用铁钉中单质铁的含量进行测定,他们先配制一定物质的量浓度的硫酸,然后将一定质量的铁与硫酸(加入适量的铜粉)充分反应,并收集产生的气体,有关数据如下表:
| ① | ② | ③ | |
| 硫酸溶液体积/mL | 50 | 50 | 50 |
| 称取铁钉质量/g | 5.0 | 6.0 | 7.0 |
| 两投入铜粉质量/g | 1.0 | 1.0 | 1.0 |
| 标准状况下的体积/L | 1.97 | 2.24 | 2.24 |
所配硫酸的物质的量浓度为
您最近一年使用:0次
2020-09-22更新
|
105次组卷
|
2卷引用:内蒙古自治区呼和浩特市和林格尔县第一中学2018-2019学年高二上学期第一次月考化学试题
3 . 茶垢清洁剂的主要成分是过碳酸钠(Na2CO3∙3H2O2)。过碳酸钠兼具Na2CO3和H2O2的性质,能溶于水,热水溶解后,能迅速放出活性气体,快速清洁茶具上附着的茶垢。某化学实验小组进行了下列实验。请回答下列问题:
I.探究过碱酸钠与热水反应生成的气体成分:
实验1:向盛有茶垢清洁剂的试管中加入少量热水并将试管加热竹80℃,将试管中生成的气体通入澄清石灰水中,无明显现象。
实验2:向盛有茶垢清洁剂的试管中加入少量热水并将试管加热至80℃,……
实验结论:碳酸钠与热水反应生成的气体为O2。
(1)实验1和实验2中适宜的加热方式为水浴加热,与用酒精灯直接加热相比,采用水浴加热的优点为____ (答一条)。
(2)请补全实验2中能证明生成气体为O2的实验操作和现象:___ 。
II.测定茶垢清洁剂中的过碳酸钠含量
实验3:排水量气法测定过碳酸钠含量:按下图连接好实验装置并放入药品,打开分液漏斗活塞,使水滴入锥形瓶中,一段时间后,关闭活塞,读取生成气体的体积。
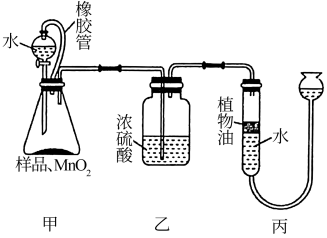
(3)实验3中装置甲中橡胶管的作用为___ 。若实验结束后测得反应生成气体的体积为VL,若加入样品质量为mg,O2的在该实验条件下的密度为dg/L,则计算得到茶垢清洁剂中的过碳酸钠的质量分数为__ (结果用含m、d、V的式子表示)。
III.探究过碳酸钠的制备过程中合适的原料配比
实验4:10℃时,将4份等量的饱和 溶液和质量分数均为27.5%的
溶液和质量分数均为27.5%的 溶液按不同配比混合,发生反应
溶液按不同配比混合,发生反应 。反应时间为
。反应时间为 ,测得原料配比对过碳酸钠的产率和溶液中活性氧的含量的关系如下表所示。
,测得原料配比对过碳酸钠的产率和溶液中活性氧的含量的关系如下表所示。
(4)由题给数据可知实验4中 和
和 较合适的物质的量之比为
较合适的物质的量之比为_ ,当原料配比增至1.8∶l时,过碳酸钠的产率下降的原因为_ 。
I.探究过碱酸钠与热水反应生成的气体成分:
实验1:向盛有茶垢清洁剂的试管中加入少量热水并将试管加热竹80℃,将试管中生成的气体通入澄清石灰水中,无明显现象。
实验2:向盛有茶垢清洁剂的试管中加入少量热水并将试管加热至80℃,……
实验结论:碳酸钠与热水反应生成的气体为O2。
(1)实验1和实验2中适宜的加热方式为水浴加热,与用酒精灯直接加热相比,采用水浴加热的优点为
(2)请补全实验2中能证明生成气体为O2的实验操作和现象:
II.测定茶垢清洁剂中的过碳酸钠含量
实验3:排水量气法测定过碳酸钠含量:按下图连接好实验装置并放入药品,打开分液漏斗活塞,使水滴入锥形瓶中,一段时间后,关闭活塞,读取生成气体的体积。

(3)实验3中装置甲中橡胶管的作用为
III.探究过碳酸钠的制备过程中合适的原料配比
实验4:10℃时,将4份等量的饱和
 溶液和质量分数均为27.5%的
溶液和质量分数均为27.5%的 溶液按不同配比混合,发生反应
溶液按不同配比混合,发生反应 。反应时间为
。反应时间为 ,测得原料配比对过碳酸钠的产率和溶液中活性氧的含量的关系如下表所示。
,测得原料配比对过碳酸钠的产率和溶液中活性氧的含量的关系如下表所示。| 过氧化氢与碳酸钠的物质的量比 | 过碳酸钠的产率/% | 活性氧的含量/% |
| 1.8∶l | 78.91 | 12.70 |
| 1.7∶1 | 81.08 | 12.71 |
| 1.6∶1 | 79.53 | 12.67 |
| 1.5∶1 | 76.02 | 12.68 |
 和
和 较合适的物质的量之比为
较合适的物质的量之比为
您最近一年使用:0次
名校
解题方法
4 . 某研究性学习小组探究FeSO4的化学性质并测定某药片中FeSO4的含量,回答下列问题。
(1)探究FeSO4溶液的酸碱性。实验测得FeSO4溶液呈______ (填“酸性”、“中性”、“碱性”),原因为______ (用离子方程式表示)。
(2)利用如图装置探究FeSO4的稳定性。
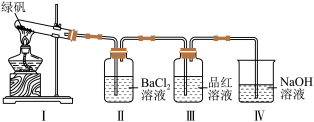
已知:绿矾为FeSO4·7H2O晶体,受热分解产物为4种氧化物。
①实验中观察到Ⅰ中固体逐渐变为红棕色,Ⅱ中有白色沉淀生成。Ⅱ中现象表明绿矾分解产物有_____________ (填化学式)。
②预测Ⅲ中现象为_________ ,设计实验证明Ⅲ中现象有可逆性,操作和现象为:取少量Ⅲ中溶液于试管中,___________ 。
③Ⅳ中NaOH溶液的作用是吸收尾气,防止污染空气。反应的化学方程式为_____ 。
(3)缺铁性贫血往往口服主要成分为FeSO4的药片。现用氧化还原滴定法测定某品牌药片中FeSO4含量,反应原理为:MnO + 5Fe2+ + 8H+ = Mn2+ + 5Fe3+ + 4H2O。称取8.0g药片,剥掉表面糖衣,将药片捣碎,配成100mL溶液,用KMnO4溶液滴定。
+ 5Fe2+ + 8H+ = Mn2+ + 5Fe3+ + 4H2O。称取8.0g药片,剥掉表面糖衣,将药片捣碎,配成100mL溶液,用KMnO4溶液滴定。
该药片中FeSO4的质量分数为______ ,若盛装KMnO4溶液的滴定管用蒸馏水洗净后没有润洗,则测定结果将______ 。(填“偏大”、“偏小”、“不变”)。
(1)探究FeSO4溶液的酸碱性。实验测得FeSO4溶液呈
(2)利用如图装置探究FeSO4的稳定性。

已知:绿矾为FeSO4·7H2O晶体,受热分解产物为4种氧化物。
①实验中观察到Ⅰ中固体逐渐变为红棕色,Ⅱ中有白色沉淀生成。Ⅱ中现象表明绿矾分解产物有
②预测Ⅲ中现象为
③Ⅳ中NaOH溶液的作用是吸收尾气,防止污染空气。反应的化学方程式为
(3)缺铁性贫血往往口服主要成分为FeSO4的药片。现用氧化还原滴定法测定某品牌药片中FeSO4含量,反应原理为:MnO
 + 5Fe2+ + 8H+ = Mn2+ + 5Fe3+ + 4H2O。称取8.0g药片,剥掉表面糖衣,将药片捣碎,配成100mL溶液,用KMnO4溶液滴定。
+ 5Fe2+ + 8H+ = Mn2+ + 5Fe3+ + 4H2O。称取8.0g药片,剥掉表面糖衣,将药片捣碎,配成100mL溶液,用KMnO4溶液滴定。| 滴定次数 | 待测FeSO4溶液体积/mL | 0.1000 mol/LKMnO4溶液体积/mL | |
| 滴定前刻度 | 滴定后刻度 | ||
| 1 | 25.00 | 0.00 | 25.11 |
| 2 | 25.00 | 0.56 | 30.56 |
| 3 | 25.00 | 0.22 | 25.11 |
您最近一年使用:0次
2020-11-14更新
|
185次组卷
|
2卷引用:广东省广州市第八十九中学2020-2021学年高二上学期期中考试化学试题
名校
解题方法
5 . 过氧化尿素的化学式为CO(NH2)2•H2O2,是过氧化氢和尿素的加合物,外观为白色针状晶体,无毒无味,热分解温度为 45℃,易溶于水和乙醇,熔点 75-85℃,其水溶液兼有尿素和过氧化氢的性质,具有活性氧含量高、稳定性好等特点,被广泛用于医药、纺织领域。已知尿素与KMnO4溶液、NaOH 溶液都不反应。
I.合成过氧化尿素的流程及反应器的示意图如下:
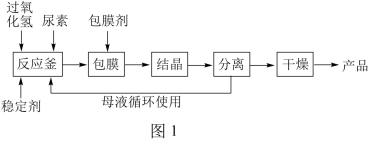
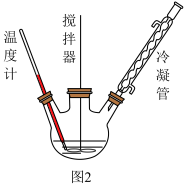
回答下列问题:
(1)图1中分离操作的名称为_______ ,图 2 中反应器的名称是 _______ ;
(2)过氧化尿素是尿素分子与过氧化氢分子之间通过_________ (填字母)结合形成的。
A.氢键 B.共价键 C.离子键 D.化学键
反应器中发生反应的化学方程式为____________ 。
(3)工业生产中,除向反应釜中投料反应物过氧化氢、工业尿素(含少量杂质铁、铜等离子)外,添加稳定剂可以提高产品的稳定性。不加稳定剂导致产品稳定率差的原因是__ 。
(4)活性氧含量的高低直接决定产品的质量,合格产品中活性氧的含量≥16%(相当于其中含H2O234%)。为了确定所得产品合格与否,质检员称取干燥样品 2.500g,溶解于水,在250mL 容量瓶中定容,准确量取其中 25.00mL 溶液于锥形瓶中,加入1mL6mol/LH2SO4,然后用0.1000mol/L KMnO4标准溶液滴定样品中的H2O2,三次滴定平均消耗KMnO4溶液 8.000mL。
①达到滴定终点的现象是____________ 。
②根据滴定结果确定产品质量_ (填“合格”或“不合格”),活性氧的质量分数为___ 。
II.过氧化尿素的性质探究:
(5)过氧化尿素的催化分解实验:在试管中加入 0.1g 产品、少量水及二氧化锰,用火柴余烬检验生成气体,可观察到火柴复燃。实验中加入二氧化锰的量一定要少(固体控制在小米粒大小)的原因是:_________ 。
(6)测定过氧化尿素溶液的酸碱性:在试管中加入1mL 6mol/L NaOH溶液、1mL过氧化尿素溶液和 2mL无水乙醇,振荡试管。测得pH约为6,并观察到有白色的胶状沉淀生成,该沉淀为生成的NaHO2在乙醇中析出。写出该反应的化学方程式:___
I.合成过氧化尿素的流程及反应器的示意图如下:


回答下列问题:
(1)图1中分离操作的名称为
(2)过氧化尿素是尿素分子与过氧化氢分子之间通过
A.氢键 B.共价键 C.离子键 D.化学键
反应器中发生反应的化学方程式为
(3)工业生产中,除向反应釜中投料反应物过氧化氢、工业尿素(含少量杂质铁、铜等离子)外,添加稳定剂可以提高产品的稳定性。不加稳定剂导致产品稳定率差的原因是
(4)活性氧含量的高低直接决定产品的质量,合格产品中活性氧的含量≥16%(相当于其中含H2O234%)。为了确定所得产品合格与否,质检员称取干燥样品 2.500g,溶解于水,在250mL 容量瓶中定容,准确量取其中 25.00mL 溶液于锥形瓶中,加入1mL6mol/LH2SO4,然后用0.1000mol/L KMnO4标准溶液滴定样品中的H2O2,三次滴定平均消耗KMnO4溶液 8.000mL。
①达到滴定终点的现象是
②根据滴定结果确定产品质量
II.过氧化尿素的性质探究:
(5)过氧化尿素的催化分解实验:在试管中加入 0.1g 产品、少量水及二氧化锰,用火柴余烬检验生成气体,可观察到火柴复燃。实验中加入二氧化锰的量一定要少(固体控制在小米粒大小)的原因是:
(6)测定过氧化尿素溶液的酸碱性:在试管中加入1mL 6mol/L NaOH溶液、1mL过氧化尿素溶液和 2mL无水乙醇,振荡试管。测得pH约为6,并观察到有白色的胶状沉淀生成,该沉淀为生成的NaHO2在乙醇中析出。写出该反应的化学方程式:
您最近一年使用:0次
名校
解题方法
6 . 某化学课外活动小组通过实验探究NO能否与Na2O2反应以及反应后的产物,该活动小组同学设计了如图所示装置(夹持仪器、连接用的乳胶管均已省略)。
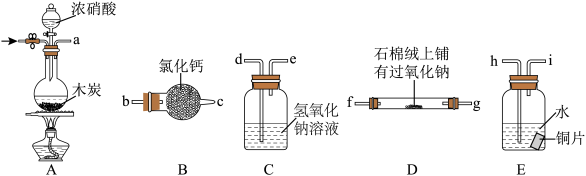
经查阅资料知:①NO是不成盐氧化物;②2NO2+2NaOH =NaNO3+NaNO2+H2O。
回答下列问题:
(1)写出木炭与浓硝酸反应的化学方程式:__________________________________ 。
(2)为了完成实验,同学甲选择上图中的装置,其连接顺序为a→h→i→d→e→b→c→f;但有同学乙认为该装置存在两处缺陷,则该缺陷是______________ 、______________ 。
(3)按改进后的方案连接,检验装置的气密性,装入药品后,要通入一段时间的氮气,再滴入浓硝酸,点燃酒精灯,通入氮气的主要目的是_________________________________ 。
(4)如果将连接顺序h→i→d→e改为d→e→h→i,会产生怎样的后果,请简述__________________________________________________________________ 。
(5)已知NO与Na2O2反应的产物为NaNO3和NaNO2的混合物,为了测定产物中NaNO2含量,该小组同学准确称取反应后的固体3.50g,用煮沸并冷却后的蒸馏水配成100.00mL溶液,取10.00mL溶液于锥形瓶中,用0.1000mol·L-1KMnO4溶液(硫酸酸化)滴定,共消耗KMnO4溶液20mL。滴定过程中发生反应的离子方程式为_______________________ ,反应产物中NaNO2的质量分数为___________ (保留四位有效数字)

经查阅资料知:①NO是不成盐氧化物;②2NO2+2NaOH =NaNO3+NaNO2+H2O。
回答下列问题:
(1)写出木炭与浓硝酸反应的化学方程式:
(2)为了完成实验,同学甲选择上图中的装置,其连接顺序为a→h→i→d→e→b→c→f;但有同学乙认为该装置存在两处缺陷,则该缺陷是
(3)按改进后的方案连接,检验装置的气密性,装入药品后,要通入一段时间的氮气,再滴入浓硝酸,点燃酒精灯,通入氮气的主要目的是
(4)如果将连接顺序h→i→d→e改为d→e→h→i,会产生怎样的后果,请简述
(5)已知NO与Na2O2反应的产物为NaNO3和NaNO2的混合物,为了测定产物中NaNO2含量,该小组同学准确称取反应后的固体3.50g,用煮沸并冷却后的蒸馏水配成100.00mL溶液,取10.00mL溶液于锥形瓶中,用0.1000mol·L-1KMnO4溶液(硫酸酸化)滴定,共消耗KMnO4溶液20mL。滴定过程中发生反应的离子方程式为
您最近一年使用:0次
名校
解题方法
7 . 某研究小组设计如下所示实验装置(夹持装置已略去)分别探究NO与铜粉、Na2O2的反应。
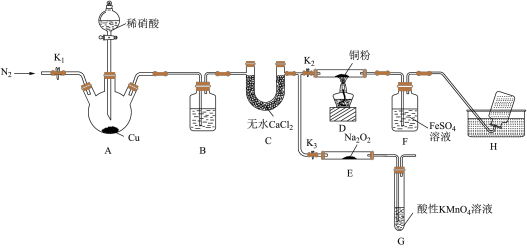
已知:①NO与Na2O2可发生反应2NO+Na2O2===2NaNO2。
②NO能被酸性高锰酸钾溶液氧化为NO3-
③在溶液中存在平衡FeSO4+NO Fe(NO)SO4(棕色)
Fe(NO)SO4(棕色)
I.关闭K3,打开K2,探究NO与铜粉的反应并检验NO。
(1)反应开始前,打开K1,通入一段时间N2,其目的是______________________ 。
(2)装置B中盛放的试剂为水,其作用是______________________ 。
(3)装置F中的实验现象为___________ 。装置H中收集的气体为___________ (填化学式)。
Ⅱ.关闭K2,打开K3,探究NO与Na2O2的反应并制备NaNO2。
(4)装置G的作用是______________________ 。
(5)若省略装置C,则进入装置G中的气体除N2、NO外,可能还有___________ (填化学式)。
(6)测定反应后装置E中NaNO2的含量。已知;在酸性条件下,NO2-可将MnO4-还原为Mn2+,为测定样品中亚硝酸钠的含量,该小组同学称取ag样品溶于水配制成250mL溶液,取25.00mL所得溶液于锥形瓶中,用0.100mol·L-1的酸性KMnO4溶液滴定至终点时,消耗bmL酸性KMnO4溶液。
①滴定过程中发生反应的离子方程式为______________________ 。
②滴定过程中酸性KMnO4溶液的作用是___________ 。
③样品中NaNO2的质量分数为___________ 用含有a、b的代数式表示)

已知:①NO与Na2O2可发生反应2NO+Na2O2===2NaNO2。
②NO能被酸性高锰酸钾溶液氧化为NO3-
③在溶液中存在平衡FeSO4+NO
 Fe(NO)SO4(棕色)
Fe(NO)SO4(棕色)I.关闭K3,打开K2,探究NO与铜粉的反应并检验NO。
(1)反应开始前,打开K1,通入一段时间N2,其目的是
(2)装置B中盛放的试剂为水,其作用是
(3)装置F中的实验现象为
Ⅱ.关闭K2,打开K3,探究NO与Na2O2的反应并制备NaNO2。
(4)装置G的作用是
(5)若省略装置C,则进入装置G中的气体除N2、NO外,可能还有
(6)测定反应后装置E中NaNO2的含量。已知;在酸性条件下,NO2-可将MnO4-还原为Mn2+,为测定样品中亚硝酸钠的含量,该小组同学称取ag样品溶于水配制成250mL溶液,取25.00mL所得溶液于锥形瓶中,用0.100mol·L-1的酸性KMnO4溶液滴定至终点时,消耗bmL酸性KMnO4溶液。
①滴定过程中发生反应的离子方程式为
②滴定过程中酸性KMnO4溶液的作用是
③样品中NaNO2的质量分数为
您最近一年使用:0次
名校
8 . 清远市某校的化学兴趣小组经常做探究实验:
(一)为了探究一氧化氮能否被Na2O2完全吸收,设计了如下实验。装置如下(加热装置省略):
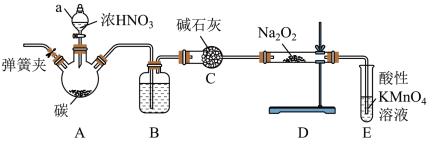
查阅资料所知:①2NO+Na2O2=2NaNO2;②酸性条件下,NO或NO2都能与KMnO4溶液反应生成 。回答下列问题:
。回答下列问题:
(1)仪器a名称:____________ 。
(2)B瓶内装的物质是:_________ 。
(3)若NO能被Na2O2完全吸收,E装置中的现象为__________________ 。
(4)三颈烧瓶A中反应的化学方程式为______________________ 。
(5)C装置的作用是_________________________ 。
(二)实验室常用Na2SO3固体与浓硫酸反应制取SO2
(6)某同学测定部分变质的Na2SO3样品中Na2SO3的含量(已知在酸性条件下 能将
能将 氧化为
氧化为 ,自身还原为I-):
,自身还原为I-):
①用电子天平称取16.00gNa2SO3固体配成l00mL溶液,取25.00mL于锥形瓶中,并加入几滴淀粉溶液。
②用0.1000mol/L酸性KIO3溶液(硫酸酸化)滴定,三次平行实验所用标准液体积的平均值为24.00mL。则滴定终点时锥形瓶中产生的现象______________ ,写出与产生终点现象有关反应的离子方程式__________ ,样品中Na2SO3的质量分数为_________ 。(计算结果保留四位有效数字)
(一)为了探究一氧化氮能否被Na2O2完全吸收,设计了如下实验。装置如下(加热装置省略):

查阅资料所知:①2NO+Na2O2=2NaNO2;②酸性条件下,NO或NO2都能与KMnO4溶液反应生成
 。回答下列问题:
。回答下列问题:(1)仪器a名称:
(2)B瓶内装的物质是:
(3)若NO能被Na2O2完全吸收,E装置中的现象为
(4)三颈烧瓶A中反应的化学方程式为
(5)C装置的作用是
(二)实验室常用Na2SO3固体与浓硫酸反应制取SO2
(6)某同学测定部分变质的Na2SO3样品中Na2SO3的含量(已知在酸性条件下
 能将
能将 氧化为
氧化为 ,自身还原为I-):
,自身还原为I-):①用电子天平称取16.00gNa2SO3固体配成l00mL溶液,取25.00mL于锥形瓶中,并加入几滴淀粉溶液。
②用0.1000mol/L酸性KIO3溶液(硫酸酸化)滴定,三次平行实验所用标准液体积的平均值为24.00mL。则滴定终点时锥形瓶中产生的现象
您最近一年使用:0次
2019-03-08更新
|
323次组卷
|
2卷引用:四川省江油中学2019届高三下学期第一次月考理科综合化学试题
真题
名校
9 . 化学兴趣小组对某品牌牙膏中的摩擦剂成分及其含量进行以下探究:查得资料:该牙膏摩擦剂由碳酸钙、氢氧化铝组成;牙膏中其它成分遇到盐酸时无气体产生。
Ⅰ.摩擦剂中氢氧化铝的定性检验
取适量牙膏样品,加水充足搅拌、过滤。
(1)往滤渣中加入过量 NaOH溶液,过滤。氢氧化铝与NaOH溶液反应的离子方程式是_______ 。
(2)往(1)所得滤液中先通入过量二氧化碳,再加入过量稀盐酸。观察的现象是______ 。
Ⅱ.牙膏样品中碳酸钙的定量测定
利用下图所示装置(图中夹持仪器略去)进行实验,充分反应后,测定C中生成的BaCO 沉淀质量,以确定碳酸钙的质量分数。
沉淀质量,以确定碳酸钙的质量分数。
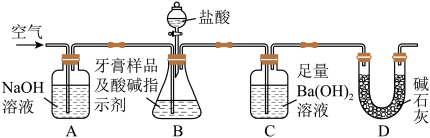
依据实验过程回答下列问题:
(3)实验过程中需持续缓缓通入空气。其作用除了可搅拌B、C中的反应物外,还有:________
(4)C中反应生成BaCO3的化学方程式是__________________ 。
(5)下列各项措施中,不能提高测定准确度的是_________ (填标号)。
a.在加入盐酸之前,应排净装置内的CO2气体
b.滴加盐酸不宜过快
c.在A-B之间增添盛有浓硫酸的洗气装置
d.在B-C之间增添盛有饱和碳酸氢钠溶液的洗气装置
(6)实验中准确称取8.00 g样品三份,进行三次测定,测得BaCO3平均质量为3.94 g。则样品中碳酸钙的质量分数为__________ 。
(7)有人认为不必测定C中生成的BaCO3质量,只要测定装置C在吸收CO2前后的质量差,一样可以确定碳酸钙的质量分数。实验证明按此方法测定的结果明显偏高,原因是______ .
Ⅰ.摩擦剂中氢氧化铝的定性检验
取适量牙膏样品,加水充足搅拌、过滤。
(1)往滤渣中加入过量 NaOH溶液,过滤。氢氧化铝与NaOH溶液反应的离子方程式是
(2)往(1)所得滤液中先通入过量二氧化碳,再加入过量稀盐酸。观察的现象是
Ⅱ.牙膏样品中碳酸钙的定量测定
利用下图所示装置(图中夹持仪器略去)进行实验,充分反应后,测定C中生成的BaCO
 沉淀质量,以确定碳酸钙的质量分数。
沉淀质量,以确定碳酸钙的质量分数。
依据实验过程回答下列问题:
(3)实验过程中需持续缓缓通入空气。其作用除了可搅拌B、C中的反应物外,还有:
(4)C中反应生成BaCO3的化学方程式是
(5)下列各项措施中,不能提高测定准确度的是
a.在加入盐酸之前,应排净装置内的CO2气体
b.滴加盐酸不宜过快
c.在A-B之间增添盛有浓硫酸的洗气装置
d.在B-C之间增添盛有饱和碳酸氢钠溶液的洗气装置
(6)实验中准确称取8.00 g样品三份,进行三次测定,测得BaCO3平均质量为3.94 g。则样品中碳酸钙的质量分数为
(7)有人认为不必测定C中生成的BaCO3质量,只要测定装置C在吸收CO2前后的质量差,一样可以确定碳酸钙的质量分数。实验证明按此方法测定的结果明显偏高,原因是
您最近一年使用:0次
2019-01-30更新
|
1322次组卷
|
11卷引用:2011年普通高等学校招生全国统一考试化学卷(福建)
2011年普通高等学校招生全国统一考试化学卷(福建)(已下线)2012届山西省康杰中学高三9月份月考化学试卷(已下线)2013-2014湖南省衡南县高二下学期期末考试化学试卷2017届西藏自治区拉萨中学高三上第一次月考化学卷【全国百强校】宁夏回族自治区银川一中2019届高三第二次月考理综化学试题新疆克拉玛依市第十三中学2018-2019学年高一上学期第二次月考化学试题(已下线)解密12 实验化学(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(浙江专版)浙江省诸暨市第二高级中学2020-2021学年高二下学期期中考试化学试题江西省九校2021-2022学年高三上学期期中联考化学试题(已下线)解密13 实验化学(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(浙江专用)河南省名校联盟2021-2022学年高三上学期第三次诊断考试化学试题
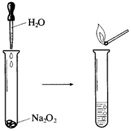
10 . Na2O2具有强氧化性,可以用来漂白纺织类物品、麦秆、纤维等。
(1)如下图所示实验,反应的化学方程式为_______________ 。实验结束后,向试管所得溶液中滴加酚酞溶液,现象是___________________________ 。
(2)若用嘴通过导管向附着少量Na2O2粉末的棉花吹气,棉花燃烧。原因是Na2O2与H2O和CO2反应,其中与CO2反应的化学方程式为______________________ 。若标准状况下反应生成了5.6LO2,则转移电子的物质的量为______ mol。
过氧化钙(CaO2)是一种白色、无毒、难溶于水的固体,能杀菌消毒,广泛用于果蔬保鲜、空气净化、污水处理等方面。工业生产过程如下:
①在NH4Cl溶液中加入Ca(OH)2;
②在第①步的生成的产物中加入30%H2O2,反应生成CaO2•8H2O沉淀;
③经过陈化、过滤,水洗得到CaO2•8H2O,再脱水干燥得到CaO2。
完成下列填空:
(3)第①步反应的化学方程式为_____________________ 。
(4)生产中可循环使用的物质是_____________________ 。
(5)检验CaO2•8H2O是否洗净的方法是___________ 。
(6)已知CaO2在350℃迅速分解生成CaO和O2。如图是实验室测定产品中CaO2含量的装置(夹持装置省略)。

若所取产品质量是m g,测得气体体积为V mL(标况),产品中CaO2的质量分数为________ (用字母表示)。过氧化钙的含量也可用重量法测定,需要测定的物理量有______________________ 。
(1)如下图所示实验,反应的化学方程式为

(2)若用嘴通过导管向附着少量Na2O2粉末的棉花吹气,棉花燃烧。原因是Na2O2与H2O和CO2反应,其中与CO2反应的化学方程式为
过氧化钙(CaO2)是一种白色、无毒、难溶于水的固体,能杀菌消毒,广泛用于果蔬保鲜、空气净化、污水处理等方面。工业生产过程如下:
①在NH4Cl溶液中加入Ca(OH)2;
②在第①步的生成的产物中加入30%H2O2,反应生成CaO2•8H2O沉淀;
③经过陈化、过滤,水洗得到CaO2•8H2O,再脱水干燥得到CaO2。
完成下列填空:
(3)第①步反应的化学方程式为
(4)生产中可循环使用的物质是
(5)检验CaO2•8H2O是否洗净的方法是
(6)已知CaO2在350℃迅速分解生成CaO和O2。如图是实验室测定产品中CaO2含量的装置(夹持装置省略)。

若所取产品质量是m g,测得气体体积为V mL(标况),产品中CaO2的质量分数为
您最近一年使用:0次



