解题方法
1 . 亚硝酰氯( )是一种黄色气体,沸点为
)是一种黄色气体,沸点为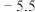 ℃。其液体呈红褐色。遇水发生反应:
℃。其液体呈红褐色。遇水发生反应: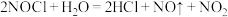 。某化学兴趣小组设计如图装置用
。某化学兴趣小组设计如图装置用 和
和 制备
制备 。回答下列相关问题:
。回答下列相关问题:
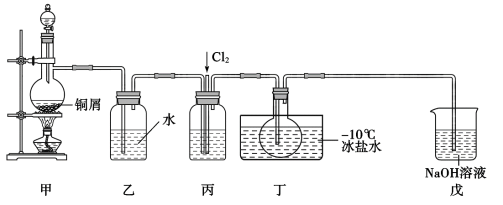
(1)甲装置发生反应的离子方程式为_______ ,装置丙中的液体是浓硫酸。
(2)实验时,先通入 ,待丁中烧瓶内充满黄绿色气体时,再通入
,待丁中烧瓶内充满黄绿色气体时,再通入 ,这样做的目的是
,这样做的目的是_______ 。
(3)装置丁中冰盐水的作用是_______ 。
(4)经分析该套装置设计上有一处明显缺陷,改进方法是_______ 。(用文字描述)
(5)吸收尾气时, 发生反应的化学方程式为
发生反应的化学方程式为_______ 。(已知: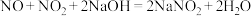 )
)
(6)反应完成后,取烧瓶中所得产物mg溶于水,配制成 溶液,取出
溶液,取出 ,再加入
,再加入

 溶液恰好完全反应,则产物中
溶液恰好完全反应,则产物中 纯度(质量分数)的计算式为
纯度(质量分数)的计算式为_______ 。
 )是一种黄色气体,沸点为
)是一种黄色气体,沸点为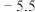 ℃。其液体呈红褐色。遇水发生反应:
℃。其液体呈红褐色。遇水发生反应: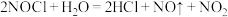 。某化学兴趣小组设计如图装置用
。某化学兴趣小组设计如图装置用 和
和 制备
制备 。回答下列相关问题:
。回答下列相关问题:
(1)甲装置发生反应的离子方程式为
(2)实验时,先通入
 ,待丁中烧瓶内充满黄绿色气体时,再通入
,待丁中烧瓶内充满黄绿色气体时,再通入 ,这样做的目的是
,这样做的目的是(3)装置丁中冰盐水的作用是
(4)经分析该套装置设计上有一处明显缺陷,改进方法是
(5)吸收尾气时,
 发生反应的化学方程式为
发生反应的化学方程式为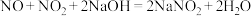 )
)(6)反应完成后,取烧瓶中所得产物mg溶于水,配制成
 溶液,取出
溶液,取出 ,再加入
,再加入

 溶液恰好完全反应,则产物中
溶液恰好完全反应,则产物中 纯度(质量分数)的计算式为
纯度(质量分数)的计算式为
您最近一年使用:0次
2021-07-03更新
|
424次组卷
|
2卷引用:河北省廊坊市香河县2020-2021学年高一下学期期末调研考试化学试题
2 .  是一种重要的杀菌消毒剂,也是一种烟气(主要含
是一种重要的杀菌消毒剂,也是一种烟气(主要含 、
、 )脱硫脱硝的吸收剂。已知:
)脱硫脱硝的吸收剂。已知: 溶液呈碱性;随溶液
溶液呈碱性;随溶液 增大,
增大, 氧化性降低;生产成本随着
氧化性降低;生产成本随着 的浓度增大明显增加。
的浓度增大明显增加。
(1)① 和
和 反应可制得
反应可制得 ,写出该反应的化学方程式
,写出该反应的化学方程式_______ 。
② 和
和 按一定比例与
按一定比例与 溶液反应也可制得
溶液反应也可制得 ,理论上
,理论上 与
与 完全反应的物质的量之比为
完全反应的物质的量之比为_______ 。
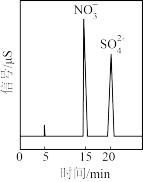
③在反应釜中用 吸收烟气,所得产物的离子色谱如下图所示。写出
吸收烟气,所得产物的离子色谱如下图所示。写出 溶液在脱硫过程中的离子方程式
溶液在脱硫过程中的离子方程式_______ 。
(2) 浓度对脱除效率的影响如下图所示。
浓度对脱除效率的影响如下图所示。
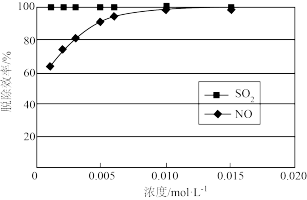
①综合考虑脱除效率和生产成本,选用 溶液浓度为
溶液浓度为_______ 。
②相对于 ,
, 更难脱除,可能的原因是
更难脱除,可能的原因是_______ 。
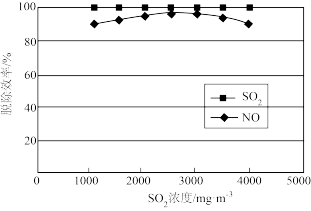
(3)烟气中 含量对脱硝的影响如下图所示,在
含量对脱硝的影响如下图所示,在 浓度小于
浓度小于 时,
时, 的浓度增大,脱硝效率提高,可能的原因是
的浓度增大,脱硝效率提高,可能的原因是_______ 。
 是一种重要的杀菌消毒剂,也是一种烟气(主要含
是一种重要的杀菌消毒剂,也是一种烟气(主要含 、
、 )脱硫脱硝的吸收剂。已知:
)脱硫脱硝的吸收剂。已知: 溶液呈碱性;随溶液
溶液呈碱性;随溶液 增大,
增大, 氧化性降低;生产成本随着
氧化性降低;生产成本随着 的浓度增大明显增加。
的浓度增大明显增加。(1)①
 和
和 反应可制得
反应可制得 ,写出该反应的化学方程式
,写出该反应的化学方程式②
 和
和 按一定比例与
按一定比例与 溶液反应也可制得
溶液反应也可制得 ,理论上
,理论上 与
与 完全反应的物质的量之比为
完全反应的物质的量之比为③在反应釜中用
 吸收烟气,所得产物的离子色谱如下图所示。写出
吸收烟气,所得产物的离子色谱如下图所示。写出 溶液在脱硫过程中的离子方程式
溶液在脱硫过程中的离子方程式
(2)
 浓度对脱除效率的影响如下图所示。
浓度对脱除效率的影响如下图所示。
①综合考虑脱除效率和生产成本,选用
 溶液浓度为
溶液浓度为②相对于
 ,
, 更难脱除,可能的原因是
更难脱除,可能的原因是(3)烟气中
 含量对脱硝的影响如下图所示,在
含量对脱硝的影响如下图所示,在 浓度小于
浓度小于 时,
时, 的浓度增大,脱硝效率提高,可能的原因是
的浓度增大,脱硝效率提高,可能的原因是
您最近一年使用:0次
名校
解题方法
3 .  在空气中易被氧化。某小组探究绿矾
在空气中易被氧化。某小组探究绿矾 和莫尔盐
和莫尔盐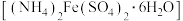 在空气中的稳定性。
在空气中的稳定性。
Ⅰ.探究溶液中的稳定性:配制 两种溶液[A:
两种溶液[A: ,B:
,B: ],露置于空气中一段时间,并检验其中的
],露置于空气中一段时间,并检验其中的 ,结果如表。
,结果如表。
(1)新配制的A溶液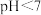 ,原因是
,原因是 发生了水解,离子方程式是
发生了水解,离子方程式是_______ 。
(2)常温时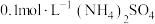 溶液
溶液 ,则B溶液中水解程度:
,则B溶液中水解程度:
_______  (填“>”或“<”),因此新配制的A、B溶液
(填“>”或“<”),因此新配制的A、B溶液 几乎相同。
几乎相同。
(3)放置 后溶液
后溶液 均减小,写出该过程中的离子方程式:
均减小,写出该过程中的离子方程式:_______ 。
上述实验说明两种溶液中的 的稳定性差异不大。
的稳定性差异不大。
Ⅱ.探究晶体的稳定性:将两种晶体分别在不同条件下放置数天,实验记录如表。
(4)甲同学推测绿矾在ⅱ中的结果与ⅰ不同可能是容器中 不足造成的。乙同学经过对比,分析该推测不成立,其理由是
不足造成的。乙同学经过对比,分析该推测不成立,其理由是_______ 。
(5)该小组同学根据实验结果进而推测绿矾易被氧化与其失去结晶水有关。
①绿矾晶体失去结晶水的实验现象是_______ 。
②莫尔盐晶体中_______ 离子的存在使结晶水不易失去;该离子与 分子之间可能存在的作用是
分子之间可能存在的作用是_______ 。
(6)同学们经过对两种晶体结构的比较,分析莫尔盐在空气中更稳定,除了上述原因外,还可能的原因:莫尔盐晶体中离子间的空隙较小,_______ 。
 在空气中易被氧化。某小组探究绿矾
在空气中易被氧化。某小组探究绿矾 和莫尔盐
和莫尔盐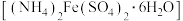 在空气中的稳定性。
在空气中的稳定性。Ⅰ.探究溶液中的稳定性:配制
 两种溶液[A:
两种溶液[A: ,B:
,B: ],露置于空气中一段时间,并检验其中的
],露置于空气中一段时间,并检验其中的 ,结果如表。
,结果如表。| 编号 | 新配制 |  后 后 |  后 后 | |||||
 | 性状 | 酸化后滴等量 |  | 性状 | 酸化后滴等量 |  | 性状 | |
| A | 3.9 | 无色溶液 | 几乎无色 | 3.4 | 黄色溶液 | 变红 | 3.3 | 红褐色沉淀 |
| B | 3.9 | 无色溶液 | 几乎无色 | 3.3 | 黄色溶液 | 变红 | 3.2 | 红褐色沉淀 |
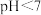 ,原因是
,原因是 发生了水解,离子方程式是
发生了水解,离子方程式是(2)常温时
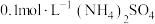 溶液
溶液 ,则B溶液中水解程度:
,则B溶液中水解程度:
 (填“>”或“<”),因此新配制的A、B溶液
(填“>”或“<”),因此新配制的A、B溶液 几乎相同。
几乎相同。(3)放置
 后溶液
后溶液 均减小,写出该过程中的离子方程式:
均减小,写出该过程中的离子方程式:上述实验说明两种溶液中的
 的稳定性差异不大。
的稳定性差异不大。Ⅱ.探究晶体的稳定性:将两种晶体分别在不同条件下放置数天,实验记录如表。
| 编号 | ⅰ | ⅱ | ⅲ | ⅳ | |
| 实验条件 | 露置 | 密闭容器 | 潮湿的密闭容器 | 盛有干燥剂的密闭容器 | |
| 实验 结果 | 绿矾 | 晶体逐渐变白,进而出现土黄色; 含量很多 含量很多 | 无明显变化; 含量非常少 含量非常少 | 晶体结块,颜色不变; 含量非常少 含量非常少 | 晶体逐渐变白,最终出现淡黄色; 含量很多 含量很多 |
| 莫尔盐 | 无明显变化; 含量非常少 含量非常少 | 无明显变化; 含量非常少 含量非常少 | 晶体略结块,颜色不变; 含量非常少 含量非常少 | 无明显变化; 含量很少 含量很少 | |
 不足造成的。乙同学经过对比,分析该推测不成立,其理由是
不足造成的。乙同学经过对比,分析该推测不成立,其理由是(5)该小组同学根据实验结果进而推测绿矾易被氧化与其失去结晶水有关。
①绿矾晶体失去结晶水的实验现象是
②莫尔盐晶体中
 分子之间可能存在的作用是
分子之间可能存在的作用是(6)同学们经过对两种晶体结构的比较,分析莫尔盐在空气中更稳定,除了上述原因外,还可能的原因:莫尔盐晶体中离子间的空隙较小,
您最近一年使用:0次
2023-02-17更新
|
464次组卷
|
4卷引用:北京市第二中学2022-2023学年高三下学期2月开学测试化学试题
解题方法
4 . 某校化学兴趣小组为探究浓、稀硝酸与金属铝反应的异同,实验装置如下图,请回答下列问题:

(1)实验开始前先将A、B、C、D连接在一起,打开弹簧夹,通一段时间的氮气,其目的为_______ 。然后再关闭弹簧夹,连接E、F装置。
(2)甲同学先向A中滴加20mL稀硝酸,观察到C中气体为无色,D中导气管口有气泡冒出。试写出此时A中反应的离子方程式_______ 。接下来他把稀硝酸换成浓硝酸,重复上述操作,观察到C中气体仍然为无色,D中导气管口也有气泡冒出。于是得出结论:无论浓硝酸还是稀硝酸,与金属铝反应生成的气体产物相同。你认为甲同学的结论是否正确?_______ (填“是”或“否”)。加浓硝酸时“D中导气管口也有气泡冒出”是因为_______ 。
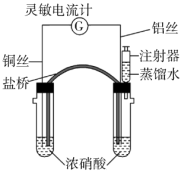
(3)乙同学用电化学方法来测定使铝钝化时硝酸的最低浓度,装置如下图。向两支具支试管中分别加入浓硝酸5.0mL(质量分数为65%,密度为1.4g·mL-1),将金属丝插入溶液中,开始实验时,观察到灵敏电流计指针指向正极_______ (填“铜”或“铝”),此时电池的正极反应式为_______ ,但指针又迅速反转。用盛蒸馏水的注射器缓慢向右边具支试管内加水并振荡,当出现_______ 的现象时,抽出金属丝停止实验。重复三次实验得平均加水量为2.5mL据此计算,使铝钝化的硝酸溶液的最低溶质质量分数为_______ (结果保留3位有效数字)。

(1)实验开始前先将A、B、C、D连接在一起,打开弹簧夹,通一段时间的氮气,其目的为
(2)甲同学先向A中滴加20mL稀硝酸,观察到C中气体为无色,D中导气管口有气泡冒出。试写出此时A中反应的离子方程式
(3)乙同学用电化学方法来测定使铝钝化时硝酸的最低浓度,装置如下图。向两支具支试管中分别加入浓硝酸5.0mL(质量分数为65%,密度为1.4g·mL-1),将金属丝插入溶液中,开始实验时,观察到灵敏电流计指针指向正极

您最近一年使用:0次
名校
5 . 二氧化氯(ClO2)是一种黄绿色有刺激性气味的气体。与Cl2的氧化性相近,可用于自来水消毒。为检测二氧化氯能否与KI溶液反应,某兴趣小组设计了下述实验(实验装置如图所示,且气密性良好,D中稳定剂不能与Cl2反应)。回答下列问题:

(1)盛放稀盐酸仪器的名称为_______ 。
(2)打开B的活塞,A中发生反应,且产物有ClO2、Cl2等,该反应的化学方程式为_______ 。
(3)关闭B的活塞,ClO2在D中被稳定剂完全吸收生成NaClO,此时观察到F中溶液的颜色不变,则装置C的作用是_______ 。
(4)已知在酸性条件下NaClO2可发生反应生成NaCl并放出ClO2,反应的离子方程式为_______ 。
(5)自来水厂用碘量法检测水中ClO2的浓度,其实验操作如下:取300.0 mL的水样,酸化,加入足量的碘化钾反应,再用0.2000 mol/L Na2S2O3溶液和生成的碘单质反应(反应的化学方程式为:2ClO2+10I-+8H+=5I2+2Cl- +4H2O、I2+2S2O =2I- +S4O
=2I- +S4O ),恰好完全反应时用去25.00 mL Na2S2O3溶液,测得该水样中的ClO2含量为
),恰好完全反应时用去25.00 mL Na2S2O3溶液,测得该水样中的ClO2含量为_______ mg/L。
(6)该小组同学还制得了ClO2的水溶液,以探究FeI2的还原性。他们进行了如下实验:取一定量的FeI2溶液,向其中滴加ClO2的水溶液。某同学对FeI2反应后的产物的成分(不考虑Cl- )提出了如下假设:
假设1:I2和Fe2+;
假设2:Fe3+、I-;
假设3:Fe3+、I2;
假设4:Fe2+、Fe3+、I2
其中假设_______ (填“1”“2”“3”或“4”)错误,理由是_______ 。

(1)盛放稀盐酸仪器的名称为
(2)打开B的活塞,A中发生反应,且产物有ClO2、Cl2等,该反应的化学方程式为
(3)关闭B的活塞,ClO2在D中被稳定剂完全吸收生成NaClO,此时观察到F中溶液的颜色不变,则装置C的作用是
(4)已知在酸性条件下NaClO2可发生反应生成NaCl并放出ClO2,反应的离子方程式为
(5)自来水厂用碘量法检测水中ClO2的浓度,其实验操作如下:取300.0 mL的水样,酸化,加入足量的碘化钾反应,再用0.2000 mol/L Na2S2O3溶液和生成的碘单质反应(反应的化学方程式为:2ClO2+10I-+8H+=5I2+2Cl- +4H2O、I2+2S2O
 =2I- +S4O
=2I- +S4O ),恰好完全反应时用去25.00 mL Na2S2O3溶液,测得该水样中的ClO2含量为
),恰好完全反应时用去25.00 mL Na2S2O3溶液,测得该水样中的ClO2含量为(6)该小组同学还制得了ClO2的水溶液,以探究FeI2的还原性。他们进行了如下实验:取一定量的FeI2溶液,向其中滴加ClO2的水溶液。某同学对FeI2反应后的产物的成分(不考虑Cl- )提出了如下假设:
假设1:I2和Fe2+;
假设2:Fe3+、I-;
假设3:Fe3+、I2;
假设4:Fe2+、Fe3+、I2
其中假设
您最近一年使用:0次
名校
6 . 据古籍记载,焙烧绿矾( )矿石能制备铁红,同时制得硫酸。某研究性学习小组对绿矾的焙烧反应进行探究,装置如下图所示。
)矿石能制备铁红,同时制得硫酸。某研究性学习小组对绿矾的焙烧反应进行探究,装置如下图所示。

回答下列问题:
(1)在试管中加入少量绿矾样品,加水溶解,滴加 溶液,无明显现象。再向试管中加入适量
溶液,无明显现象。再向试管中加入适量___________ (填写试剂名称),振荡,溶液变为红色。由此可知该样品___________ (填“已”或“未”)变质。
(2)写出绿矾充分焙烧的过程中只生成一种酸性气体的化学方程式___________ 。
(3)装置 中冷水的作用是
中冷水的作用是___________ 。
(4)为防止倒吸,停止实验时应进行的操作是___________ 。
(5)用 滴定法测定绿矾的纯度。称取
滴定法测定绿矾的纯度。称取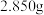 绿矾样品,配制成
绿矾样品,配制成 溶液,量取
溶液,量取 待测液于锥形瓶中,用
待测液于锥形瓶中,用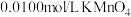 酸性溶液滴定,反应消耗
酸性溶液滴定,反应消耗 酸性溶液体积的平均值为
酸性溶液体积的平均值为 。
。
①配制绿矾样品溶液时需要用到的玻璃仪器是:烧杯、玻璃棒、量筒、___________ 。
②该实验滴定终点时溶液的颜色变为___________ 。
③该绿矾样品中 的质量分数为
的质量分数为___________ (计算结果保留3位有效数字)。
 )矿石能制备铁红,同时制得硫酸。某研究性学习小组对绿矾的焙烧反应进行探究,装置如下图所示。
)矿石能制备铁红,同时制得硫酸。某研究性学习小组对绿矾的焙烧反应进行探究,装置如下图所示。
回答下列问题:
(1)在试管中加入少量绿矾样品,加水溶解,滴加
 溶液,无明显现象。再向试管中加入适量
溶液,无明显现象。再向试管中加入适量(2)写出绿矾充分焙烧的过程中只生成一种酸性气体的化学方程式
(3)装置
 中冷水的作用是
中冷水的作用是(4)为防止倒吸,停止实验时应进行的操作是
(5)用
 滴定法测定绿矾的纯度。称取
滴定法测定绿矾的纯度。称取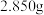 绿矾样品,配制成
绿矾样品,配制成 溶液,量取
溶液,量取 待测液于锥形瓶中,用
待测液于锥形瓶中,用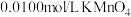 酸性溶液滴定,反应消耗
酸性溶液滴定,反应消耗 酸性溶液体积的平均值为
酸性溶液体积的平均值为 。
。①配制绿矾样品溶液时需要用到的玻璃仪器是:烧杯、玻璃棒、量筒、
②该实验滴定终点时溶液的颜色变为
③该绿矾样品中
 的质量分数为
的质量分数为
您最近一年使用:0次
2021-04-24更新
|
548次组卷
|
5卷引用:湖北省武汉市2020-2021学年高三下学期4月质量检测化学试题
名校
7 . SO2在生活、生产中有重要用途,使用不当会造成环境污染。回答下列问题:
(1)某同学利用如图所示装置研究二氧化硫的性质。____ 。
②向仪器a中滴加70%浓硫酸之前,需先通入一段时间N2,此操作的目的是____ 。
③实验时,装置B中没有明显变化。实验结束后取下装置B,向其中滴加适量氨水,观察到的实验现象是____ 。
④装置C中出现淡黄色浑浊,反应的化学方程式为____ 。
⑤装置D的作用是____ 。
(2)某兴趣小组用如图所示装置模拟测定空气中的二氧化硫的含量。当注入标准状况下VmL空气时,酸性KMnO4溶液恰好褪色,停止实验。____ 。
②该空气中二氧化硫的体积分数为____ (用含V的代数式表示)。
(3)某化工厂用如图所示工艺流程除去燃煤产生的SO2。____ 。
②过程II发生反应的化学方程式为_____ 。
(1)某同学利用如图所示装置研究二氧化硫的性质。

②向仪器a中滴加70%浓硫酸之前,需先通入一段时间N2,此操作的目的是
③实验时,装置B中没有明显变化。实验结束后取下装置B,向其中滴加适量氨水,观察到的实验现象是
④装置C中出现淡黄色浑浊,反应的化学方程式为
⑤装置D的作用是
(2)某兴趣小组用如图所示装置模拟测定空气中的二氧化硫的含量。当注入标准状况下VmL空气时,酸性KMnO4溶液恰好褪色,停止实验。

②该空气中二氧化硫的体积分数为
(3)某化工厂用如图所示工艺流程除去燃煤产生的SO2。

②过程II发生反应的化学方程式为
您最近一年使用:0次
2022-11-17更新
|
128次组卷
|
2卷引用:山西省金科大联考2022-2023学年高三上学期11月质量检测化学试题
解题方法
8 . 如图是实验室中制备气体或验证气体性质的装置图。

(1)仪器a的名称是________ 。
(2)利用图装置证明SO2具有漂白性、还原性及生成气体中含有CO2。圆底烧瓶内加入碳,a中加入浓硫酸,B、D中均为少量品红溶液,C中为酸性高锰酸钾溶液,E中为澄清石灰水。
①证明SO2通常使用的试剂是________ 。
②证明SO2具有还原性的现象是________ 。
③证明生成气体中含有CO2的现象是________ 。
④证明SO2具有漂白性的装置是________ 。
⑤D装置的作用是________ 。
⑥如果将E中试剂换成硅酸钠溶液,看到E中浑浊,则酸性H2CO3________ H2SiO3(填“=”、“>”或“<”)。
(3)某同学拟用以下方法测定空气中SO2含量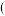 假设空气中无其它还原性气体
假设空气中无其它还原性气体 。
。
你认为不可行的装置是________  填序号“a”或“b”
填序号“a”或“b” ,理由是
,理由是________ 。

(1)仪器a的名称是
(2)利用图装置证明SO2具有漂白性、还原性及生成气体中含有CO2。圆底烧瓶内加入碳,a中加入浓硫酸,B、D中均为少量品红溶液,C中为酸性高锰酸钾溶液,E中为澄清石灰水。
①证明SO2通常使用的试剂是
②证明SO2具有还原性的现象是
③证明生成气体中含有CO2的现象是
④证明SO2具有漂白性的装置是
⑤D装置的作用是
⑥如果将E中试剂换成硅酸钠溶液,看到E中浑浊,则酸性H2CO3
(3)某同学拟用以下方法测定空气中SO2含量
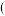 假设空气中无其它还原性气体
假设空气中无其它还原性气体 。
。
你认为不可行的装置是
 填序号“a”或“b”
填序号“a”或“b” ,理由是
,理由是
您最近一年使用:0次
名校
解题方法
9 . 某学习小组设计制取SO2并验证其部分性质的实验装置图如图(夹持装置省略)。下列叙述正确的是


| A.取反应后D中溶液少许,滴加品红溶液,红色褪去就能说明SO2具有漂白性 |
| B.A装置中比较理想的反应物质是Na2SO3固体和质量分数为10%的硫酸 |
C.B装置溶液变为红色,说明SO2是酸性氧化物;C装置产生白色沉淀的原因为:BaCl2+SO2+H2O BaSO3↓+2HCl BaSO3↓+2HCl |
| D.关闭弹簧夹a,打开弹簧夹b,用酒精灯在三颈烧瓶下微热,若能观察到C中长导管口有明显气泡现象,冷却后液体倒吸,就能判断装置A、B部分气密性良好 |
您最近一年使用:0次
2021-04-06更新
|
956次组卷
|
12卷引用:山东省淄博市高青县第一中学2020-2021学年高二下学期第一次月考化学试题
山东省淄博市高青县第一中学2020-2021学年高二下学期第一次月考化学试题(已下线)考点11 硫及其化合物-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点11 硫及其化合物-备战2022年高考化学一轮复习考点帮(浙江专用)(已下线)第11讲 硫及其化合物(讲)— 2022年高考化学一轮复习讲练测(新教材新高考)(已下线)课后-5.1.1 硫和二氧化硫-人教2019必修第二册山西省长治市第二中学校2021-2022学年高一下学期期中考试化学试题(已下线)考点10 硫及其化合物-备战2023年高考化学一轮复习考点帮(全国通用)(已下线)专题四 非金属及其化合物 能力提升检测卷(测)-2023年高考化学一轮复习讲练测(新教材新高考)辽宁省锦州市育明高级中学2022-2023学年高一下学期第一次阶段性考试化学试题(已下线)考点10 硫及其化合物(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)江苏省常熟市王淦昌高级中学2022-2023学年高二下学期5月月考化学试卷山东省济宁市育才中学2023-2024学年高一下学期期中考试化学试卷
10 . I.某学习小组用如图所示实验检验浓硫酸与铜反应产生的二氧化硫(图中夹持装置已略去)。

已知:浓硫酸的沸点为338℃,酒精灯外焰温度一般为500℃左右。
(1)浸有NaOH溶液的棉团作用是_______ 。
(2)能证明铜丝与浓硫酸反应产生了SO2的实验现象为_______ 。铜丝与浓硫酸反应的化学方程式为_______ 。
(3)将品红溶液换为Ba(OH)2溶液,发现其中产生白色沉淀。小组同学认为此现象不足以说明Cu和浓硫酸反应产生了SO2,其原因是_______ 。
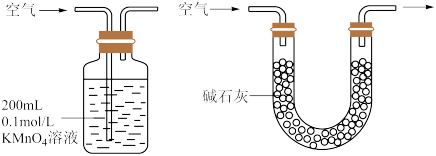
II.为测定空气中SO2的含量,某课外小组的同学将空气样品经过管道通入密闭容器中的200mL 0.100mol/L的酸性KMnO4溶液。已知SO2与该溶液反应的离子方程式为: 。
。
(4)若管道中空气流量为a L/min,经过bmin溶液恰好褪色,假定样品中的SO2可被溶液充分吸收,则该空气样品中SO2的含量是______ g/L

已知:浓硫酸的沸点为338℃,酒精灯外焰温度一般为500℃左右。
(1)浸有NaOH溶液的棉团作用是
(2)能证明铜丝与浓硫酸反应产生了SO2的实验现象为
(3)将品红溶液换为Ba(OH)2溶液,发现其中产生白色沉淀。小组同学认为此现象不足以说明Cu和浓硫酸反应产生了SO2,其原因是
II.为测定空气中SO2的含量,某课外小组的同学将空气样品经过管道通入密闭容器中的200mL 0.100mol/L的酸性KMnO4溶液。已知SO2与该溶液反应的离子方程式为:
 。
。(4)若管道中空气流量为a L/min,经过bmin溶液恰好褪色,假定样品中的SO2可被溶液充分吸收,则该空气样品中SO2的含量是
您最近一年使用:0次



