1 . 甲同学通过查询资料知道,一定浓度的硝酸与镁反应时,可得到二氧化氮、一氧化氮、氮气三种气体。该同学用下列仪器组装装置来直接验证有二氧化氮、一氧化氮生成并制取氮化镁 (假设实验中每步转化均是完全的) 。查阅文献得知:
①二氧化氮沸点为21.1 ℃、熔点为-11 ℃,一氧化氮沸点为-151 ℃、熔点为-164 ℃;
②镁也能与二氧化碳反应;
③氮化镁遇水反应生成氢氧化镁和氨气。
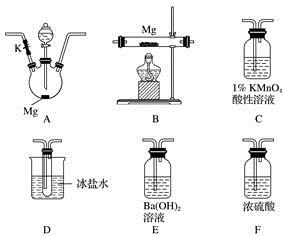
(1)实验中先打开开关K,通过导管向装置内通入二氧化碳气体以排出装置内的空气,停止通入二氧化碳的标志是________________________________ 。
(2)为实现上述实验目的,所选用的仪器的正确连接方式是A→____________ →E,确定还原产物中有二氧化氮的现象是______________________________________ ,实验中要多次使用装置F,第二次使用F的目的是______________________________________________ 。
(3)实验过程中,发现在D中产生预期现象的同时,C中溶液颜色慢慢褪去,试写出C中反应的离子方程式:________________________________ 。
(4)甲同学在A中开始反应时,马上点燃B处的酒精灯,实验结束后通过测试发现B处的产品纯度不高,原因是______________________________________ 。
(5)设计一种实验方案,验证镁与硝酸反应时确实有氮气生成:__________________________ 。
①二氧化氮沸点为21.1 ℃、熔点为-11 ℃,一氧化氮沸点为-151 ℃、熔点为-164 ℃;
②镁也能与二氧化碳反应;
③氮化镁遇水反应生成氢氧化镁和氨气。

(1)实验中先打开开关K,通过导管向装置内通入二氧化碳气体以排出装置内的空气,停止通入二氧化碳的标志是
(2)为实现上述实验目的,所选用的仪器的正确连接方式是A→
(3)实验过程中,发现在D中产生预期现象的同时,C中溶液颜色慢慢褪去,试写出C中反应的离子方程式:
(4)甲同学在A中开始反应时,马上点燃B处的酒精灯,实验结束后通过测试发现B处的产品纯度不高,原因是
(5)设计一种实验方案,验证镁与硝酸反应时确实有氮气生成:
您最近一年使用:0次
2016-12-09更新
|
1403次组卷
|
10卷引用:2015-2016学年江苏省扬州中学高一下期中化学试卷
2015-2016学年江苏省扬州中学高一下期中化学试卷2016届湖北省沙市中学高三下第一次半月考理综化学试卷(已下线)同步君 必修1 第4章 第4节 硝酸高中化学人教版 必修1 第四章 非金属及其化合物 4.氨 硫酸 硝酸 硝酸云南省元江县一中2018-2019学年高一上学期12月考试化学试题贵州省剑河县二中2018-2019学年高一上学期期末考试化学试题内蒙古集宁一中2019-2020学年高二下学期第二次月考化学试题山西省忻州市静乐县第一中学2019-2020学年高二下学期第一次月考化学试题云南省玉溪市通海二中2020-2021学年高一下学期期中考试化学试题辽宁省沈阳市第一二〇中学2021-2022学年高一下学期线上教学质量检测期中考试化学试题
名校
解题方法
2 . 某小组同学为了获取在Fe(OH)2制备过程中,沉淀颜色的改变与氧气有关的实验证据,用下图所示装置进行了如下实验(夹持装置已略去,气密性已检验)。
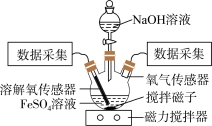
【进行实验】
实验步骤:Ⅰ.向瓶中加入饱和FeSO4溶液,按图1所示连接装置;
Ⅱ.打开磁力搅拌器,立即加入10% NaOH溶液;
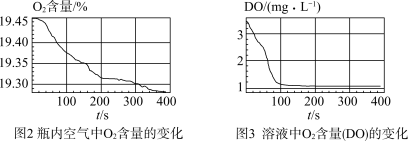
Ⅲ.采集瓶内空气中O2含量和溶液中O2含量(DO)的数据。
实验现象:生成白色絮状沉淀,白色沉淀迅速变为灰绿色,一段时间后部分变为红褐色。
【解释与结论】
(1)搅拌的目的是__________________________ 。
(2)生成白色沉淀的离子方程式是____________ 。
(3)红褐色沉淀是__________________________ 。(填化学式)
(4)通过上述实验,可得到“在Fe(OH)2制备过程中,沉淀颜色改变与氧气有关”的结论,其实验证据是______________________ 。
(5)写出白色沉淀最终生成红褐色转化的方程式:___________________________ 。

【进行实验】
实验步骤:Ⅰ.向瓶中加入饱和FeSO4溶液,按图1所示连接装置;
Ⅱ.打开磁力搅拌器,立即加入10% NaOH溶液;
Ⅲ.采集瓶内空气中O2含量和溶液中O2含量(DO)的数据。
实验现象:生成白色絮状沉淀,白色沉淀迅速变为灰绿色,一段时间后部分变为红褐色。
实验数据:

【解释与结论】
(1)搅拌的目的是
(2)生成白色沉淀的离子方程式是
(3)红褐色沉淀是
(4)通过上述实验,可得到“在Fe(OH)2制备过程中,沉淀颜色改变与氧气有关”的结论,其实验证据是
(5)写出白色沉淀最终生成红褐色转化的方程式:
您最近一年使用:0次
3 . 某化学小组为了证明二氧化硫和氯气的漂白性,设计了如下图所示的实验装置:

他们制备二氧化硫和氯气所依据的原理分别是:
Na2SO3+H2SO4 = Na2SO4+H2O+SO2↑
MnO2+4HCl(浓) MnCl2+2H2O+Cl2↑
MnCl2+2H2O+Cl2↑
(1)用来制取氯气的装置是______ (填字母),反应中浓盐酸所表现出________________ 性质。
(2)反应开始一段时间后,B、D试管中的品红溶液均褪色。停止通气后,再给B、D两个试管分别加热____ (填" B”或“D")试管中无明显现象。
(3)装置C的作用是________________________ ;
(4)若装置D中的品红溶液换成紫色的石蕊溶液,则出现的现象是____________________________ ;
(5)该小组同学将两种气体混合后通入品红溶液,一段时间后,品红溶液几乎不褪色。查阅资料得知:两种气体按体积比1:1混合,再与水反应可生成两种常见的酸,因而失去漂白作用,该反应的化学方程式是:________________________________ 。

他们制备二氧化硫和氯气所依据的原理分别是:
Na2SO3+H2SO4 = Na2SO4+H2O+SO2↑
MnO2+4HCl(浓)
 MnCl2+2H2O+Cl2↑
MnCl2+2H2O+Cl2↑(1)用来制取氯气的装置是
(2)反应开始一段时间后,B、D试管中的品红溶液均褪色。停止通气后,再给B、D两个试管分别加热
(3)装置C的作用是
(4)若装置D中的品红溶液换成紫色的石蕊溶液,则出现的现象是
(5)该小组同学将两种气体混合后通入品红溶液,一段时间后,品红溶液几乎不褪色。查阅资料得知:两种气体按体积比1:1混合,再与水反应可生成两种常见的酸,因而失去漂白作用,该反应的化学方程式是:
您最近一年使用:0次
2019-12-27更新
|
1271次组卷
|
10卷引用:2013-2014学年广东省东莞市高一上学期期末考试化学试卷(A)
(已下线)2013-2014学年广东省东莞市高一上学期期末考试化学试卷(A)2013-2014广东省东莞市高一上学期期末化学A试卷云南省大关县一中2018-2019学年高一上学期12月考试化学试题【全国百强校】黑龙江省牡丹江市第一高级中学2018-2019学年高一上学期期末考试化学试题(已下线)【走进新高考】(人教版必修一)4.3.1硫和氮的氧化物——二氧化硫和三氧化硫 同步练习02河南省郑州第四十七中2019-2020学年高一上学期第二次月考化学试题人教版高中化学必修一第四章《非金属及其化合物》测试卷人教版高中化学必修1第四章《非金属及其化合物》测试卷5(已下线)练习15 含硫化合物的性质和应用-2020-2021学年【补习教材·寒假作业】高一化学(苏教版)江苏省宿迁市泗阳县实验高级中学2021-2022学年高一上学期第二次调研测试化学试题
4 . 工业上常通过高温分解FeSO4的方法制备较为纯净的Fe2O3,其反应方程式为:2FeSO4 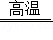 Fe2O3+SO2↑+SO3↑
Fe2O3+SO2↑+SO3↑
为了检验FeSO4高温分解的产物,进行如下实验:
①取少量FeSO4高温分解得到的固体,先加入一定量稀盐酸使固体完全溶解,再向所得溶液中适量的KSCN溶液,观察溶液颜色的变化以检验Fe3+是否存在。
②将FeSO4高温分解产生的气体通入如图所示的装置中,以检验产生的气体中是否含有SO2 和SO3
请回答下列问题:
(1)写出能说明FeSO4发生分解的现象__________________________________ ;
(2)写出KSCN溶液与Fe3+反应的离子方程式:_________________ ;
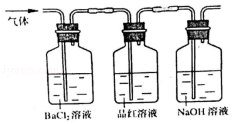
(3)实验②中,气体通过BaCl2时可以观察到的现象__________________________ ,产生该现象所对应的化学反应为___________________________________ (用一个化学反应方程式表示);
(4)实验②中最后要将通过品红溶液的气体通入NaOH溶液中,其目的是________________________ 。
 Fe2O3+SO2↑+SO3↑
Fe2O3+SO2↑+SO3↑为了检验FeSO4高温分解的产物,进行如下实验:
①取少量FeSO4高温分解得到的固体,先加入一定量稀盐酸使固体完全溶解,再向所得溶液中适量的KSCN溶液,观察溶液颜色的变化以检验Fe3+是否存在。
②将FeSO4高温分解产生的气体通入如图所示的装置中,以检验产生的气体中是否含有SO2 和SO3
请回答下列问题:
(1)写出能说明FeSO4发生分解的现象
(2)写出KSCN溶液与Fe3+反应的离子方程式:
(3)实验②中,气体通过BaCl2时可以观察到的现象
(4)实验②中最后要将通过品红溶液的气体通入NaOH溶液中,其目的是

您最近一年使用:0次
5 . 某校化学实验兴趣小组为了探究在实验室制备Cl2的过程中有水蒸气和HCl挥发出来,同时证明氯气的某些性质,甲同学设计了如图所示的实验装置(支撑用的铁架台省略),按要求回答问题。
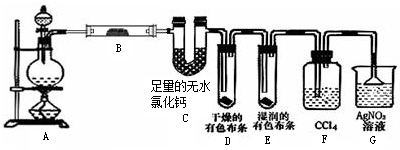
(1)写出A中实验室制氯气的化学方程式________ 。
(2)①装置B中盛放的试剂名称为________ ,现象是________ 。
②装置D和E中出现的不同现象说明________ 。
③装置F的作用是________ 。
(3)乙同学认为甲同学的实验有缺陷,不能确保最终通入AgNO3溶液中的气体只有一种。为了确保实验结论的可靠性,证明最终通入AgNO3溶液的气体只有一种,乙同学提出在装置F和装置G之间再加一个装置,该装置中应放入________ (填写试剂或用品名称)。

(1)写出A中实验室制氯气的化学方程式
(2)①装置B中盛放的试剂名称为
②装置D和E中出现的不同现象说明
③装置F的作用是
(3)乙同学认为甲同学的实验有缺陷,不能确保最终通入AgNO3溶液中的气体只有一种。为了确保实验结论的可靠性,证明最终通入AgNO3溶液的气体只有一种,乙同学提出在装置F和装置G之间再加一个装置,该装置中应放入
您最近一年使用:0次
2018-12-19更新
|
154次组卷
|
2卷引用:江苏省公道中学2018-2019学年高一上学期期中考试化学试题
6 . 工业上常通过高温分解FeSO4的方法制备Fe2O3,其化学方程式为:2FeSO4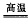 Fe2O3+SO2↑+SO3↑为检验FeSO4高温分解的产物,进行如下实验
Fe2O3+SO2↑+SO3↑为检验FeSO4高温分解的产物,进行如下实验
(1)检验产物Fe2O3取少量FeSO4高温分解得到的固体,加入一定量__________ 溶解,再向该溶液中加入适量的__________ 溶液,如有____________ 现象产生,则证明产物中存在Fe2O3
(2)检验气体产物:将FeSO4高温分解产生的气体通入下图三个装置中,以检验产生的气体中是否含有SO2、SO3。
①三个装量的连接序为_______________ (填装置序号)
②实验中如观察到装置A中品红溶液______ ,装置B BaCl2溶液中__________ ,则可证明FeSO4高温分解产生的气体中含有SO2、SO3。
③装置C中NaOH溶液的作用是_______________ (用离子方程式表示〕。
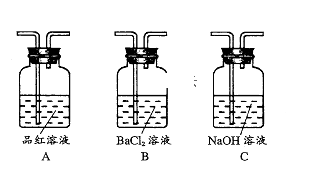
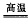 Fe2O3+SO2↑+SO3↑为检验FeSO4高温分解的产物,进行如下实验
Fe2O3+SO2↑+SO3↑为检验FeSO4高温分解的产物,进行如下实验(1)检验产物Fe2O3取少量FeSO4高温分解得到的固体,加入一定量
(2)检验气体产物:将FeSO4高温分解产生的气体通入下图三个装置中,以检验产生的气体中是否含有SO2、SO3。
①三个装量的连接序为
②实验中如观察到装置A中品红溶液
③装置C中NaOH溶液的作用是

您最近一年使用:0次
7 . 某课外研究性学习小组用下图所示装置制备少量溴苯并验证溴与苯的反应是取代反应。
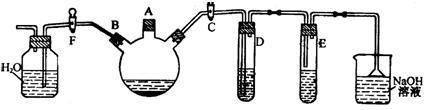
实验时,关闭F活塞,打开C活塞,在装有少量苯的三口烧瓶中由A口加入少量液溴,再加入少量铁屑,塞住A口。
回答下列问题:
(1)D试管内装的是______________ ,其作用是_____________________ 。
(2)E试管内装的是______________ 。
(3)除去溴苯中混有的Br2杂质的试剂是____________ ,操作方法为____________ 。
(4)三口烧瓶中发生反应的化学方程式为:_________________________________
(5)根据什么现象可证明验证溴与苯的反应是取代反应?__________________ 。

实验时,关闭F活塞,打开C活塞,在装有少量苯的三口烧瓶中由A口加入少量液溴,再加入少量铁屑,塞住A口。
回答下列问题:
(1)D试管内装的是
(2)E试管内装的是
(3)除去溴苯中混有的Br2杂质的试剂是
(4)三口烧瓶中发生反应的化学方程式为:
(5)根据什么现象可证明验证溴与苯的反应是取代反应?
您最近一年使用:0次
8 . 某研究性学习小组为了验证臭氧的氧化性强于氧气,进行了下述实验,请参与探究并回答相关问题。
[实验目的]验证臭氧的氧化性强于氧气。
[实验原理]2KI+O3+H2O=2KOH+I2+O2,淀粉溶液遇单质碘变蓝色。
[实验用品]臭氧消毒碗柜、a溶液、碘化钾溶液、滤纸、玻璃片、温度计。
[实验步骤]
①取a溶液与碘化钾溶液混合。
②取两片用滤纸剪成的纸条,在a和碘化钾的混合液中湿润后分别置于两块洁净的玻璃片上。
③将一块玻璃片(Ⅰ)置于臭氧消毒碗柜中并接通电源生成臭氧。将另一块玻璃片(Ⅱ)置于可控温度的温箱里,尽量地使温箱的温度与消毒碗柜中的温度相等。
④观察现象并进行记录:
请根据上述实验原理、步骤及你所学的知识,回答下列问题:
(1)实验药品中的a溶液是__________ 溶液。
(2)写出在臭氧消毒柜中产生O3的化学方程式:_____ 。
(3)整个实验过程要保持两块玻璃片所在环境的温度相同的原因是_________ 。
(4)从实验数据记录可以得出的结论是____ (填序号)。
A. O3的氧化性比O2强
B. 氧气也能氧化碘化钾中的碘离子
C. 空气中可能也有一定浓度的O3,所以实验数据不可靠,不能达到实验目的
D. O3不仅氧化I-的速率比氧气快,而且有漂白作用
(5)在O3氧化KI的反应中,若有9.6 g O3发生反应,则转移的电子的物质的量为_____ 。
[实验目的]验证臭氧的氧化性强于氧气。
[实验原理]2KI+O3+H2O=2KOH+I2+O2,淀粉溶液遇单质碘变蓝色。
[实验用品]臭氧消毒碗柜、a溶液、碘化钾溶液、滤纸、玻璃片、温度计。
[实验步骤]
①取a溶液与碘化钾溶液混合。
②取两片用滤纸剪成的纸条,在a和碘化钾的混合液中湿润后分别置于两块洁净的玻璃片上。
③将一块玻璃片(Ⅰ)置于臭氧消毒碗柜中并接通电源生成臭氧。将另一块玻璃片(Ⅱ)置于可控温度的温箱里,尽量地使温箱的温度与消毒碗柜中的温度相等。
④观察现象并进行记录:
| 时间(min) | 0 | 15 | 30 | 45 | 60 | 90 | 120 | |
| 滤纸的颜色变化 | 玻璃片(Ⅰ)上的滤纸 | 白色 | 白色 | 灰色 | 浅蓝色 | 蓝色 | 蓝色 | 浅蓝色 |
| 玻璃片(Ⅱ) 上的滤纸 | 白色 | 白色 | 白色 | 白色 | 灰色 | 灰色 | 浅蓝色 | |
(1)实验药品中的a溶液是
(2)写出在臭氧消毒柜中产生O3的化学方程式:
(3)整个实验过程要保持两块玻璃片所在环境的温度相同的原因是
(4)从实验数据记录可以得出的结论是
A. O3的氧化性比O2强
B. 氧气也能氧化碘化钾中的碘离子
C. 空气中可能也有一定浓度的O3,所以实验数据不可靠,不能达到实验目的
D. O3不仅氧化I-的速率比氧气快,而且有漂白作用
(5)在O3氧化KI的反应中,若有9.6 g O3发生反应,则转移的电子的物质的量为
您最近一年使用:0次
9 . 下列实验操作与预期实验目的或所得实验结论一致的是
| 选项 | 实验操作和现象 | 预期实验目的或结论 |
| A | 用洁净的铂丝蘸取某食盐试样,在酒精灯火焰上灼烧,火焰显黄色 | 说明该食盐不是加碘盐 |
| B | 银氨溶液中滴入少量组成为C2H4O2 的液态有机物,水浴微热,有银镜出现 | 可确定该有机物一定是甲酸甲酯 |
| C | 向两支盛有KI3 的溶液的试管中,分别滴加淀粉溶液和AgNO3溶液,前者溶液变蓝,后者有黄色沉淀 | KI3溶液中存在平衡:I3-=I2+I- |
| D | 浓硫酸与乙醇170℃共热,制得的气体通入酸性高锰酸钾溶液,溶液紫色褪去 | 制得的气体产物为乙烯 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
解题方法
10 . 下列实验操作不能 达到相应实验目的的是
| 选项 | 实验目的 | 实验操作 |
| A | 比较水与乙醇中氢的活泼性 | 分别将少量钠投入到乙醇和水中,观察现象 |
| B | 检验淀粉酸性水解液中含葡萄糖 | 向水解液中直接加入少量Cu(OH)2悬浊液,加热 |
| C | 提纯含有少量乙酸的乙酸乙酯 | 试样中加入足量饱和碳酸钠溶液,振荡后静置分液,并除去有机层中的水 |
| D | 验证温度对化学反应速率的影响 | 在两支试管中各加入5mL12%H2O2 溶液,将其中一支用水浴加热,观察并比较实验现象 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2017-07-04更新
|
207次组卷
|
2卷引用:江苏省盐城市2016-2017学年高一下学期期末考试化学试题



