1 . 某化学兴趣小组为探究Cl2的性质并制备氯水,用如图所示装置进行实验。装置Ⅲ中夹持装置已略去,其中a为干燥的品红试纸,b为湿润的品红试纸。

回答下列问题:
(1)盛装浓盐酸的仪器的名称为___________ 。
(2)装置Ⅰ中发生反应的化学方程式为___________ 。
(3)实验结束后,该组同学在装置Ⅲ中观察到b的红色褪去,但是并未观察到“a无明显变化”这一预期现象。为了达到这一实验目的,你认为应在___________ 和___________ (填装置序号)之间添加洗气装置,该装置的作用是___________ 。
(4)装置Ⅴ中NaOH溶液的作用是___________ ,相关反应的离子方程式为___________ 。
(5)工业上可用氢氧化钠与氯气反应制取84消毒液,在生活中84消毒液不可与洁厕灵(HCl)混用,否则会产生一种黄绿色有毒气体,其原因是___________ (用离子方程式解释)。
(6)氯在饮用水处理中常用作杀菌剂,且HClO的杀菌能力比ClO-强,氯水中Cl2(aq)、HClO和ClO-分别在三者中所占分数(α)随pH变化的关系如图所示。
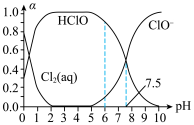
①用氯处理饮用水,pH=7.5时的杀菌效果比pH=6.5时的杀菌效果___________ (填“好”或“差”)。
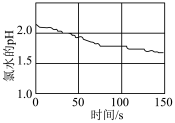
②利用数字化实验测定光照氯水得到光照过程中氯水的pH变化情况如图所示,变化原因是___________ (用方程式或必要的文字说明)。

回答下列问题:
(1)盛装浓盐酸的仪器的名称为
(2)装置Ⅰ中发生反应的化学方程式为
(3)实验结束后,该组同学在装置Ⅲ中观察到b的红色褪去,但是并未观察到“a无明显变化”这一预期现象。为了达到这一实验目的,你认为应在
(4)装置Ⅴ中NaOH溶液的作用是
(5)工业上可用氢氧化钠与氯气反应制取84消毒液,在生活中84消毒液不可与洁厕灵(HCl)混用,否则会产生一种黄绿色有毒气体,其原因是
(6)氯在饮用水处理中常用作杀菌剂,且HClO的杀菌能力比ClO-强,氯水中Cl2(aq)、HClO和ClO-分别在三者中所占分数(α)随pH变化的关系如图所示。

①用氯处理饮用水,pH=7.5时的杀菌效果比pH=6.5时的杀菌效果
②利用数字化实验测定光照氯水得到光照过程中氯水的pH变化情况如图所示,变化原因是

您最近一年使用:0次
解题方法
2 . 浓盐酸和高锰酸钾在室温下即可制备氯气,用如图装置制备少量的氯气并探究其性质。下列实验装置和操作能达到实验目的的是
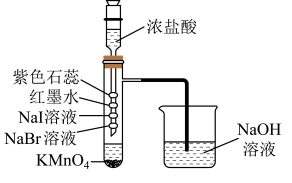

| A.根据溴化钠和碘化钠中的现象可证明氧化性:Br2<I2 |
| B.红墨水褪色,说明氯水具有漂白性 |
| C.紫色石蕊试液先变红后褪色,说明氯气具有酸性和强氧化性 |
| D.可用饱和食盐水代替NaOH溶液吸收多余的氯气 |
您最近一年使用:0次
3 . 某校化学兴趣小组为研究Cl2的性质,设计如图所示装置进行实验。装置Ⅲ中夹持装置已略去,其中a为干燥的品红试纸,b为湿润的品红试纸。
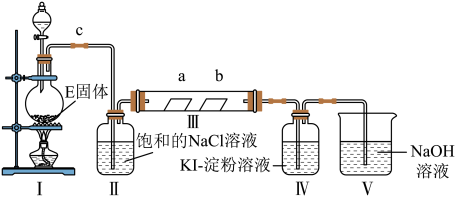
(1)实验室以二氧化锰和浓盐酸制备氯气的离子方程式是___________ 。
(2)装置Ⅱ的作用是___________ 。
(3)实验过程中,装置IV中的实验现象为___________ ;发生反应的化学方程式为___________ 。
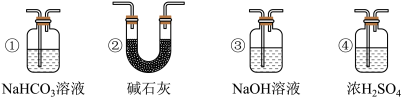
(4)实验结束后,该组同学在装置Ⅲ中观察到b的红色褪去,但是并未观察到“a无明显变化”这一预期现象。为了达到这一实验目的,你认为还需在上图装置Ⅱ与Ⅲ之间添加如图中的___________ 装置(填序号),
(5)装置Ⅴ的目的是防止尾气污染,写出装置Ⅴ中发生反应的离子方程式___________ 。

(1)实验室以二氧化锰和浓盐酸制备氯气的离子方程式是
(2)装置Ⅱ的作用是
(3)实验过程中,装置IV中的实验现象为
(4)实验结束后,该组同学在装置Ⅲ中观察到b的红色褪去,但是并未观察到“a无明显变化”这一预期现象。为了达到这一实验目的,你认为还需在上图装置Ⅱ与Ⅲ之间添加如图中的

(5)装置Ⅴ的目的是防止尾气污染,写出装置Ⅴ中发生反应的离子方程式
您最近一年使用:0次
名校
解题方法
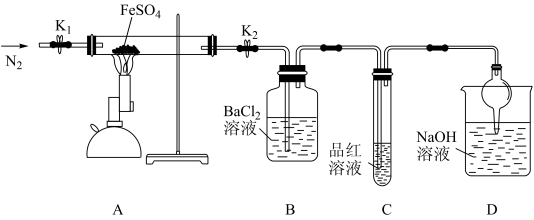
4 . 硫酸亚铁可用于治疗缺铁性贫血症。某兴趣小组为探究硫酸亚铁的分解产物,设计实验方案如下:
①先按要求搭配好装置再检查装置的气密性;
②打开弹簧夹K1和K2,向装置中缓缓通入N2一段时间后,加热装有 的硬质玻璃管;
的硬质玻璃管;
③观察到的实验现象:A装置中有红棕色固体出现,B中有白色沉淀生成,C中品红溶液褪色;
④冷却后A装置中剩余固体的质量为10.88g。

(1)根据B、C装置中的实验现象可推测分解产物中含有___________ 和___________ 。
(2)将装置B、C顺序颠倒能否达到原来的实验目的___________ (填“能”或“不能”),原因是___________ 。
(3)D装置中发生的主要反应的离子方程式是___________ 。
(4)通过计算确定已分解的FeSO4物质的量(写出计算过程)___________ 。
①先按要求搭配好装置再检查装置的气密性;
②打开弹簧夹K1和K2,向装置中缓缓通入N2一段时间后,加热装有
 的硬质玻璃管;
的硬质玻璃管;③观察到的实验现象:A装置中有红棕色固体出现,B中有白色沉淀生成,C中品红溶液褪色;
④冷却后A装置中剩余固体的质量为10.88g。

(1)根据B、C装置中的实验现象可推测分解产物中含有
(2)将装置B、C顺序颠倒能否达到原来的实验目的
(3)D装置中发生的主要反应的离子方程式是
(4)通过计算确定已分解的FeSO4物质的量(写出计算过程)
您最近一年使用:0次
2024-03-15更新
|
148次组卷
|
2卷引用:江苏省盐城市建湖高级中学2023-2024学年高一下学期期初测试(2月)化学试题
解题方法
5 . 硫酸亚铁可用于治疗缺铁性贫血症。某兴趣小组为探究硫酸亚铁的分解产物,设计实验方案如下:
①先按要求搭配好装置再检查装置的气密性;
②打开弹簧夹K1和K2,向装置中缓缓通入N2一段时间后,加热装有 的硬质玻璃管;
的硬质玻璃管;
③观察到的实验现象:A装置中有红棕色固体出现,B中有白色沉淀生成,C中品红溶液褪色;
④冷却后A装置中剩余固体的质量为10.88g。
(1)根据B、C装置中的实验现象可推测分解产物中含有_______ 和_______ 。
(2)将装置B、C顺序颠倒能否达到原来的实验目的_______ (填“能”或“不能”),原因是_______ 。
(3)D装置中发生的主要反应的离子方程式是_______ 。
(4)通过计算确定剩余10.88g固体的成分,写出计算过程。______
①先按要求搭配好装置再检查装置的气密性;
②打开弹簧夹K1和K2,向装置中缓缓通入N2一段时间后,加热装有
 的硬质玻璃管;
的硬质玻璃管;③观察到的实验现象:A装置中有红棕色固体出现,B中有白色沉淀生成,C中品红溶液褪色;
④冷却后A装置中剩余固体的质量为10.88g。

(1)根据B、C装置中的实验现象可推测分解产物中含有
(2)将装置B、C顺序颠倒能否达到原来的实验目的
(3)D装置中发生的主要反应的离子方程式是
(4)通过计算确定剩余10.88g固体的成分,写出计算过程。
您最近一年使用:0次
名校
6 . 实验室进行 制备和性质探究,下列实验原理和装置
制备和性质探究,下列实验原理和装置不 能达到实验目的的是
 制备和性质探究,下列实验原理和装置
制备和性质探究,下列实验原理和装置| A | B | C | D |
|
|
|
|
制备 | 探究 溶解性 溶解性 | 探究 氧化性 氧化性 | 吸收尾气 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2023-12-05更新
|
481次组卷
|
3卷引用:江苏省镇江市2023-2024学年高三上学期期中考试化学试题
7 . 甲同学通过查询资料知道,一定浓度的硝酸与镁反应时,可得到二氧化氮、一氧化氮、氮气三种气体。该同学用下列仪器组装装置来直接验证有二氧化氮、一氧化氮生成并制取氮化镁 (假设实验中每步转化均是完全的) 。查阅文献得知:
①二氧化氮沸点为21.1 ℃、熔点为-11 ℃,一氧化氮沸点为-151 ℃、熔点为-164 ℃;
②镁也能与二氧化碳反应;
③氮化镁遇水反应生成氢氧化镁和氨气。
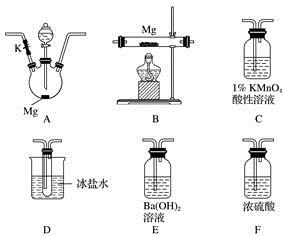
(1)实验中先打开开关K,通过导管向装置内通入二氧化碳气体以排出装置内的空气,停止通入二氧化碳的标志是________________________________ 。
(2)为实现上述实验目的,所选用的仪器的正确连接方式是A→____________ →E,确定还原产物中有二氧化氮的现象是______________________________________ ,实验中要多次使用装置F,第二次使用F的目的是______________________________________________ 。
(3)实验过程中,发现在D中产生预期现象的同时,C中溶液颜色慢慢褪去,试写出C中反应的离子方程式:________________________________ 。
(4)甲同学在A中开始反应时,马上点燃B处的酒精灯,实验结束后通过测试发现B处的产品纯度不高,原因是______________________________________ 。
(5)设计一种实验方案,验证镁与硝酸反应时确实有氮气生成:__________________________ 。
①二氧化氮沸点为21.1 ℃、熔点为-11 ℃,一氧化氮沸点为-151 ℃、熔点为-164 ℃;
②镁也能与二氧化碳反应;
③氮化镁遇水反应生成氢氧化镁和氨气。

(1)实验中先打开开关K,通过导管向装置内通入二氧化碳气体以排出装置内的空气,停止通入二氧化碳的标志是
(2)为实现上述实验目的,所选用的仪器的正确连接方式是A→
(3)实验过程中,发现在D中产生预期现象的同时,C中溶液颜色慢慢褪去,试写出C中反应的离子方程式:
(4)甲同学在A中开始反应时,马上点燃B处的酒精灯,实验结束后通过测试发现B处的产品纯度不高,原因是
(5)设计一种实验方案,验证镁与硝酸反应时确实有氮气生成:
您最近一年使用:0次
2016-12-09更新
|
1384次组卷
|
10卷引用:2015-2016学年江苏省扬州中学高一下期中化学试卷
2015-2016学年江苏省扬州中学高一下期中化学试卷2016届湖北省沙市中学高三下第一次半月考理综化学试卷(已下线)同步君 必修1 第4章 第4节 硝酸高中化学人教版 必修1 第四章 非金属及其化合物 4.氨 硫酸 硝酸 硝酸云南省元江县一中2018-2019学年高一上学期12月考试化学试题贵州省剑河县二中2018-2019学年高一上学期期末考试化学试题内蒙古集宁一中2019-2020学年高二下学期第二次月考化学试题山西省忻州市静乐县第一中学2019-2020学年高二下学期第一次月考化学试题云南省玉溪市通海二中2020-2021学年高一下学期期中考试化学试题辽宁省沈阳市第一二〇中学2021-2022学年高一下学期线上教学质量检测期中考试化学试题
8 . 实验室利用下列装置,按照 的制备、净化、收集、性质检验及尾气处理的顺序进行实验.
的制备、净化、收集、性质检验及尾气处理的顺序进行实验.
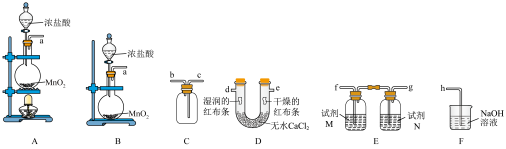
回答下列问题:
(1)制备 的装置应选用装置
的装置应选用装置______ (填“A”或“B”);盛放浓盐酸的仪器名称为______ .
(2)该实验中制备 的化学方程式为
的化学方程式为______ .
(3)该实验正确的连接顺序为a→______ (按气流方向,用小写字母表示).
(4)试剂M和试剂N分别为______ 、______ .
(5)能证明只有潮湿的氯气才具有漂白性的实验现象为______ .
(6)利用装置F吸收多余的 时,发生反应的离子方程式为
时,发生反应的离子方程式为______ .
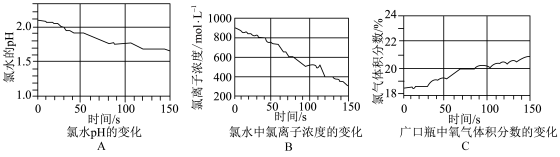
(7)某同学将装置C中收集的氯气溶于水制备氯水,并进一步探究氯水中次氯酸的稳定性.
实验操作为:先将制备的氯水分为三等份,分别倒入广口瓶中,再将pH传感器、氯离子传感器、氧气传感器分别与数据采集器、计算机连接,将三种传感器分别插入广口瓶中,用强光照射氯水,同时采集实验数据.
下面是该同学完成实验报告时画出的坐标图.其中与次氯酸光照分解事实不符的是______ (填序号).
 的制备、净化、收集、性质检验及尾气处理的顺序进行实验.
的制备、净化、收集、性质检验及尾气处理的顺序进行实验.
回答下列问题:
(1)制备
 的装置应选用装置
的装置应选用装置(2)该实验中制备
 的化学方程式为
的化学方程式为(3)该实验正确的连接顺序为a→
(4)试剂M和试剂N分别为
(5)能证明只有潮湿的氯气才具有漂白性的实验现象为
(6)利用装置F吸收多余的
 时,发生反应的离子方程式为
时,发生反应的离子方程式为(7)某同学将装置C中收集的氯气溶于水制备氯水,并进一步探究氯水中次氯酸的稳定性.
实验操作为:先将制备的氯水分为三等份,分别倒入广口瓶中,再将pH传感器、氯离子传感器、氧气传感器分别与数据采集器、计算机连接,将三种传感器分别插入广口瓶中,用强光照射氯水,同时采集实验数据.
下面是该同学完成实验报告时画出的坐标图.其中与次氯酸光照分解事实不符的是

您最近一年使用:0次
2023-12-22更新
|
127次组卷
|
2卷引用:江苏省徐州市青桐鸣大联考2023-2024学年高一上学期12月月考化学试卷
9 . 过二硫酸钠( )也叫高硫酸钠,可用于废气处理及有害物质的氧化降解。用
)也叫高硫酸钠,可用于废气处理及有害物质的氧化降解。用 溶液和一定浓度的NaOH溶液混合可制得
溶液和一定浓度的NaOH溶液混合可制得 晶体。实验室制备
晶体。实验室制备 晶体的装置如下图所示:
晶体的装置如下图所示: 。
。
(1)写出装置中生成 的反应的化学方程式:
的反应的化学方程式:___________ 。
(2)盛装NaOH溶液的仪器名称为___________ ,持续通入氮气的目的是___________ 。
(3)装置中硫酸的作用是___________ 。
(4)某兴趣小组设计实验探究不同环境下 氧化性的强弱。将
氧化性的强弱。将 (1.69g)与过量
(1.69g)与过量 (10g)溶于水中形成的混合溶液煮沸3min,观察并记录加入试剂时和加热过程中的现象(如下表所示)。
(10g)溶于水中形成的混合溶液煮沸3min,观察并记录加入试剂时和加热过程中的现象(如下表所示)。
①在___________ (填“中性”“酸性”或“碱性”)条件下, 的氧化能力最强。
的氧化能力最强。
②若用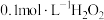 溶液滴定碱性氧化反应后的溶液(先将溶液调至酸性再滴定),滴定终点时的现象为
溶液滴定碱性氧化反应后的溶液(先将溶液调至酸性再滴定),滴定终点时的现象为___________ ;达到滴定终点时,消耗 溶液的体积为
溶液的体积为 。则碱性氧化后的溶液中
。则碱性氧化后的溶液中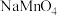 的质量为
的质量为___________ g(用含 的代数式表示,
的代数式表示,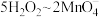 )
)
 )也叫高硫酸钠,可用于废气处理及有害物质的氧化降解。用
)也叫高硫酸钠,可用于废气处理及有害物质的氧化降解。用 溶液和一定浓度的NaOH溶液混合可制得
溶液和一定浓度的NaOH溶液混合可制得 晶体。实验室制备
晶体。实验室制备 晶体的装置如下图所示:
晶体的装置如下图所示: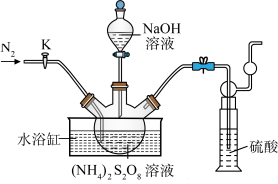
 。
。(1)写出装置中生成
 的反应的化学方程式:
的反应的化学方程式:(2)盛装NaOH溶液的仪器名称为
(3)装置中硫酸的作用是
(4)某兴趣小组设计实验探究不同环境下
 氧化性的强弱。将
氧化性的强弱。将 (1.69g)与过量
(1.69g)与过量 (10g)溶于水中形成的混合溶液煮沸3min,观察并记录加入试剂时和加热过程中的现象(如下表所示)。
(10g)溶于水中形成的混合溶液煮沸3min,观察并记录加入试剂时和加热过程中的现象(如下表所示)。| 环境 | 调节溶液氧化环境时的现象 | 加热煮沸3min期间产生的现象 |
| 中性 | 加入VmL蒸馏水,无明显现象 | 30s时开始有大量气泡冒出,3min后溶液变为深棕色,溶液中有悬浮小颗粒 |
| 碱性 | 加入VmL某浓度的NaOH溶液,瞬间变为棕色( ) ) | 10s后溶液逐渐变为深紫色( ),没有明显冒气泡现象 ),没有明显冒气泡现象 |
| 酸性 | 加入VmL稀硫酸无明显现象 | 煮沸3min后,有气泡冒出 |
 的氧化能力最强。
的氧化能力最强。②若用
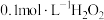 溶液滴定碱性氧化反应后的溶液(先将溶液调至酸性再滴定),滴定终点时的现象为
溶液滴定碱性氧化反应后的溶液(先将溶液调至酸性再滴定),滴定终点时的现象为 溶液的体积为
溶液的体积为 。则碱性氧化后的溶液中
。则碱性氧化后的溶液中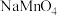 的质量为
的质量为 的代数式表示,
的代数式表示,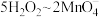 )
)
您最近一年使用:0次
名校
10 . 氯气常用于自来水的杀菌消毒,实验室常用 和浓盐酸共热制备氯气。
和浓盐酸共热制备氯气。
(1)写出该反应的化学方程式:________ ,其中氧化剂和还原剂的物质的量之比为_____ 。
(2) 固体与浓盐酸在常温下就可以反应制备氯气,反应的化学方程式为
固体与浓盐酸在常温下就可以反应制备氯气,反应的化学方程式为______ (已知酸性条件下 可被还原为
可被还原为 )。
)。
(3) 固体与浓盐酸的反应装置如图所示,同时验证氯气性质(其中夹持装置已省略)。
固体与浓盐酸的反应装置如图所示,同时验证氯气性质(其中夹持装置已省略)。
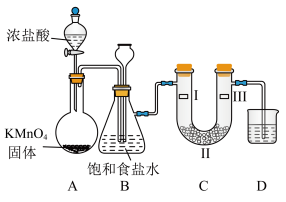
①从反应条件看, 和
和 的氧化能力不同,氧化能力较强的是
的氧化能力不同,氧化能力较强的是______ 。
②装置B的作用为_________ ;装置C中若发生堵塞,装置B中的实验现象为_______ 。
③装置C的作用是验证氯气是否具有漂白性,则装置C中Ⅰ、Ⅱ、Ⅲ处依次应放入的物质正确的是_______ 。
④D中的液体是___________ (填化学式)
(4)用氯气对自来水消毒易产生致癌物质,二氧化氯是一种更为高效安全的消毒剂。工业上制备 的反应为
的反应为 。
。
①该反应中的还原产物是______ (写化学式),反应中每生成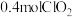 ,转移电子的数目为
,转移电子的数目为______ 。
② 在杀菌消毒的过程中会生成副产物亚氯酸盐(
在杀菌消毒的过程中会生成副产物亚氯酸盐( ),需要将其转化为
),需要将其转化为 除去,下列试剂能实现其转化过程的是
除去,下列试剂能实现其转化过程的是______ (填序号)。
A. B.
B. C.KI D.
C.KI D.
 和浓盐酸共热制备氯气。
和浓盐酸共热制备氯气。(1)写出该反应的化学方程式:
(2)
 固体与浓盐酸在常温下就可以反应制备氯气,反应的化学方程式为
固体与浓盐酸在常温下就可以反应制备氯气,反应的化学方程式为 可被还原为
可被还原为 )。
)。(3)
 固体与浓盐酸的反应装置如图所示,同时验证氯气性质(其中夹持装置已省略)。
固体与浓盐酸的反应装置如图所示,同时验证氯气性质(其中夹持装置已省略)。
①从反应条件看,
 和
和 的氧化能力不同,氧化能力较强的是
的氧化能力不同,氧化能力较强的是②装置B的作用为
③装置C的作用是验证氯气是否具有漂白性,则装置C中Ⅰ、Ⅱ、Ⅲ处依次应放入的物质正确的是
| Ⅰ | Ⅱ | Ⅲ | |
| A | 干燥的有色布条 | 碱石灰 | 湿润的有色布条 |
| B | 干燥的有色布条 | 无水硫酸铜 | 湿润的有色布条 |
| C | 湿润的有色布条 | 浓硫酸 | 干燥的有色布条 |
| D | 湿润的有色布条 | 无水氯化钙 | 干燥的有色布条 |
(4)用氯气对自来水消毒易产生致癌物质,二氧化氯是一种更为高效安全的消毒剂。工业上制备
 的反应为
的反应为 。
。①该反应中的还原产物是
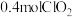 ,转移电子的数目为
,转移电子的数目为②
 在杀菌消毒的过程中会生成副产物亚氯酸盐(
在杀菌消毒的过程中会生成副产物亚氯酸盐( ),需要将其转化为
),需要将其转化为 除去,下列试剂能实现其转化过程的是
除去,下列试剂能实现其转化过程的是A.
 B.
B. C.KI D.
C.KI D.
您最近一年使用:0次