名校
解题方法
1 . 某小组同学探究不同条件下氯气与二价锰化合物的反应。资料i. 在一定条件下被
在一定条件下被 或
或 氧化成
氧化成 (棕黑色)、
(棕黑色)、 (绿色)、
(绿色)、 (紫色);ⅱ.浓碱条件下,
(紫色);ⅱ.浓碱条件下, 可被
可被 还原为
还原为 ;ⅲ.
;ⅲ. 的氧化性与溶液的酸碱性无关,
的氧化性与溶液的酸碱性无关, 的氧化性随碱性增强而减弱。
的氧化性随碱性增强而减弱。
实验装置如图(夹持装置略)。
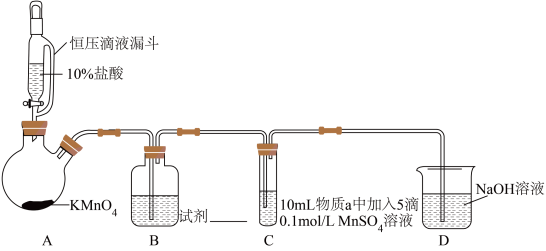
(1)B中试剂是___________ 。
(2)通 前,Ⅱ、Ⅲ中沉淀由白色变为棕黑色的化学方程式为
前,Ⅱ、Ⅲ中沉淀由白色变为棕黑色的化学方程式为___________ 。
(3)对比实验I、Ⅱ通 后的实验现象,对于二价锰化合物还原性的认识是
后的实验现象,对于二价锰化合物还原性的认识是___________ 。
(4)根据资料ⅱ,Ⅲ中应得到绿色溶液,实验中得到紫色溶液,分析现象与资料不符的原因:
原因一:可能是通入 导致溶液的碱性减弱。
导致溶液的碱性减弱。
原因二:可能是氧化剂过量氧化剂将 氧化为
氧化为 。
。
①用化学方程式表示可能导致溶液碱性减弱的原因:________ 。但通过实验测定溶液的碱性变化很小。
②取Ⅲ中放置后的 悬浊液,加入
悬浊液,加入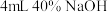 溶液,溶液紫色迅速变为绿色,且绿色缓慢加深。溶液紫色变为绿色的离子方程式为
溶液,溶液紫色迅速变为绿色,且绿色缓慢加深。溶液紫色变为绿色的离子方程式为________ ,溶液绿色缓慢加深,原因是 被
被________ (填化学式)氧化,可证明Ⅲ中的悬浊液中氧化剂过量。
③取Ⅲ中放置后的 悬浊液,加入
悬浊液,加入 水,溶液紫色缓慢加深,发生的反应是
水,溶液紫色缓慢加深,发生的反应是________ 。
 在一定条件下被
在一定条件下被 或
或 氧化成
氧化成 (棕黑色)、
(棕黑色)、 (绿色)、
(绿色)、 (紫色);ⅱ.浓碱条件下,
(紫色);ⅱ.浓碱条件下, 可被
可被 还原为
还原为 ;ⅲ.
;ⅲ. 的氧化性与溶液的酸碱性无关,
的氧化性与溶液的酸碱性无关, 的氧化性随碱性增强而减弱。
的氧化性随碱性增强而减弱。实验装置如图(夹持装置略)。

| 序号 | 物质a | C中实验现象 | |
通入 前 前 | 通入 后 后 | ||
| I | 水 | 得到无色溶液 | 产生棕黑色沉淀,且放置后不发生变化 |
| Ⅱ | 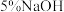 溶液 溶液 | 产生白色沉淀,在空气中缓慢变成棕黑色沉淀 | 棕黑色沉淀增多,放置后溶液变为紫色,仍有沉淀 |
| Ⅲ | 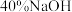 溶液 溶液 | 产生白色沉淀,在空气中缓慢变成棕黑色沉淀 | 棕黑色沉淀增多,放置后溶液变为紫色,仍有沉淀 |
(1)B中试剂是
(2)通
 前,Ⅱ、Ⅲ中沉淀由白色变为棕黑色的化学方程式为
前,Ⅱ、Ⅲ中沉淀由白色变为棕黑色的化学方程式为(3)对比实验I、Ⅱ通
 后的实验现象,对于二价锰化合物还原性的认识是
后的实验现象,对于二价锰化合物还原性的认识是(4)根据资料ⅱ,Ⅲ中应得到绿色溶液,实验中得到紫色溶液,分析现象与资料不符的原因:
原因一:可能是通入
 导致溶液的碱性减弱。
导致溶液的碱性减弱。原因二:可能是氧化剂过量氧化剂将
 氧化为
氧化为 。
。①用化学方程式表示可能导致溶液碱性减弱的原因:
②取Ⅲ中放置后的
 悬浊液,加入
悬浊液,加入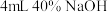 溶液,溶液紫色迅速变为绿色,且绿色缓慢加深。溶液紫色变为绿色的离子方程式为
溶液,溶液紫色迅速变为绿色,且绿色缓慢加深。溶液紫色变为绿色的离子方程式为 被
被③取Ⅲ中放置后的
 悬浊液,加入
悬浊液,加入 水,溶液紫色缓慢加深,发生的反应是
水,溶液紫色缓慢加深,发生的反应是
您最近一年使用:0次
2024-01-29更新
|
109次组卷
|
2卷引用:山东省菏泽外国语学校2023-2024学年高三上学期第一次月考化学试卷
名校
2 . 根据实验目的、操作及现象,得出的结论都正确的是
| 选项 | 实验目的 | 操作及现象 | 结论 |
| A | 比较酸性 | 向 溶液中通入 溶液中通入 气体,产生黑色沉淀 气体,产生黑色沉淀 | 酸性: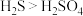 |
| B | 探究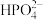 在水中的变化 在水中的变化 | 向 溶液中滴加 溶液中滴加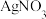 溶液产生淡黄色沉淀 溶液产生淡黄色沉淀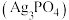 | 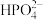 在水中发生了电离 在水中发生了电离 |
| C | 比较离子的氧化性 | 向含有KSCN的 溶液中滴加酸化的 溶液中滴加酸化的 溶液,溶液变红 溶液,溶液变红 | 氧化性: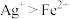 |
| D | 探究浓硫酸的性质 | 将浓硫酸、氯化钠固体、 混合加热,产生黄绿色气体 混合加热,产生黄绿色气体 | 浓硫酸具有强氧化性 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2023-12-30更新
|
215次组卷
|
2卷引用:山东省青岛市部分学校2023--2024学年高三上学期期中大联考化学试题
名校
3 . 下列对有关实验现象的解释或所得结论错误的是
| 选项 | 实验操作 | 现象 | 解释或结论 |
| A | 将NaBiO3固体加入酸性MnSO4溶液中,充分振荡 | 溶液变为紫红色 | 氧化性:BiO >MnO >MnO |
| B | 用pH计测定室温下溶液pH:①CH3COONa②NaHCO3 | pH值①<② | 碳酸酸性弱于醋酸 |
| C | 将少量铜粉加入稀硫酸中,无明显现象,再加入硝酸铁溶液 | 铜粉溶解 | Fe3+与铜粉反应 |
| D | 向NaClO溶液中滴加酚酞试液 | 溶液先变红后褪色 | NaClO发生水解反应 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
4 . 为探究类卤离子SCN-与Fe2+的还原性强弱,某同学进行了如下实验:
①分别配制0.1mol/L的KSCN溶液、FeSO4溶液;
②向0.1mol/L的KSCN溶液中滴加酸性KMnO4溶液,酸性KMnO4;溶液褪色;
③向0.1mol/L的FeSO4溶液中滴加酸性KMnO4溶液,酸性KMnO4溶液褪色;
④向等体积、浓度均为0.1mol/L的KSCN和FeSO4混合溶液中滴加酸性KMnO4溶液,溶液先变红后褪色。
下列说法错误的是
①分别配制0.1mol/L的KSCN溶液、FeSO4溶液;
②向0.1mol/L的KSCN溶液中滴加酸性KMnO4溶液,酸性KMnO4;溶液褪色;
③向0.1mol/L的FeSO4溶液中滴加酸性KMnO4溶液,酸性KMnO4溶液褪色;
④向等体积、浓度均为0.1mol/L的KSCN和FeSO4混合溶液中滴加酸性KMnO4溶液,溶液先变红后褪色。
下列说法错误的是
| A.实验①中配制FeSO4溶液应将其固体溶于稀硫酸中,并加少量还原铁粉搅匀过滤后使用 |
B.实验②中MnO 可将SCN-氧化为(SCN)2 可将SCN-氧化为(SCN)2 |
| C.实验④说明还原性:SCN->Fe2+ |
D.实验③中反应的离子方程式为MnO +5Fe2++8H+=Mn2++5Fe3++4H2O +5Fe2++8H+=Mn2++5Fe3++4H2O |
您最近一年使用:0次
2023-12-27更新
|
503次组卷
|
3卷引用:山东省实验中学2023-2024学年高三上学期11月二诊化学试题
山东省实验中学2023-2024学年高三上学期11月二诊化学试题(已下线)题型17 化学实验综合-2024年高考化学二轮热点题型归纳与变式演练(新高考通用)黑龙江省大庆市实验中学实验二部2023-2024学年高三下学期得分训练化学试卷
名校
解题方法
5 . 绿矾是含有一定量结晶水的硫酸亚铁,在工农业生产中具有重要的用途。利用下列装置对绿矾的性质进行探究。回答下列问题:
(1)为测定绿矾中硫酸亚铁含量,取mg绿矾样品于烧杯中,加入适量稀硫酸,溶解后配成250mL溶液。用___________ (填仪器名称)量取25.00mL待测液于锥形瓶中,用 的
的 标准溶液滴定至终点,平行操作三次,消耗
标准溶液滴定至终点,平行操作三次,消耗 标准溶液的平均体积为VmL。此样品中硫酸亚铁的含量为
标准溶液的平均体积为VmL。此样品中硫酸亚铁的含量为___________ %(用含m、c、V的代数式表示)。导致测定结果偏高的可能原因是___________ (填标号)。
a.量取绿矾溶液的仪器没有润洗 b.配溶液定容时俯视刻度线
c.盛放待测液的锥形瓶洗净后未干燥 d.绿矾样品结晶水部分损失
(2)为测定绿矾中结晶水含量,将石英玻璃管(装置A,带两端开关 和
和 )称重,记为
)称重,记为 。将样品装入石英玻璃管中,再次将装置A称重,记为
。将样品装入石英玻璃管中,再次将装置A称重,记为 。按下图连接好装置进行实验。
。按下图连接好装置进行实验。

①下列实验操作步骤正确排序为___________ (填标号);重复上述操作直至A恒重,记为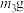 。
。
a.点燃酒精灯,加热 b.熄灭酒精灯 c.打开 和
和 ,缓缓通入
,缓缓通入
d.关闭 和
和 e.冷却至室温 f.称量A
e.冷却至室温 f.称量A
②加热A时始终保持 的通入,目的是
的通入,目的是___________ 。
③根据实验记录,计算绿矾化学式中结晶水数目x=___________ (列式表示)。若实验时按a、c次序操作,则使x___________ (填“偏大”“偏小”或“无影响”)。
(3)为探究硫酸亚铁的分解产物,将(2)中已恒重的装置A接入下图所示的装置中,打开 和
和 ,缓缓通入
,缓缓通入 ,加热。实验后反应管中残留固体为红色粉末。
,加热。实验后反应管中残留固体为红色粉末。

①硫酸亚铁高温分解反应的化学方程式为___________ 。
②C、D中的溶液依次为___________ 、___________ (填标号)。
a.浓 b.NaOH c.品红 d.
b.NaOH c.品红 d. e.
e.
(1)为测定绿矾中硫酸亚铁含量,取mg绿矾样品于烧杯中,加入适量稀硫酸,溶解后配成250mL溶液。用
 的
的 标准溶液滴定至终点,平行操作三次,消耗
标准溶液滴定至终点,平行操作三次,消耗 标准溶液的平均体积为VmL。此样品中硫酸亚铁的含量为
标准溶液的平均体积为VmL。此样品中硫酸亚铁的含量为a.量取绿矾溶液的仪器没有润洗 b.配溶液定容时俯视刻度线
c.盛放待测液的锥形瓶洗净后未干燥 d.绿矾样品结晶水部分损失
(2)为测定绿矾中结晶水含量,将石英玻璃管(装置A,带两端开关
 和
和 )称重,记为
)称重,记为 。将样品装入石英玻璃管中,再次将装置A称重,记为
。将样品装入石英玻璃管中,再次将装置A称重,记为 。按下图连接好装置进行实验。
。按下图连接好装置进行实验。
①下列实验操作步骤正确排序为
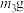 。
。a.点燃酒精灯,加热 b.熄灭酒精灯 c.打开
 和
和 ,缓缓通入
,缓缓通入
d.关闭
 和
和 e.冷却至室温 f.称量A
e.冷却至室温 f.称量A②加热A时始终保持
 的通入,目的是
的通入,目的是③根据实验记录,计算绿矾化学式中结晶水数目x=
(3)为探究硫酸亚铁的分解产物,将(2)中已恒重的装置A接入下图所示的装置中,打开
 和
和 ,缓缓通入
,缓缓通入 ,加热。实验后反应管中残留固体为红色粉末。
,加热。实验后反应管中残留固体为红色粉末。
①硫酸亚铁高温分解反应的化学方程式为
②C、D中的溶液依次为
a.浓
 b.NaOH c.品红 d.
b.NaOH c.品红 d. e.
e.
您最近一年使用:0次
解题方法
6 . 某兴趣小组探究金属与硝酸反应的还原产物,进行了下列三组实验,下列说法正确的是
| 序号 | 实验操作(室温)及实验现象 |
| ① | 将足量的铜粉加入1mL10mol∙L-1HNO3中,溶液呈绿色,产生红棕色气体 |
| ② | 将足量的铜粉加入100mL0.1mol∙L-1HNO3中,溶液呈蓝色,产生无色气体 |
| ③ | 将足量的铁粉加入1mL0.1 mol∙L-1HNO3中,溶液呈浅绿色,无气体产生 |
| A.实验①②反应后溶液颜色不同,说明氧化产物不同 |
| B.实验②中产生的气体可用向上排空气法收集 |
| C.实验③中硝酸可能被还原成铵盐 |
| D.以上实验说明硝酸的还原产物与硝酸的浓度及金属的活泼性有关 |
您最近一年使用:0次
2022·北京·高考真题
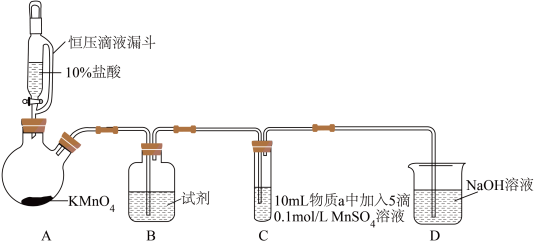
7 . 某小组同学探究不同条件下氯气与二价锰化合物的反应。
资料:ⅰ、Mn2+在一定条件下被Cl2或ClO-氧化成MnO2(棕黑色)、MnO (绿色)、MnO
(绿色)、MnO (紫色)。
(紫色)。
ⅱ、浓碱条件下,MnO 可被OH-还原为MnO
可被OH-还原为MnO 。
。
ⅲ、Cl2的氧化性与溶液的酸碱性无关,NaClO的氧化性随碱性增强而减弱。
实验装置如图(夹持装置略):
(1)B中试剂是_____ 。
(2)通入Cl2前,实验Ⅱ、Ⅲ中沉淀由白色变为棕黑色的化学方程式为_____ 。
(3)对比实验Ⅰ、Ⅱ通入Cl2后的实验现象,对于二价锰化合物还原性的认识是_____ 。
(4)根据资料ⅱ,实验Ⅲ中应得到绿色溶液,实验中得到紫色溶液,分析现象与资料不符的原因:
原因一:可能是通入Cl2导致溶液的碱性减弱。
原因二:可能是氧化剂过量,氧化剂将MnO 氧化为MnO
氧化为MnO 。
。
①用化学方程式表示可能导致溶液碱性减弱的原因:_____ ,但通过实验测定溶液的碱性变化很小。
②取实验Ⅲ中放置后的1mL悬浊液,加入4mL40%NaOH溶液,溶液紫色迅速变为绿色,且绿色缓慢加深。溶液紫色变为绿色的离子方程式为_____ ,溶液绿色缓慢加深,原因是MnO2被_____ (填化学式)氧化,可证明实验Ⅲ的悬浊液中氧化剂过量。
③取实验Ⅱ中放置后的1mL悬浊液,加入4mL水,溶液紫色缓慢加深,发生反应的离子方程式是_____ 。
④从反应速率的角度,分析实验Ⅲ未得到绿色溶液的可能原因:_____ 。
资料:ⅰ、Mn2+在一定条件下被Cl2或ClO-氧化成MnO2(棕黑色)、MnO
 (绿色)、MnO
(绿色)、MnO (紫色)。
(紫色)。ⅱ、浓碱条件下,MnO
 可被OH-还原为MnO
可被OH-还原为MnO 。
。ⅲ、Cl2的氧化性与溶液的酸碱性无关,NaClO的氧化性随碱性增强而减弱。
实验装置如图(夹持装置略):
| 实验 | 物质a | C中实验现象 | |
| 通入Cl2前 | 通入Cl2后 | ||
| Ⅰ | 水 | 得到无色溶液 | 产生棕黑色沉淀,且放置后不发生变化 |
| Ⅱ | 5%NaOH溶液 | 产生白色沉淀,在空气中缓慢变成棕黑色沉淀 | 棕黑色沉淀增多,放置后溶液变为紫色,仍有沉淀 |
| Ⅲ | 40%NaOH溶液 | 产生白色沉淀,在空气中缓慢变成棕黑色沉淀 | 棕黑色沉淀增多,放置后溶液变为紫色,仍有沉淀 |
(2)通入Cl2前,实验Ⅱ、Ⅲ中沉淀由白色变为棕黑色的化学方程式为
(3)对比实验Ⅰ、Ⅱ通入Cl2后的实验现象,对于二价锰化合物还原性的认识是
(4)根据资料ⅱ,实验Ⅲ中应得到绿色溶液,实验中得到紫色溶液,分析现象与资料不符的原因:
原因一:可能是通入Cl2导致溶液的碱性减弱。
原因二:可能是氧化剂过量,氧化剂将MnO
 氧化为MnO
氧化为MnO 。
。①用化学方程式表示可能导致溶液碱性减弱的原因:
②取实验Ⅲ中放置后的1mL悬浊液,加入4mL40%NaOH溶液,溶液紫色迅速变为绿色,且绿色缓慢加深。溶液紫色变为绿色的离子方程式为
③取实验Ⅱ中放置后的1mL悬浊液,加入4mL水,溶液紫色缓慢加深,发生反应的离子方程式是
④从反应速率的角度,分析实验Ⅲ未得到绿色溶液的可能原因:
您最近一年使用:0次
2023-11-29更新
|
853次组卷
|
29卷引用:山东省日照神州天立高级中学高复部2023-2024学年高三上学期12月份阶段性测试化学试题
山东省日照神州天立高级中学高复部2023-2024学年高三上学期12月份阶段性测试化学试题突破超重点 高效突破综合实验 实验4 创新探究实验角度1控制变量法探究(已下线)题型46 实验原理探究型综合实验(已下线)专题19 实验综合题(已下线)专题19 实验综合题(已下线)考点09 氯及其化合物(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)(已下线)第11讲 氯气和卤族元素(已下线)专题15 化学实验综合题-2023年高考化学真题题源解密(新高考专用)(已下线)专题14 化学实验综合题-2023年高考化学真题题源解密(全国通用)(已下线)考点14 氯及其化合物(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)(已下线)考点48 实验方案设计与评价(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)(已下线)考点4 化学实验方案设计与探究 (核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)北京一零一中学2023-2024学年高三上学期11月统练五化学试题(已下线)微专题 物质性质综合实验探究北京市日坛中学2023-2024学年高三上学期10月检测化学试题北京师范大学第二附属中学2023-2024学年高三上学期期中考试化学试题(已下线)2022年北京市高考真题化学试题(部分试题)(已下线)考点53 化学实验方案设计与评价-备战2023年高考化学一轮复习考点帮(全国通用)四川省成都市树德中学2022-2023学年高三上学期入学考试理综化学试题2022年北京市高考真题化学试题(已下线)第28讲 定性、定量实验(讲)-2023年高考化学一轮复习讲练测(新教材新高考)(已下线)2022年北京高考真题变式题1-14(已下线)易错点09 氯元素及其化合物-备战2023年高考化学考试易错题(已下线)专题三 离子反应-实战高考·二轮复习核心突破(已下线)2022年北京高考真题化学试题变式题(实验探究题)(已下线)第18练 化学实验综合题 -2023年【暑假分层作业】高二化学(2024届一轮复习通用)江苏省苏州市工业园区星海实验高级中学2023-2024学年高一上学期12月调研化学试题新疆乌鲁木齐市第101中学2022-2023学年高一上学期12月月考化学试题
名校
8 . 某化学兴趣小组同学为探究化合物 的稳定性进行如下操作:
的稳定性进行如下操作:

下列分析正确的是
 的稳定性进行如下操作:
的稳定性进行如下操作:
下列分析正确的是
| A.气体a是二氧化碳 | B.固体c是四氧化三铁 |
| C.白色沉淀的质量为2.00g | D.d中滴加 褪色,d中存在 褪色,d中存在 |
您最近一年使用:0次
2023-11-16更新
|
615次组卷
|
3卷引用:山东省德州市2023-2024学年高三上学期期中考试化学试题
名校
解题方法
9 . 硫的化合物在生产、生活中应用广泛。
I.某兴趣小组探究 气体还原
气体还原 、
、 。
。
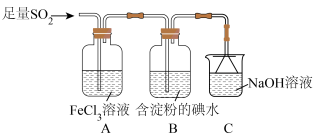
(1)通入足量 后,装置B中的现象是
后,装置B中的现象是___________ ;装置C的作用是___________ 。
(2)该小组同学认为 与
与 溶液发生的是氧化还原反应。写出
溶液发生的是氧化还原反应。写出 与
与 溶液反应的离子方程式:
溶液反应的离子方程式:___________ 。
II.实验室可用如图装皿(略去部分夹持仪器)制取 并验证其性质。
并验证其性质。
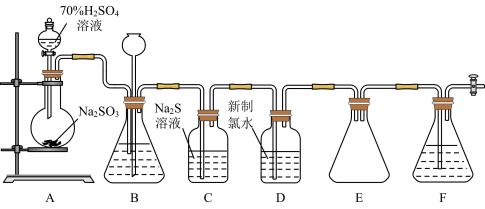
(3)盛装 的仪器名称为
的仪器名称为___________ 。
(4)装置B的作用之一是通过观察产生气泡的多少判断 生成的快慢,其中的液体最好选择
生成的快慢,其中的液体最好选择___________ (填字母)。
a.蒸馏水 b.饱和 溶液 c.饱和
溶液 c.饱和 溶液 d.饱和NaOH溶液
溶液 d.饱和NaOH溶液
(5)为验证二氧化硫的还原性,充分反应后,取装置D中的溶液分成三份,分别进行如下实验:
方案I:向第一份溶液中加入 溶液,有白色沉淀生成;
溶液,有白色沉淀生成;
方案II:向第二份溶液中加入品红溶液,红色褪去;
方案III:向第三份溶液中加入 溶液,产生白色沉淀。
溶液,产生白色沉淀。
上述方案合理的是方案___________ (填“I”“II”或“III”);装置D中发生反应的离子方程式为___________ 。
I.某兴趣小组探究
 气体还原
气体还原 、
、 。
。
(1)通入足量
 后,装置B中的现象是
后,装置B中的现象是(2)该小组同学认为
 与
与 溶液发生的是氧化还原反应。写出
溶液发生的是氧化还原反应。写出 与
与 溶液反应的离子方程式:
溶液反应的离子方程式:II.实验室可用如图装皿(略去部分夹持仪器)制取
 并验证其性质。
并验证其性质。
(3)盛装
 的仪器名称为
的仪器名称为(4)装置B的作用之一是通过观察产生气泡的多少判断
 生成的快慢,其中的液体最好选择
生成的快慢,其中的液体最好选择a.蒸馏水 b.饱和
 溶液 c.饱和
溶液 c.饱和 溶液 d.饱和NaOH溶液
溶液 d.饱和NaOH溶液(5)为验证二氧化硫的还原性,充分反应后,取装置D中的溶液分成三份,分别进行如下实验:
方案I:向第一份溶液中加入
 溶液,有白色沉淀生成;
溶液,有白色沉淀生成;方案II:向第二份溶液中加入品红溶液,红色褪去;
方案III:向第三份溶液中加入
 溶液,产生白色沉淀。
溶液,产生白色沉淀。上述方案合理的是方案
您最近一年使用:0次
10 . 为检验溶液中是否含有Cl⁻,某同学向溶液中先加HNO3,再加AgNO3,若有白色沉淀生成,则证明有Cl⁻。对此结论,有人提出了质疑:溶液中可能有SO ,并设计了如下探究性实验。
,并设计了如下探究性实验。
实验一:向Na2SO4溶液中滴加AgNO3溶液
(1)实验一中产生沉淀的离子方程式为_______ 。
(2)已知:25℃时,Ksp(Ag2SO4)=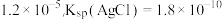 实验一中编号④无明显变化,若要产生浑浊,溶液中c(SO
实验一中编号④无明显变化,若要产生浑浊,溶液中c(SO )理论上至少需达到
)理论上至少需达到_______ mol·L-1。若向1mL某浓度的NaCl与Na2SO4的混合溶液中加入3滴 溶液,分析上面数据,下列说法正确的是
溶液,分析上面数据,下列说法正确的是_______ (填标号)。
A.混合液中 时不会产生Ag2SO4沉淀
时不会产生Ag2SO4沉淀
B.混合液中 时不会产生Ag2SO4沉淀
时不会产生Ag2SO4沉淀
C.无论SO 浓度大小,都会产生Ag2SO4沉淀
浓度大小,都会产生Ag2SO4沉淀
D.若使用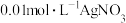 溶液,可基本排除SO
溶液,可基本排除SO 对Cl⁻检验构成的干扰
对Cl⁻检验构成的干扰
将实验一编号③中的理论计算结果与现象对照,发现理论上大部分Ag+应该形成沉淀,这与“有些许浑浊”的现象相矛盾。为探究真相,在实验一的基础上继续设计了以下实验。
实验二:
(3)对于Ag2SO4溶于硝酸的原因提出了如下假设,请完成假设二。
假设一:NO 对Ag2SO4溶解起作用。
对Ag2SO4溶解起作用。
假设二:_______ 。
(4)选择合适的试剂并设计实验方案,分别验证假设一和假设二是否成立。请补充完整实验操作和现象。
(5)通过(4)的实验,请用平衡理论解释Ag2SO4溶解的原因:_______ 。(已知:H2SO4=H++HSO 、HSO
、HSO =H++SO
=H++SO )
)
 ,并设计了如下探究性实验。
,并设计了如下探究性实验。实验一:向Na2SO4溶液中滴加AgNO3溶液
| 编号 | Na2SO4溶液 | AgNO3溶液 | 混合后Ag+浓度/(mol·L-1) | 现象 | ||
| 体积/mL | 浓度/(mol·L-1) | 体积/滴 | 浓度/(mol·L-1) | |||
| ① | 1 | 1 | 3 | 2 | 0.2 | 出现大量白色沉淀 |
| ② | 1 | 1 | 3 | 0.5 | 0.05 | 出现少量白色沉淀 |
| ③ | 1 | 1 | 3 | 0.1 | 0.01 | 有些许浑浊 |
| ④ | 1 | 1 | 3 | 0.01 | 0.001 | 无明显变化 |
(2)已知:25℃时,Ksp(Ag2SO4)=
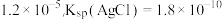 实验一中编号④无明显变化,若要产生浑浊,溶液中c(SO
实验一中编号④无明显变化,若要产生浑浊,溶液中c(SO )理论上至少需达到
)理论上至少需达到 溶液,分析上面数据,下列说法正确的是
溶液,分析上面数据,下列说法正确的是A.混合液中
 时不会产生Ag2SO4沉淀
时不会产生Ag2SO4沉淀B.混合液中
 时不会产生Ag2SO4沉淀
时不会产生Ag2SO4沉淀C.无论SO
 浓度大小,都会产生Ag2SO4沉淀
浓度大小,都会产生Ag2SO4沉淀D.若使用
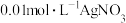 溶液,可基本排除SO
溶液,可基本排除SO 对Cl⁻检验构成的干扰
对Cl⁻检验构成的干扰将实验一编号③中的理论计算结果与现象对照,发现理论上大部分Ag+应该形成沉淀,这与“有些许浑浊”的现象相矛盾。为探究真相,在实验一的基础上继续设计了以下实验。
实验二:
| 编号 | AgNO3溶液浓度/(mol·L-1) | 现象 | 滴加硝酸后的现象 |
| ① | 2 | 出现大量白色沉淀 | 滴加稀硝酸,沉淀大量溶解;改加浓硝酸,沉淀较快消失 |
| ② | 0.5 | 出现少量白色沉淀 | 滴加稀硝酸,沉淀基本消失 |
假设一:NO
 对Ag2SO4溶解起作用。
对Ag2SO4溶解起作用。假设二:
(4)选择合适的试剂并设计实验方案,分别验证假设一和假设二是否成立。请补充完整实验操作和现象。
| 步骤 | 操作 | 现象 | 结论 |
| 步骤① | 取少量Ag2SO4于试管中,加入2mL水,振荡 | 固体不溶解 | |
| 步骤② | 将①的浊液分成两等份 | ||
| 步骤③ | 向其中一份加入1mL0.1mol·L-1NaNO3溶液,振荡 | 假设一不成立 | |
| 步骤④ | 向另一份加入 | 假设二成立 |
 、HSO
、HSO =H++SO
=H++SO )
)
您最近一年使用:0次
2023-07-06更新
|
93次组卷
|
2卷引用: 山东省泰安肥城市2023-2024学年高三9月阶段测试化学试题



