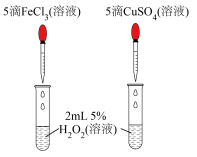
1 . 下列实验装置或现象正确且能达到实验目的的是
|
|
| A.制备Fe(OH)3胶体 | B.形成红色喷泉 |
|
|
| C.收集NO气体 | D.比较Fe3+和Cu2+催化效果 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2 . 下列关于溴苯制备,并验证反应类型的实验,说法正确的是
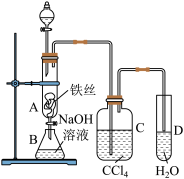
| A.分液漏斗中的试剂是苯和水的混合物 |
| B.B中NaOH用于反应后萃取产品溴苯 |
| C.CCl4中可观察到分层现象 |
| D.反应结束后还需向D中加入AgNO3溶液或石蕊 |
您最近一年使用:0次
2023-12-04更新
|
328次组卷
|
4卷引用:云南省昆明市第一中学2023-2024学年高二下学期4月月考化学试题
云南省昆明市第一中学2023-2024学年高二下学期4月月考化学试题(已下线)2.3.1 芳香烃(巩固)(已下线)2.3.2苯的同系物上海市新中高级中学2023-2024学年高二上学期期中考试化学试题
解题方法
3 . Ⅰ.为观察亚硫酸钠和浓硫酸的反应现象并探究 与
与 之间的氧化还原反应,某化学兴趣小组按如图装置进行实验(夹持、加热仪器已略去)。请回答下列问题:
之间的氧化还原反应,某化学兴趣小组按如图装置进行实验(夹持、加热仪器已略去)。请回答下列问题:______ 。
(2)该实验过程中空气会对实验造成干扰,滴加浓硫酸之前应进行的操作是____________ 。
(3)装置 产生的现象是
产生的现象是_________________________ ,其中 与
与 溶液反应的离子方程式为
溶液反应的离子方程式为________________________ ,体现了的
______ 性。
(4) 溶液同样也可用于脱硫,主要利用次氯酸钠的氧化性可将二氧化硫氧化为
溶液同样也可用于脱硫,主要利用次氯酸钠的氧化性可将二氧化硫氧化为 ,请写出脱硫(
,请写出脱硫( )反应的离子方程式:
)反应的离子方程式:____________ 。
Ⅱ.我国国家标准规定葡萄酒中的最大使用量为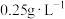 。该小组测定某干白葡萄酒中的含量(以游离计),将
。该小组测定某干白葡萄酒中的含量(以游离计),将 葡萄酒和足量盐酸共热,使全部逸出并与
葡萄酒和足量盐酸共热,使全部逸出并与 完全反应,除去过量的
完全反应,除去过量的 后,与
后,与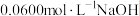 标准溶液反应,恰好消耗
标准溶液反应,恰好消耗 溶液
溶液 ,请回答:
,请回答:
(5)该葡萄酒中 的含量为
的含量为______  ,该测定结果比实际值偏高,原因是
,该测定结果比实际值偏高,原因是________________________ 。
 与
与 之间的氧化还原反应,某化学兴趣小组按如图装置进行实验(夹持、加热仪器已略去)。请回答下列问题:
之间的氧化还原反应,某化学兴趣小组按如图装置进行实验(夹持、加热仪器已略去)。请回答下列问题:
(2)该实验过程中空气会对实验造成干扰,滴加浓硫酸之前应进行的操作是
(3)装置
 产生的现象是
产生的现象是 与
与 溶液反应的离子方程式为
溶液反应的离子方程式为
(4)
 溶液同样也可用于脱硫,主要利用次氯酸钠的氧化性可将二氧化硫氧化为
溶液同样也可用于脱硫,主要利用次氯酸钠的氧化性可将二氧化硫氧化为 ,请写出脱硫(
,请写出脱硫( )反应的离子方程式:
)反应的离子方程式:Ⅱ.我国国家标准规定葡萄酒中的最大使用量为
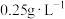 。该小组测定某干白葡萄酒中的含量(以游离计),将
。该小组测定某干白葡萄酒中的含量(以游离计),将 葡萄酒和足量盐酸共热,使全部逸出并与
葡萄酒和足量盐酸共热,使全部逸出并与 完全反应,除去过量的
完全反应,除去过量的 后,与
后,与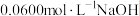 标准溶液反应,恰好消耗
标准溶液反应,恰好消耗 溶液
溶液 ,请回答:
,请回答:(5)该葡萄酒中
 的含量为
的含量为 ,该测定结果比实际值偏高,原因是
,该测定结果比实际值偏高,原因是
您最近一年使用:0次
名校
解题方法
4 . 某实验小组为了证明过氧化钠可在呼吸面具和潜水艇中做供氧剂,设计了如图实验装置进行实验,则下列说法不正确的是
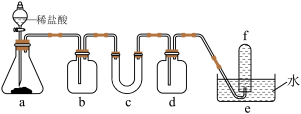
A.c中盛放的是 ,装置中会发生2个反应 ,装置中会发生2个反应 |
B.b中盛放的是浓硫酸,作用是干燥 |
| C.c中会观察到固体颜色逐渐变白,伴有发热的现象 |
D.d中盛放的是NaOH溶液,作用是吸收多余的 |
您最近一年使用:0次
2023-12-06更新
|
147次组卷
|
3卷引用:云南省丽江润泽高级中学2023-2024学年高一下学期开学考试化学试题
名校
解题方法
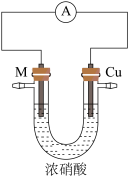
5 . 某小组设计实验探究某常见金属 与硝酸反应。
与硝酸反应。
实验(一) 与浓硝酸反应。
与浓硝酸反应。
取金属 片和铜片在浓硝酸中构成原电池,如图所示。
片和铜片在浓硝酸中构成原电池,如图所示。
_________ 。
(2)符合实验现象的金属 可以是
可以是_________ (填一种金属的化学式即可)。
(3)若 为铁,探究铁极表面的物质组成。实验完毕,用蒸馏水清洗铁电极后,将该铁电极浸泡于盐酸中一段时间,将得到的溶液分成甲、乙两份,进行如下实验:
为铁,探究铁极表面的物质组成。实验完毕,用蒸馏水清洗铁电极后,将该铁电极浸泡于盐酸中一段时间,将得到的溶液分成甲、乙两份,进行如下实验:
已知 遇
遇 溶液会产生蓝色沉淀,则关于铁极表面物质的推断合理的是 (填字母)。
溶液会产生蓝色沉淀,则关于铁极表面物质的推断合理的是 (填字母)。
实验(二)铁与极稀硝酸反应。
已知: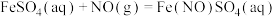 (棕色)。
(棕色)。 中溶液变棕色,装置D中黑色粉末变为红色,装置E中白色粉末变为蓝色。实验完毕后,取少量装置
中溶液变棕色,装置D中黑色粉末变为红色,装置E中白色粉末变为蓝色。实验完毕后,取少量装置 中溶液,加入浓
中溶液,加入浓 溶液,加热,产生的气体使湿润的红色石蕊试纸变蓝色。
溶液,加热,产生的气体使湿润的红色石蕊试纸变蓝色。
(4)根据装置 、
、 现象可知,装置A中还原产物有
现象可知,装置A中还原产物有_________ (填化学式),产生该气体的原因是_________ 。
(5)假设上述实验生成三种还原产物且物质的量之比为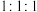 ,
, 完全反应转移
完全反应转移 电子。写出该反应的离子方程式:
电子。写出该反应的离子方程式:_________ 。
 与硝酸反应。
与硝酸反应。实验(一)
 与浓硝酸反应。
与浓硝酸反应。取金属
 片和铜片在浓硝酸中构成原电池,如图所示。
片和铜片在浓硝酸中构成原电池,如图所示。步骤 | 操作及现象 | 记录 |
① | 安装如图装置,加入试剂进行反应,电流表指针偏转 | 电流强度(Ⅰ)为 |
② | 随着反应进行,电流表指针偏转角度减小 |
|
③ | 电流表指针向反方向偏转 | 电流强度(Ⅰ)为 |
(2)符合实验现象的金属
 可以是
可以是(3)若
 为铁,探究铁极表面的物质组成。实验完毕,用蒸馏水清洗铁电极后,将该铁电极浸泡于盐酸中一段时间,将得到的溶液分成甲、乙两份,进行如下实验:
为铁,探究铁极表面的物质组成。实验完毕,用蒸馏水清洗铁电极后,将该铁电极浸泡于盐酸中一段时间,将得到的溶液分成甲、乙两份,进行如下实验:实验 | 操作 | 现象 |
ⅰ | 向甲中滴加 | 无明显现象 |
ⅱ | 向乙中滴加 | 产生蓝色沉淀 |
 遇
遇 溶液会产生蓝色沉淀,则关于铁极表面物质的推断合理的是 (填字母)。
溶液会产生蓝色沉淀,则关于铁极表面物质的推断合理的是 (填字母)。A.一定是 | B.一定不含 价铁 价铁 | C.一定是 | D.可能是 |
实验(二)铁与极稀硝酸反应。
已知:
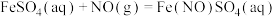 (棕色)。
(棕色)。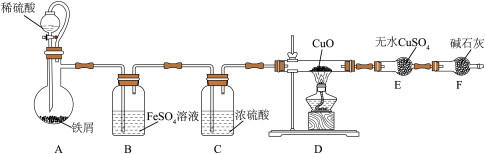
 中溶液变棕色,装置D中黑色粉末变为红色,装置E中白色粉末变为蓝色。实验完毕后,取少量装置
中溶液变棕色,装置D中黑色粉末变为红色,装置E中白色粉末变为蓝色。实验完毕后,取少量装置 中溶液,加入浓
中溶液,加入浓 溶液,加热,产生的气体使湿润的红色石蕊试纸变蓝色。
溶液,加热,产生的气体使湿润的红色石蕊试纸变蓝色。(4)根据装置
 、
、 现象可知,装置A中还原产物有
现象可知,装置A中还原产物有(5)假设上述实验生成三种还原产物且物质的量之比为
 ,
, 完全反应转移
完全反应转移 电子。写出该反应的离子方程式:
电子。写出该反应的离子方程式:
您最近一年使用:0次
名校
6 .  具有强氧化性,可作氧化剂和漂白剂。某实验小组设计以下实验制备
具有强氧化性,可作氧化剂和漂白剂。某实验小组设计以下实验制备 并探究其性质,回答下列问题:
并探究其性质,回答下列问题: 的制备
的制备
实验小组设计如图11所示装置制备 ,反应原理为
,反应原理为 。
。
(1)仪器 的名称为
的名称为______ ,仪器 的作用为
的作用为______ 。
(2)写出实验室利用 固体和
固体和 固体制备
固体制备 的化学方程式:
的化学方程式:______
(3)已知 中含有一个
中含有一个 键,则其中硫元素的化合价为
键,则其中硫元素的化合价为______ 。
Ⅱ.探究 与KI的反应
与KI的反应
实验操作:取 溶液,滴入两滴淀粉溶液,无明显变化,再加入少量
溶液,滴入两滴淀粉溶液,无明显变化,再加入少量 溶液,溶液颜色立即变蓝。
溶液,溶液颜色立即变蓝。
(4)经检验反应后的溶液中含 。写出
。写出 与
与 反应的离子方程式:
反应的离子方程式:______ 由此可得: 的氧化性
的氧化性______ (填“强于”或“弱于”) 。
。
(5)已知 可与
可与 发生反应:
发生反应: 。为进一步探究
。为进一步探究 与
与 反应的速率,该小组设计以下实验:
反应的速率,该小组设计以下实验:
实验ⅰ中溶液立即变色,实验ⅱ中溶液在 时变色。
时变色。
①实验中ⅱ
______ 。
②猜想加入 溶液后溶液变蓝的时间明显增长的可能原因:
溶液后溶液变蓝的时间明显增长的可能原因:
猜想一:______ ;
猜想二: 与
与 反应的速率远低于
反应的速率远低于 与
与 反应的速率。
反应的速率。
 具有强氧化性,可作氧化剂和漂白剂。某实验小组设计以下实验制备
具有强氧化性,可作氧化剂和漂白剂。某实验小组设计以下实验制备 并探究其性质,回答下列问题:
并探究其性质,回答下列问题: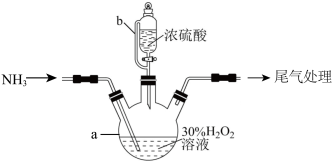
 的制备
的制备实验小组设计如图11所示装置制备
 ,反应原理为
,反应原理为 。
。(1)仪器
 的名称为
的名称为 的作用为
的作用为(2)写出实验室利用
 固体和
固体和 固体制备
固体制备 的化学方程式:
的化学方程式:(3)已知
 中含有一个
中含有一个 键,则其中硫元素的化合价为
键,则其中硫元素的化合价为Ⅱ.探究
 与KI的反应
与KI的反应实验操作:取
 溶液,滴入两滴淀粉溶液,无明显变化,再加入少量
溶液,滴入两滴淀粉溶液,无明显变化,再加入少量 溶液,溶液颜色立即变蓝。
溶液,溶液颜色立即变蓝。(4)经检验反应后的溶液中含
 。写出
。写出 与
与 反应的离子方程式:
反应的离子方程式: 的氧化性
的氧化性 。
。(5)已知
 可与
可与 发生反应:
发生反应: 。为进一步探究
。为进一步探究 与
与 反应的速率,该小组设计以下实验:
反应的速率,该小组设计以下实验:试剂 | 实验ⅰ | 实验ⅱ |
| 4.0 | 4.0 |
| 0 | 1.0 |
蒸馏水的体积 | 4.0 |
|
| 2 | 2 |
|
| 2.0 |
 时变色。
时变色。①实验中ⅱ

②猜想加入
 溶液后溶液变蓝的时间明显增长的可能原因:
溶液后溶液变蓝的时间明显增长的可能原因:猜想一:
猜想二:
 与
与 反应的速率远低于
反应的速率远低于 与
与 反应的速率。
反应的速率。
您最近一年使用:0次
名校
7 . 亚硝酸钠(NaNO2)外观酷似食盐且有咸味,是一种常用的发色剂和防腐剂。某化学兴趣小组设计实验制备NaNO2并探究其性质。
查阅资料信息:①2NO+Na2O2=2NaNO2;2NO2+Na2O2=2NaNO3。
②酸性KMnO4溶液可将低价氮的氧化物或酸根离子氧化为NO 。
。
(1)NaNO2的制备(夹持装置和加热装置均已略,已检查装置气密性)。
①若没有装置B,则装置C中Na2O2与水发生反应:_____ (写化学方程式)。
②制得的NaNO2固体中混有的杂质主要为NaNO3,改进措施是在装置A、B间添加_____ ,提高NaNO2的纯度。
③装置E中发生的主要反应的离子方程式为_____ 。
(2)验证亚硝酸钠与70%硫酸反应的气体产物为NO和NO2的混合气体。
已知:FeSO4溶液可吸收NO;NO2的沸点为21℃,熔点为-11℃。

①为了检验装置A中生成的气体产物,装置的连接顺序是A→_____ 。(按气流方向从左到右)
②反应前应打开弹簧夹1,先通入一段时间氮气,目的是_____ 。
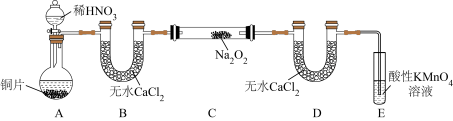
(3)测定某亚硝酸钠样品的纯度。
设该样品的杂质均不与酸性KMnO4溶液反应,可用酸性KMnO4溶液测定NaNO2的含量。称取2.0g亚硝酸钠样品溶于水配成250mL溶液,取出25.00mL溶液于锥形瓶中,再用0.1000mol•L-1的酸性KMnO4标准溶液进行滴定,消耗酸性KMnO4标准溶液的体积如表:
该亚硝酸钠样品中NaNO2的质量分数为______ 。
查阅资料信息:①2NO+Na2O2=2NaNO2;2NO2+Na2O2=2NaNO3。
②酸性KMnO4溶液可将低价氮的氧化物或酸根离子氧化为NO
 。
。(1)NaNO2的制备(夹持装置和加热装置均已略,已检查装置气密性)。

①若没有装置B,则装置C中Na2O2与水发生反应:
②制得的NaNO2固体中混有的杂质主要为NaNO3,改进措施是在装置A、B间添加
③装置E中发生的主要反应的离子方程式为
(2)验证亚硝酸钠与70%硫酸反应的气体产物为NO和NO2的混合气体。
已知:FeSO4溶液可吸收NO;NO2的沸点为21℃,熔点为-11℃。

①为了检验装置A中生成的气体产物,装置的连接顺序是A→
②反应前应打开弹簧夹1,先通入一段时间氮气,目的是
(3)测定某亚硝酸钠样品的纯度。
设该样品的杂质均不与酸性KMnO4溶液反应,可用酸性KMnO4溶液测定NaNO2的含量。称取2.0g亚硝酸钠样品溶于水配成250mL溶液,取出25.00mL溶液于锥形瓶中,再用0.1000mol•L-1的酸性KMnO4标准溶液进行滴定,消耗酸性KMnO4标准溶液的体积如表:
| 实验组 | 第一组 | 第二组 | 第三组 | 第四组 |
| 消耗酸性KMnO4标准溶液的体积/mL | 9.97 | 10.02 | 12.01 | 10.01 |
您最近一年使用:0次
2023-03-29更新
|
171次组卷
|
2卷引用:云南省大理市下关第一中学2023-2024学年高二下学期开学化学试题
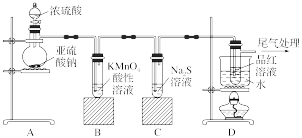
8 . 某化学兴趣小组为探究SO2的性质,按如图所示装置进行实验。
(1)装置A中盛放亚硫酸钠的仪器名称是____ ,其中发生反应的化学方程式为_____ 。
(2)实验过程中,装置B、C中发生的现象分别是_______ 、_______ ;这些现象分别说明SO2具有的性质是_______ 和_______ ;装置B中发生反应的离子方程式为_______ 。
(3)装置D的目的是探究SO2与品红反应的可逆性,请写出实验操作及现象_______ 。
(4)尾气可采用_______ 溶液吸收。
(1)装置A中盛放亚硫酸钠的仪器名称是
(2)实验过程中,装置B、C中发生的现象分别是
(3)装置D的目的是探究SO2与品红反应的可逆性,请写出实验操作及现象
(4)尾气可采用
您最近一年使用:0次
2016-12-09更新
|
5766次组卷
|
57卷引用:云南省腾冲市第八中学2023-2024学年高一下学期开学化学试题
云南省腾冲市第八中学2023-2024学年高一下学期开学化学试题云南省腾冲市第八中学2017-2018学年高一下学期第一次月考化学试题云南省普洱市景东彝族自治县第一中学2019-2020学年高二下学期期中考试理综化学试题云南省楚雄天人中学2020-2021学年高一下学期3月月考化学(B)试题云南省保山市腾冲市第八中学2020-2021学年高一下学期期中考试化学试题湖南省衡阳市衡阳县第一中学2023-2024学年高一下学期4月期中考试化学试题2010年普通高等学校招生全国统一考试理综化学部分(新课标全国I卷)2010年普通高等学校招生全国统一考试(课标Ⅰ卷)理综化学部分全解全析2010年普通高等学校招生全国统一考试(湖南卷)理综化学部分全解全析2010年高考化学试题分项专题四 离子共存和离子反应2010年高考化学试题分项专题十二 非金属元素及其化合物2010年高考化学试题分项专题十五 化学实验(已下线)2012-2013学年广东省汕头市金山中学高一下学期期末考试化学试卷(已下线)2014届贵州省六盘水市六校上学期期末联合统考理综化学试卷(已下线)2014年化学高考总复习课时演练 4-3硫及其重要化合物练习卷(已下线)2015届黑龙江省哈尔滨市第32中学高三上学期期中考试化学试卷(已下线)2015届黑龙江省绥化市三校高三上学期期中联考化学试卷2014-2015海南省文昌中学高一下学期期中段考化学(理)试卷2014-2015学年四川省成都市树德中学高一下学期期末考试化学试卷2015-2016学年广东省汕头市金山中学高一下期末化学试卷四川省资阳市2016-2017学年高一下学期期末考试化学试题黑龙江省哈尔滨市第三十二中学2018届高三上学期期中考试化学试题广西陆川县中学2018届高三期中考试化学试题(已下线)2019高考备考一轮复习精品资料 第四章 常见的非金属及其化合物 第3讲 硫及其化合物【教学案】成都龙泉第二中学2019-2020学年高二上学期入学考试化学试题黑龙江省牡丹江市第三高级中学2020届高三上学期第一次月考化学试题(已下线)考点06 典型的非金属元素及其化合物——《备战2020年高考精选考点专项突破题集》步步为赢 高一化学寒假作业:作业十四 硫和氮的氧化物2020届高三化学一轮复习 化学基础实验(选择题和大题训练)安徽省淮北市第一中学2019-2020学年高一下学期2月在线测试化学试题福建省福州市第一中学2020年高一在线自测自评质检化学试题江西省南昌市第二中学2019-2020学年高一下学期第一次月考化学试题江苏省邗江中学2019-2020学年高二(新疆班)下学期期中考试化学试题甘肃省西北师范大学附属中学2019-2020学年高一上学期期末考试化学试题辽宁省锦州市凌海市第三高级中学2019-2020学年高一6月月考化学试题(已下线)第15讲 硫及其化合物(精讲)——2021年高考化学一轮复习讲练测山东省济南市长清第一中学2020-2021学年高一上学期第三次月考化学试题(已下线)5.1.1 硫与二氧化硫(练好题)(基础过关)-2020-2021学年高一化学新教材新理念新设计同步课堂(人教2019必修第二册)陕西省榆林市第十二中学2020-2021学年高一下学期第一次月考化学试题吉林省汪清县第四中学2020-2021学年高一下学期第一次阶段考试化学试题甘肃省金昌市第一中学2020-2021学年高一下学期期中考试化学(理)试题(已下线)广东省深圳中学2020-2021学年高一下学期期中考试化学试题(已下线)微专题22 二氧化硫性质四重性探究-备战2022年高考化学考点微专题新疆伊犁市奎屯市第一高级中学2019-2020学年高二上学期期中考试化学试题湖北省安陆市第一高级中学2021-2022学年高一下学期开学考试化学试题(已下线)【期中复习】必刷题-【帮课堂】2021-2022学年高一化学同步精品讲义(人教版2019必修第二册)甘肃省会宁县第一中学2021-2022学年高一下学期期中(等级考)化学试题(已下线)【教材实验热点】06 二氧化硫的漂白性辽宁省朝阳市建平县实验中学2021-2022学年高一下学期第一次月考化学试题河南省平顶山市龙河实验高级中学2021-2022学年高一下学期期中考试化学试题安徽省池州市贵池区2021-2022学年高一下学期期中考试化学试题海南省海口嘉勋高级中学2021-2022学年高一下学期5月校考(高考班)化学试题黑龙江省大兴安岭呼玛县高级中学2021-2022学年高三上学期第一次月考化学试题内蒙古自治区第二地质中学2020-2021学年高一下学期第一次阶段检测化学试题(已下线)第01练 硫及其化合物-2023年【暑假分层作业】高一化学(人教版2019必修第二册)(已下线)第3讲 硫及其重要化合物山东新高考2022-2023学年高一上学期质量测评模拟演练化学试题



 时刻电流强度(Ⅰ)为0
时刻电流强度(Ⅰ)为0 溶液
溶液 溶液的体积
溶液的体积
 溶液的体积
溶液的体积
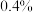 淀粉溶液的体积/滴
淀粉溶液的体积/滴 溶液的体积
溶液的体积


