名校
1 . CuCl2是常见的化学试剂,某小组利用废铜屑“湿法”制备CuCl2·2H2O并开展相关探究。
回答下列问题:
(1)仪器a的名称为___________ 。
(2)上述方法制备CuCl2的离子方程式为___________ 。
(3)为得到纯净的CuCl2·2H2O晶体,反应完全后要进行的操作是:除去其他可能的金属离子后,过滤,向滤液中持续通入 气体,加热蒸发浓缩,
气体,加热蒸发浓缩,___________ ,过滤,洗涤,低温干燥。持续通入 气体的目的是
气体的目的是___________ 。
(4)实验中,H2O2的实际用量要大于理论用量,可能因素为:原因1:___________ ;原因2:生成的CuCl2催化了H2O2的分解。
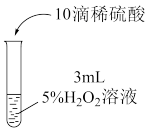
(5)该小组对“原因2”进行拓展探究。为验证CuCl2对H2O2分解的催化作用,该小组向5支盛有10mL5%H2O2的试管中滴加不同溶液,实验记录如下表(忽略溶液体积的微小变化;已知一定条件下,还原产物的浓度越小,氧化剂的氧化性越强):
①实验Ⅳ过程中观察到有白色沉淀(经检验为CuCl)生成,反应的机理表示为
第一步:H2O2+2Cu2++2Cl-=O2↑+2CuCl+2H+;
第二步:___________ (写离子方程式)。
②已知化学反应速率第一步<第二步,则气泡产生速率实验Ⅳ比实验Ⅲ加快的原因:___________ 。
③分析上述实验,下列说法正确的是___________ (填字母)。
A.实验Ⅰ的目的是证明仅有NaCl对H2O2分解没有催化作用
B. 对H2O2分解有显著催化作用
对H2O2分解有显著催化作用
C.Cl-增强了Cu2+对H2O2分解的催化效果,且Cl-浓度越大催化效果越强
④写出一种H2O2的用途___________ 。
| 温度 | 15℃以下 | 15~25.7℃ | 26~42℃ | 42℃以上 |
| 结晶水合物 | CuCl2·4H2O | CuCl2·3H2O | CuCl2·2H2O | CuCl2·H2O |
(1)仪器a的名称为
(2)上述方法制备CuCl2的离子方程式为
(3)为得到纯净的CuCl2·2H2O晶体,反应完全后要进行的操作是:除去其他可能的金属离子后,过滤,向滤液中持续通入
 气体,加热蒸发浓缩,
气体,加热蒸发浓缩, 气体的目的是
气体的目的是(4)实验中,H2O2的实际用量要大于理论用量,可能因素为:原因1:
(5)该小组对“原因2”进行拓展探究。为验证CuCl2对H2O2分解的催化作用,该小组向5支盛有10mL5%H2O2的试管中滴加不同溶液,实验记录如下表(忽略溶液体积的微小变化;已知一定条件下,还原产物的浓度越小,氧化剂的氧化性越强):
| 实验 | Ⅰ | Ⅱ | Ⅲ | Ⅳ | Ⅴ |
| 滴加试剂 | 2滴1mol/LNaCl | 2滴1mol/LNa2SO4 | 2滴1mol/LCuSO4 | 2滴1mol/LCuSO4和2滴1mol/LNaCl | 2滴1mol/LCuSO4和4滴1mol/LNaCl |
| 现象 | 无气泡产生 | 无气泡产生 | 均产生气泡,且气泡速率从Ⅲ到Ⅴ依次加快 | ||
第一步:H2O2+2Cu2++2Cl-=O2↑+2CuCl+2H+;
第二步:
②已知化学反应速率第一步<第二步,则气泡产生速率实验Ⅳ比实验Ⅲ加快的原因:
③分析上述实验,下列说法正确的是
A.实验Ⅰ的目的是证明仅有NaCl对H2O2分解没有催化作用
B.
 对H2O2分解有显著催化作用
对H2O2分解有显著催化作用C.Cl-增强了Cu2+对H2O2分解的催化效果,且Cl-浓度越大催化效果越强
④写出一种H2O2的用途
您最近一年使用:0次
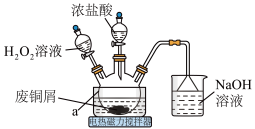
2 . 从矿石中提取金(Au)是获取贵金属的主要来源,工业上常以 溶液、氨水和
溶液、氨水和 溶液为原料配制浸金液{含
溶液为原料配制浸金液{含 }。
}。
已知:① 在酸性环境中易分解,在碱性环境中较稳定,能与金形成稳定的
在酸性环境中易分解,在碱性环境中较稳定,能与金形成稳定的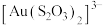 。
。
②几种物质或离子的颜色如表所示:
回答下列问题:
(1) 中提供空轨道的为
中提供空轨道的为_______ (填名称,下同),配体为_______ 。配制过程中氨水需过量,其原因是_______ 。
某科研小组对该浸金液的浸金原理进行探究:
提出猜想:
猜想一: 吸附在金表面,在
吸附在金表面,在 的作用下生成
的作用下生成 和
和 ,
, 迅速被
迅速被 替换成
替换成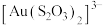 ,
, 被空气中的氧气氧化成
被空气中的氧气氧化成 参与循环。
参与循环。
猜想二: 吸附在金表面,在氧气作用下生成
吸附在金表面,在氧气作用下生成 和
和 ,
, 迅速被
迅速被 替换成
替换成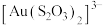 ,
, 与
与 生成的
生成的 参与循环。
参与循环。
验证猜想:
(2)俗话说“真金不怕火炼”,从化学性质的角度说明:_______ 。据此有人得出结论:猜想二不成立,但有人觉得溶液的酸碱性对物质的性质有一定影响,为验证猜想二是否成立,设计如下实验:
步骤一:用pH试纸测浸金液的pH,其操作为_______ 。
步骤二:配制与浸金液pH相同的 溶液。用
溶液。用 固体配制一定物质的量浓度的
固体配制一定物质的量浓度的 溶液所用的玻璃仪器包括量筒、烧杯、玻璃棒、
溶液所用的玻璃仪器包括量筒、烧杯、玻璃棒、_______ 。
步骤三:将一块金片放入配制的 溶液中,并通入空气,一段时间后,若观察到
溶液中,并通入空气,一段时间后,若观察到_______ ,则猜想二可能成立。
(3)某小组设计如图所示实验验证猜想一。_______ (填锥形瓶中出现的实验现象),则猜想一可能成立;打开瓶塞后的现象用离子方程式表示为_______ 。
 溶液、氨水和
溶液、氨水和 溶液为原料配制浸金液{含
溶液为原料配制浸金液{含 }。
}。已知:①
 在酸性环境中易分解,在碱性环境中较稳定,能与金形成稳定的
在酸性环境中易分解,在碱性环境中较稳定,能与金形成稳定的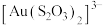 。
。②几种物质或离子的颜色如表所示:
| 物质或离子 | Au | 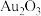 |  |  | 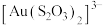 |
| 颜色 | 黄色 | 棕黑 | 蓝色 | 无色 | 无色 |
(1)
 中提供空轨道的为
中提供空轨道的为某科研小组对该浸金液的浸金原理进行探究:
提出猜想:
猜想一:
 吸附在金表面,在
吸附在金表面,在 的作用下生成
的作用下生成 和
和 ,
, 迅速被
迅速被 替换成
替换成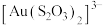 ,
, 被空气中的氧气氧化成
被空气中的氧气氧化成 参与循环。
参与循环。猜想二:
 吸附在金表面,在氧气作用下生成
吸附在金表面,在氧气作用下生成 和
和 ,
, 迅速被
迅速被 替换成
替换成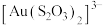 ,
, 与
与 生成的
生成的 参与循环。
参与循环。验证猜想:
(2)俗话说“真金不怕火炼”,从化学性质的角度说明:
步骤一:用pH试纸测浸金液的pH,其操作为
步骤二:配制与浸金液pH相同的
 溶液。用
溶液。用 固体配制一定物质的量浓度的
固体配制一定物质的量浓度的 溶液所用的玻璃仪器包括量筒、烧杯、玻璃棒、
溶液所用的玻璃仪器包括量筒、烧杯、玻璃棒、步骤三:将一块金片放入配制的
 溶液中,并通入空气,一段时间后,若观察到
溶液中,并通入空气,一段时间后,若观察到(3)某小组设计如图所示实验验证猜想一。
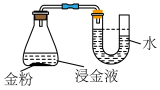
您最近一年使用:0次
3 . 探究银镜实验后溶解Ag的实验方案,如下表所示。
已知:Fe3+的氧化性与Ag+接近。下列有关叙述正确的是
| 实验方案 | 实验现象 | |
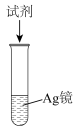 | 试剂 | |
| 实验①:稀硝酸 | 银逐渐溶解,试管口有浅红棕色气体生成 | |
| 实验②:Fe(NO3)3溶液(pH=2) | 银镜慢慢消失,溶液澄清 | |
| 实验③:FeCl3溶液(pH=2) | 银镜快速溶解,反应后溶液中有明显灰色沉淀 | |
| 实验④:HI溶液 | 银镜溶解,有黄色沉淀产生,且有气泡产生 | |
A.实验①发生反应的离子方程式为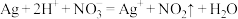 |
| B.对比分析实验②和③表明:Cl-具有催化作用 |
C.实验④发生反应的类型为置换反应,说明氧化性;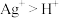 |
| D.综合上述实验说明溶解银的关键在于试剂的氧化性和能否生成银盐沉淀 |
您最近一年使用:0次
4 . 甲醛是有毒气体,某实验小组探究能否用氨水吸收甲醛。
Ⅰ.甲醛溶液的制备与浓度测定
已知制备甲醛的反应原理如下:
①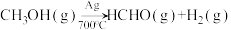
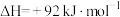
②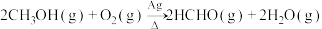
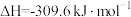
实验室制备甲醛溶液的装置如图所示。(加热装置已略去)
回答下列问题:
(1)装置A中盛放甲醇的仪器名称为___________ 。
(2)从能量利用的角度说明 的作用是
的作用是___________ ;为了防止高温下甲醛在催化剂表面吸附太久被 进一步氧化为甲酸,可采取的措施是
进一步氧化为甲酸,可采取的措施是___________ 。
(3)实验结束后,取5mL新制 悬浊液,滴入适量的装置D的溶液,加热,有砖红色沉淀生成,反应的化学方程式为
悬浊液,滴入适量的装置D的溶液,加热,有砖红色沉淀生成,反应的化学方程式为___________ 。
(4)甲醛溶液的浓度测定:装置D的溶液经预处理后,取10.00mL稀释至200mL,移取20.00mL稀释液于碘量瓶中,加入 溶液和指示剂,振荡,静置5分钟后用0.1000
溶液和指示剂,振荡,静置5分钟后用0.1000
 标准溶液滴定生成的NaOH至终点,重复三次实验,平均消耗
标准溶液滴定生成的NaOH至终点,重复三次实验,平均消耗 标准溶液体积为20.00mL。则所制得的溶液中甲醛浓度为
标准溶液体积为20.00mL。则所制得的溶液中甲醛浓度为___________  (计算结果保留四位有效数字)。(已知:
(计算结果保留四位有效数字)。(已知: )
)
Ⅱ.甲醛与氨水反应的实验探究
实验探究(ⅰ)
(5)实验1的目的是___________ 。
关于实验3褪色的原因,小组成员提出了以下猜想:
猜想①:甲醛与氨水发生反应,溶液碱性减弱,酚酞溶液褪色。
猜想②:甲醛与酚酞溶液发生反应,指示剂失效,溶液褪色。
实验探究(ⅱ)
(6)实验5的操作为___________ 。由实验4、5说明猜想___________ (填标号)正确。
Ⅰ.甲醛溶液的制备与浓度测定
已知制备甲醛的反应原理如下:
①
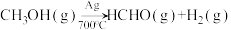
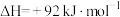
②
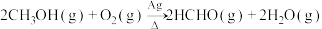
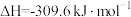
实验室制备甲醛溶液的装置如图所示。(加热装置已略去)

回答下列问题:
(1)装置A中盛放甲醇的仪器名称为
(2)从能量利用的角度说明
 的作用是
的作用是 进一步氧化为甲酸,可采取的措施是
进一步氧化为甲酸,可采取的措施是(3)实验结束后,取5mL新制
 悬浊液,滴入适量的装置D的溶液,加热,有砖红色沉淀生成,反应的化学方程式为
悬浊液,滴入适量的装置D的溶液,加热,有砖红色沉淀生成,反应的化学方程式为(4)甲醛溶液的浓度测定:装置D的溶液经预处理后,取10.00mL稀释至200mL,移取20.00mL稀释液于碘量瓶中,加入
 溶液和指示剂,振荡,静置5分钟后用0.1000
溶液和指示剂,振荡,静置5分钟后用0.1000
 标准溶液滴定生成的NaOH至终点,重复三次实验,平均消耗
标准溶液滴定生成的NaOH至终点,重复三次实验,平均消耗 标准溶液体积为20.00mL。则所制得的溶液中甲醛浓度为
标准溶液体积为20.00mL。则所制得的溶液中甲醛浓度为 (计算结果保留四位有效数字)。(已知:
(计算结果保留四位有效数字)。(已知: )
)Ⅱ.甲醛与氨水反应的实验探究
实验探究(ⅰ)
| 实验编号 | 操作 | 现象 |
| 1 | 取适量D的溶液,用pH计测溶液的pH | pH≈7.0 |
| 2 | 取2mL2%氨水(滴有酚酞),逐滴加入3mL10%甲醇溶液 | 没有明显变化 |
| 3 | 取2mL2%氨水(滴有酚酞),逐滴加入装置D的溶液 | 红色褪去 |
关于实验3褪色的原因,小组成员提出了以下猜想:
猜想①:甲醛与氨水发生反应,溶液碱性减弱,酚酞溶液褪色。
猜想②:甲醛与酚酞溶液发生反应,指示剂失效,溶液褪色。
实验探究(ⅱ)
| 实验编号 | 操作 | 现象 |
| 4 | 取实验3的无色溶液1mL,滴入几滴氨水 | 溶液变红 |
| 5 | 无明显变化 |
您最近一年使用:0次
5 . 铁是人体必需的微量元素。某研究小组通过设计实验以检验菠菜中是否含有铁元素,其实验流程如图所示,下列说法错误的是 。
。

 。
。| A.上述实验流程中操作①②都是过滤 |
| B.向溶液2中加入HNO3后再滴入KSCN溶液无现象,说明菠菜中的铁元素不是以水溶性物质存在的 |
| C.向溶液3中滴加KSCN溶液后变红,说明菠菜中存在三价的铁元素 |
D.反应③的离子方程式为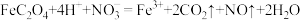 |
您最近一年使用:0次
2023-04-11更新
|
999次组卷
|
6卷引用:押题卷化学(五)
(已下线)押题卷化学(五)(已下线)题型35 微型成套装置实验流程(已下线)专题07 无机物的转化 微型工艺流程-2023年高考化学真题题源解密(全国通用)重庆市第八中学校2023-2024学年高三上学期入学测试化学试题陕西省咸阳市实验中学2023-2024学年高三下学期适应训练(一)化学试题山东省淄博市张店区2022-2023学年高一下学期5月期中考试化学试题
2022高一·全国·专题练习
6 . 在实验中由于菠菜汁颜色,所以对于实验现象的观察有一定的影响,想一想可以怎么改进这个实验_______ 。
您最近一年使用:0次
7 . 用如图所示装置测定镁铝合金中铝的质量分数。下列说法错误的是
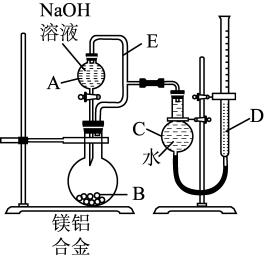

| A.合金的质量在一定范围内 |
| B.若无E导管,结果偏大 |
| C.若D管中液面高,结果偏大 |
| D.NaOH溶液换成稀H2SO4也能达到实验目的 |
您最近一年使用:0次
名校
解题方法
8 . 某兴趣小组同学探究KMnO4溶液与草酸(H2C2O4)溶液反应速率的影响因素。配制1.0×10-3mol/LKMnO4溶液、0.40mol/L草酸溶液。将KMnO4溶液与草酸溶液按如下比例混合。
【设计实验】
(1)实验①和②的目的是___________ 。
(2)甲认为上述实验应控制pH相同,可加入的试剂是___________ (填序号)。
a.盐酸 b.硫酸 c.草酸
【实施实验】
小组同学将溶液pH调至1并进行实验①和②,发现紫色并未直接褪去,而是分成两个阶段:
i.紫色溶液转变为青色溶液,ii.青色溶液逐渐褪至无色溶液。
资料:(a) 无色,在草酸中不能形成配合物;
无色,在草酸中不能形成配合物;
(b) 无色,有强氧化性,发生反应
无色,有强氧化性,发生反应 (青绿色)后氧化性减弱;
(青绿色)后氧化性减弱;
(c) 呈绿色,在酸性条件下不稳定,迅速分解产生
呈绿色,在酸性条件下不稳定,迅速分解产生 和
和 。
。
(3)乙同学从氧化还原角度推测阶段i中可能产生 ,你认为该观点是否合理,并说明理由:
,你认为该观点是否合理,并说明理由:___________ 。
【继续探究】
进一步实验证明溶液中含有 ,反应过程中
,反应过程中 和
和 浓度随时间的变化如下图。
浓度随时间的变化如下图。
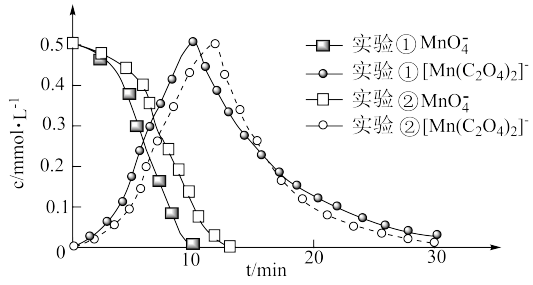
(4)第i阶段中检测到有 气体产生,反应的离子方程式为
气体产生,反应的离子方程式为___________ 。
(5)实验②在第ii阶段的反应速率较大,可能的原因是___________ 。
(6)据此推测,若在第ii阶段将 调节至
调节至 ,溶液褪至无色的时间会
,溶液褪至无色的时间会___________ (填“增加”“减少”或“不变”)。
【结论与反思】
(7)上述实验涉及的反应中,草酸的作用是___________ 。
结论:反应可能是分阶段进行的。草酸浓度的改变对不同阶段反应速率的影响可能不同。
【设计实验】
| 序号 | 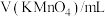 | 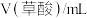 | 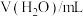 | 反应温度/℃ |
| ① | 2.0 | 2.0 | 0 | 20 |
| ② | 2.0 | 1.0 | 1.0 | 20 |
(2)甲认为上述实验应控制pH相同,可加入的试剂是
a.盐酸 b.硫酸 c.草酸
【实施实验】
小组同学将溶液pH调至1并进行实验①和②,发现紫色并未直接褪去,而是分成两个阶段:
i.紫色溶液转变为青色溶液,ii.青色溶液逐渐褪至无色溶液。
资料:(a)
 无色,在草酸中不能形成配合物;
无色,在草酸中不能形成配合物;(b)
 无色,有强氧化性,发生反应
无色,有强氧化性,发生反应 (青绿色)后氧化性减弱;
(青绿色)后氧化性减弱;(c)
 呈绿色,在酸性条件下不稳定,迅速分解产生
呈绿色,在酸性条件下不稳定,迅速分解产生 和
和 。
。(3)乙同学从氧化还原角度推测阶段i中可能产生
 ,你认为该观点是否合理,并说明理由:
,你认为该观点是否合理,并说明理由:【继续探究】
进一步实验证明溶液中含有
 ,反应过程中
,反应过程中 和
和 浓度随时间的变化如下图。
浓度随时间的变化如下图。
(4)第i阶段中检测到有
 气体产生,反应的离子方程式为
气体产生,反应的离子方程式为(5)实验②在第ii阶段的反应速率较大,可能的原因是
(6)据此推测,若在第ii阶段将
 调节至
调节至 ,溶液褪至无色的时间会
,溶液褪至无色的时间会【结论与反思】
(7)上述实验涉及的反应中,草酸的作用是
结论:反应可能是分阶段进行的。草酸浓度的改变对不同阶段反应速率的影响可能不同。
您最近一年使用:0次
2022-04-01更新
|
1366次组卷
|
8卷引用:北京市海淀区2022届高三一模化学试题
北京市海淀区2022届高三一模化学试题(已下线)必刷卷03-2022年高考化学考前信息必刷卷(河北专用)北京市第二中学2022-2023学年高二上学期10月月考化学试题北京第一零一中学2023届高三10月月考化学试题北京市第二十中学2022-2023学年高三上学期12月月考化学试题超重点8 碳酸盐、草酸盐的创新考查(已下线)北京市海淀区2022届高三一模(实验探究题)北京师范大学附属中学2022-2023学年高二上学期10月月考化学试题
名校
解题方法
9 . 实验小组探究双氧水与KI的反应,实验方案如下表。
下列说法不正确 的是
| 序号 | ① | ② | ③ |
| 实验装置及操作 |
|
|
|
| 实验现象 | 溶液无明显变化 | 溶液立即变为黄色,产生大量无色气体;溶液温度升高;最终溶液仍为黄色 | 溶液立即变为棕黄色,产生少量无色气体;溶液颜色逐渐加深,温度无明显变化;最终有紫黑色沉淀析出 |
A. 对 对 分解有催化作用 分解有催化作用 |
B.对比②和③,酸性条件下 氧化 氧化 的速率更大 的速率更大 |
C.对比②和③,②中的现象可能是因为 分解的速率大于H2O2氧化 分解的速率大于H2O2氧化 的速率 的速率 |
D.实验②③中的温度差异说明, 氧化 氧化 的反应放热 的反应放热 |
您最近一年使用:0次
2022-04-01更新
|
2414次组卷
|
23卷引用:北京市海淀区2022届高三一模化学试题
北京市海淀区2022届高三一模化学试题(已下线)专项12 化学反应速率与化学平衡-备战2022年高考化学阶段性新题精选专项特训(全国卷)(4月期)(已下线)化学-2022年高考押题预测卷02(北京卷)(含考试版、全解全析、参考答案、答题卡)北京市顺义牛栏山第一中学2021-2022学年高一下学期居家学习成果展示化学测试题广东省广州市第六中学021-2022学年高一下学期期末考试化学试题北京市清华大学附属中学2022-2023学年高三9月月考化学试题江苏省秦淮中学、宇通实验学校等六校2022-2023学年高三上学期10月学情调研化学试题北京市第一六一中学2022-2023学年高三上学期10月月考化学试题北京市第二中学2022-2023学年高二上学期10月月考化学试题北京市铁路第二中学2022-2023学年高二上学期期中检测化学试题(已下线)北京市海淀区2022届高三一模(选择题11-14)北京市第八中学2022-2023学年高一下学期期中考试(选考班)化学试题河北正定中学2022-2023学年高一下学期第四次月考化学试题北京市清华大学附属中学2023-2024学年高二上学期期中考试化学试题北京交通大学附属中学2023-2024学年高三上学期12月月考化学试题 北京市顺义区杨镇第一中学2023-2024学年高二上学期期中考试化学试题北京一零一中学2023-2024学年高三上学期月考三化学试题北京市铁路第二中学2023-2024学年高二上学期期中考试化学试题北京市育才学校2023-2024学年高一下学期期中考试化学(选考)试题湖南省邵阳市新宁县第一中学2021-2022学年高三下学期期中考试化学试题广东省四校2022-2023学年高三联考化学试题湖南省株洲市九方中学2022-2023学年高三上学期第一次月考化学试题广东省佛山市顺德市李兆基中学2022-2023学年高一下学期3月月考化学试题
解题方法
10 . 实验室用二氧化锰与浓盐酸反应制取 (实验装置如图)。实验表明制得的
(实验装置如图)。实验表明制得的 中含有
中含有 ;盐酸浓度变稀后,不能与二氧化锰反应得到
;盐酸浓度变稀后,不能与二氧化锰反应得到 。研究性学习小组对该实验进行探究。回答下列问题:
。研究性学习小组对该实验进行探究。回答下列问题:
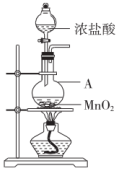
(1)为研究二氧化锰与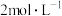 、
、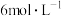 、
、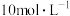 的盐酸反应的情况,甲同学设计以下实验,将产生的气体通入淀粉
的盐酸反应的情况,甲同学设计以下实验,将产生的气体通入淀粉 溶液。请完成以下实验设计表:
溶液。请完成以下实验设计表:
(2)根据编号为①、②的实验可得出的结论是_______ ,根据编号为③的实验可得出的结论是_______ 。
(3)乙同学为证明生成的气体中是否含有 ,设计以下几种方案:
,设计以下几种方案:
方案一:将气体通入紫色石蕊溶液;
方案二:将气体通入 溶液。
溶液。
方案一预期的实验现象是_______ ,其中不能证明气体中是否含有 的方案是
的方案是_______ 。
(4)丙同学利用下列试剂设计了可行的证明气体中是否含有 的方案,请补充完成。
的方案,请补充完成。
供选用的试剂: 溶液、准确浓度的
溶液、准确浓度的 溶液、
溶液、 溶液、铁粉、硝酸。
溶液、铁粉、硝酸。
 (实验装置如图)。实验表明制得的
(实验装置如图)。实验表明制得的 中含有
中含有 ;盐酸浓度变稀后,不能与二氧化锰反应得到
;盐酸浓度变稀后,不能与二氧化锰反应得到 。研究性学习小组对该实验进行探究。回答下列问题:
。研究性学习小组对该实验进行探究。回答下列问题:
(1)为研究二氧化锰与
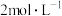 、
、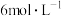 、
、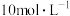 的盐酸反应的情况,甲同学设计以下实验,将产生的气体通入淀粉
的盐酸反应的情况,甲同学设计以下实验,将产生的气体通入淀粉 溶液。请完成以下实验设计表:
溶液。请完成以下实验设计表:| 编号 | 反应条件 | 盐酸浓度 | 淀粉 溶液的颜色变化 溶液的颜色变化 |
| ① | 微热 | 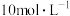 | 变蓝色 |
| ② | 常温(不加热) | 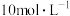 | 不变色(仍为无色) |
| ③ | 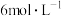 | 不变色 | |
| ④ | 微热 | 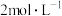 |
(3)乙同学为证明生成的气体中是否含有
 ,设计以下几种方案:
,设计以下几种方案:方案一:将气体通入紫色石蕊溶液;
方案二:将气体通入
 溶液。
溶液。方案一预期的实验现象是
 的方案是
的方案是(4)丙同学利用下列试剂设计了可行的证明气体中是否含有
 的方案,请补充完成。
的方案,请补充完成。供选用的试剂:
 溶液、准确浓度的
溶液、准确浓度的 溶液、
溶液、 溶液、铁粉、硝酸。
溶液、铁粉、硝酸。①将产生的气体用蒸馏水吸收得到溶液 ; ;②取  溶液 溶液 ,加入过量的 ,加入过量的 溶液,然后 溶液,然后 中溶解的 中溶解的 的量。 的量。③另取  溶液 溶液 , , 元素的总量。 元素的总量。④根据  中溶解的 中溶解的 的量和氯元素的总量即可确定气体是否含有 的量和氯元素的总量即可确定气体是否含有 。 。 |
您最近一年使用:0次