解题方法
1 . 某小组同学探究实验室配制银氨溶液并检验醛基的方法。
资料:i.AgOH是白色难溶于水的物质,常温下极不稳定,分解生成棕色微溶于水的 。
。
ii.向硝酸银溶液中加入氨水,转化为 的
的 占参加反应的
占参加反应的 总量的百分比最大不超过10%。
总量的百分比最大不超过10%。
Ⅰ.在实验室配制银氨溶液的过程中,小组同学发现,所用试剂的配制方式和存放时间不同,实验现象不同。(注:以下试剂若无特殊说明,均为新制)
(1)NH3分子空间构型为_______ 。
(2)结合资料ii,写出实验1中加入少量氨水时发生的主要反应的离子方程式_______ 。
(3)已知,实验2中白色沉淀加硝酸产生能使澄清石灰水变浑浊的无色气体,实验2中白色沉淀的主要成分是_______ 。
(4)对比实验1和3,分析实验3中“溶液始终澄清”的原因是_______ 。
Ⅱ.用实验1配制出的银氨溶液检验醛基。
资料:可从电极反应角度分析物质氧化性和还原性的变化。
(5)银氨溶液与CH3CHO的反应中,电极反应式:
还原反应:Ag++e-=Ag;氧化反应:_______ (碱性条件下)。
在此基础上设计并实施了以下实验。
(6)实验5产生银镜比实验4快的可能原因是_______ 。按照实验5的方法,将乙醛换成丙酮,水浴加热后也能产生银镜。
综合上述实验,实验4是检验醛基的最合理方法。
资料:i.AgOH是白色难溶于水的物质,常温下极不稳定,分解生成棕色微溶于水的
 。
。ii.向硝酸银溶液中加入氨水,转化为
 的
的 占参加反应的
占参加反应的 总量的百分比最大不超过10%。
总量的百分比最大不超过10%。Ⅰ.在实验室配制银氨溶液的过程中,小组同学发现,所用试剂的配制方式和存放时间不同,实验现象不同。(注:以下试剂若无特殊说明,均为新制)
| 序号 | 实验操作 | 实验现象 |
| 1 | 向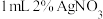 溶液中逐滴加入2%氨水 溶液中逐滴加入2%氨水 | 先产生棕色沉淀,后溶液变澄清 |
| 2 | 向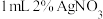 溶液中逐滴加入在空气中存放一段时间的2%氨水 溶液中逐滴加入在空气中存放一段时间的2%氨水 | 先产生白色沉淀,后溶液变澄清 |
| 3 | 向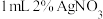 ( ( 酸化)溶液中逐滴加入2%氨水至过量 酸化)溶液中逐滴加入2%氨水至过量 | 溶液始终澄清 |
(2)结合资料ii,写出实验1中加入少量氨水时发生的主要反应的离子方程式
(3)已知,实验2中白色沉淀加硝酸产生能使澄清石灰水变浑浊的无色气体,实验2中白色沉淀的主要成分是
(4)对比实验1和3,分析实验3中“溶液始终澄清”的原因是
Ⅱ.用实验1配制出的银氨溶液检验醛基。
资料:可从电极反应角度分析物质氧化性和还原性的变化。
(5)银氨溶液与CH3CHO的反应中,电极反应式:
还原反应:Ag++e-=Ag;氧化反应:
在此基础上设计并实施了以下实验。
| 序号 | 实验操作 | 实验现象 |
| 4 | 向银氨溶液中加入3滴 ,水浴加热 ,水浴加热 | 产生银镜 |
| 5 | 向银氨溶液中加入1滴10% NaOH溶液后,滴入3滴 | 产生银镜比实验4快 |
综合上述实验,实验4是检验醛基的最合理方法。
您最近一年使用:0次
名校
解题方法
2 . 某兴趣小组同学探究KMnO4溶液与草酸(H2C2O4)溶液反应速率的影响因素。配制1.0×10-3mol/LKMnO4溶液、0.40mol/L草酸溶液。将KMnO4溶液与草酸溶液按如下比例混合。
【设计实验】
(1)实验①和②的目的是___________ 。
(2)甲认为上述实验应控制pH相同,可加入的试剂是___________ (填序号)。
a.盐酸 b.硫酸 c.草酸
【实施实验】
小组同学将溶液pH调至1并进行实验①和②,发现紫色并未直接褪去,而是分成两个阶段:
i.紫色溶液转变为青色溶液,ii.青色溶液逐渐褪至无色溶液。
资料:(a) 无色,在草酸中不能形成配合物;
无色,在草酸中不能形成配合物;
(b) 无色,有强氧化性,发生反应
无色,有强氧化性,发生反应 (青绿色)后氧化性减弱;
(青绿色)后氧化性减弱;
(c) 呈绿色,在酸性条件下不稳定,迅速分解产生
呈绿色,在酸性条件下不稳定,迅速分解产生 和
和 。
。
(3)乙同学从氧化还原角度推测阶段i中可能产生 ,你认为该观点是否合理,并说明理由:
,你认为该观点是否合理,并说明理由:___________ 。
【继续探究】
进一步实验证明溶液中含有 ,反应过程中
,反应过程中 和
和 浓度随时间的变化如下图。
浓度随时间的变化如下图。
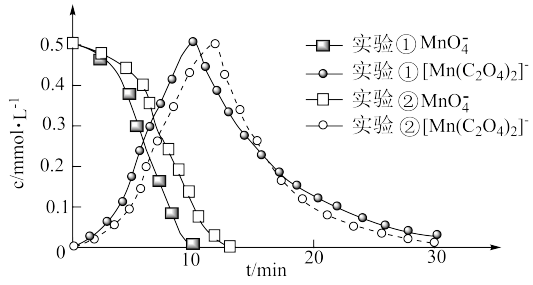
(4)第i阶段中检测到有 气体产生,反应的离子方程式为
气体产生,反应的离子方程式为___________ 。
(5)实验②在第ii阶段的反应速率较大,可能的原因是___________ 。
(6)据此推测,若在第ii阶段将 调节至
调节至 ,溶液褪至无色的时间会
,溶液褪至无色的时间会___________ (填“增加”“减少”或“不变”)。
【结论与反思】
(7)上述实验涉及的反应中,草酸的作用是___________ 。
结论:反应可能是分阶段进行的。草酸浓度的改变对不同阶段反应速率的影响可能不同。
【设计实验】
| 序号 | 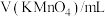 | 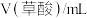 | 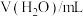 | 反应温度/℃ |
| ① | 2.0 | 2.0 | 0 | 20 |
| ② | 2.0 | 1.0 | 1.0 | 20 |
(2)甲认为上述实验应控制pH相同,可加入的试剂是
a.盐酸 b.硫酸 c.草酸
【实施实验】
小组同学将溶液pH调至1并进行实验①和②,发现紫色并未直接褪去,而是分成两个阶段:
i.紫色溶液转变为青色溶液,ii.青色溶液逐渐褪至无色溶液。
资料:(a)
 无色,在草酸中不能形成配合物;
无色,在草酸中不能形成配合物;(b)
 无色,有强氧化性,发生反应
无色,有强氧化性,发生反应 (青绿色)后氧化性减弱;
(青绿色)后氧化性减弱;(c)
 呈绿色,在酸性条件下不稳定,迅速分解产生
呈绿色,在酸性条件下不稳定,迅速分解产生 和
和 。
。(3)乙同学从氧化还原角度推测阶段i中可能产生
 ,你认为该观点是否合理,并说明理由:
,你认为该观点是否合理,并说明理由:【继续探究】
进一步实验证明溶液中含有
 ,反应过程中
,反应过程中 和
和 浓度随时间的变化如下图。
浓度随时间的变化如下图。
(4)第i阶段中检测到有
 气体产生,反应的离子方程式为
气体产生,反应的离子方程式为(5)实验②在第ii阶段的反应速率较大,可能的原因是
(6)据此推测,若在第ii阶段将
 调节至
调节至 ,溶液褪至无色的时间会
,溶液褪至无色的时间会【结论与反思】
(7)上述实验涉及的反应中,草酸的作用是
结论:反应可能是分阶段进行的。草酸浓度的改变对不同阶段反应速率的影响可能不同。
您最近一年使用:0次
2022-04-01更新
|
1366次组卷
|
8卷引用:北京市海淀区2022届高三一模化学试题
北京市海淀区2022届高三一模化学试题(已下线)必刷卷03-2022年高考化学考前信息必刷卷(河北专用)北京第一零一中学2023届高三10月月考化学试题北京市第二十中学2022-2023学年高三上学期12月月考化学试题超重点8 碳酸盐、草酸盐的创新考查(已下线)北京市海淀区2022届高三一模(实验探究题)北京市第二中学2022-2023学年高二上学期10月月考化学试题北京师范大学附属中学2022-2023学年高二上学期10月月考化学试题
解题方法
3 . 海洋是人类未来赖以生存和发展的资源宝库,合理开发和有效利用应得到重视。如从海藻灰中可得到NaI溶液。
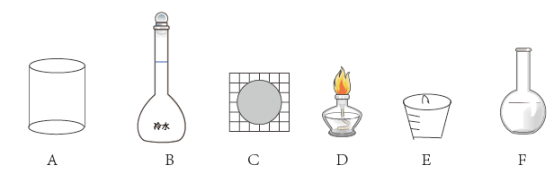
(1)以NaI溶液为原料,经过一系列变化和操作,可得到粗碘,进一步提纯粗碘时,不需要的仪器有___________ 。
(2)某学习小组以空气氧化NaI溶液为研究对象,探究溶液的酸碱性对反应的影响。
①用CCl4萃取反应后I、II、III、IV 的溶液,萃取后下层CCl4均为无色,取萃取后的上层溶液,用淀粉检验:I、Ⅱ的溶液变蓝色;III的溶液蓝色不明显、Ⅳ的溶液未变蓝。
i.写出实验Ⅰ中反应的离子方程式___________ 。
ii.查阅资料;I2易溶于NaI溶液。下列实验证实了该结论并解释Ⅰ、II的萃取现象:
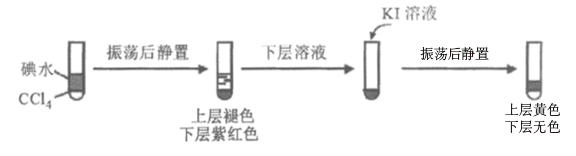
用CCl4萃取Ⅰ、II反应后的溶液,萃取后下层CCl4颜色均无色的原因是___________ 。
②查阅资料:pH <11.7时,I—能被O2氧化为I2;pH≥9.28时,I2发生歧化反应:3I2+6OH—=IO3—+5I—+3H2O,pH越大,歧化速率越快。某同学利用原电池原理设计实验证实:PH = 10的条件下实验Ⅳ确实可以发生I—能被O2氧化为I2的反应,如图所示:
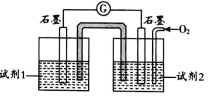
据此分析,试剂1是___________ ;试剂2是 ___________ 。
实验现象:电流表指针偏转,左侧电极附近溶液变蓝(±<30 min )。
③综合实验现象。说明I—被空气氧化的影响因素及对应关系为___________ 。
(3)测定NaI溶液中I—含量。
量取25.00 mL,NaI溶液于250mL锥形瓶中,分别加入少量稀H2SO4和稍过量的NH4Fe(SO4)2·12H2O溶液,摇匀。小火加热蒸发至碘完全升华,取下锥形瓶冷却后,用c mol· L-1酸性标准KMnO4溶液进行滴定至终点,重复3次。平均每次消耗KMnO4溶液VmL(已知反应:2Fe3+ +2I—=2Fe2++ I2 、5Fe2++ +8H+=5Fe3++Mn2+ +4H2O)。
+8H+=5Fe3++Mn2+ +4H2O)。
①该实验达到滴定终点时,现象为___________ 。
②根据滴定有关数据,该NaI溶液中I—含量是___________ g·L-1。
(1)以NaI溶液为原料,经过一系列变化和操作,可得到粗碘,进一步提纯粗碘时,不需要的仪器有

(2)某学习小组以空气氧化NaI溶液为研究对象,探究溶液的酸碱性对反应的影响。
| 实验 | 编号 | pH = a | 现象 |
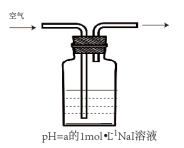 | I | 3 | 4分钟左右,溶液呈黄色 |
| Ⅱ | 7 | 60分钟左右,溶液呈浅黄色 | |
| Ⅲ | 8 | 10小时后,溶液呈很浅的黄色 | |
| Ⅳ | 10 | 10小时后,溶液颜色无明显变化 |
i.写出实验Ⅰ中反应的离子方程式
ii.查阅资料;I2易溶于NaI溶液。下列实验证实了该结论并解释Ⅰ、II的萃取现象:

用CCl4萃取Ⅰ、II反应后的溶液,萃取后下层CCl4颜色均无色的原因是
②查阅资料:pH <11.7时,I—能被O2氧化为I2;pH≥9.28时,I2发生歧化反应:3I2+6OH—=IO3—+5I—+3H2O,pH越大,歧化速率越快。某同学利用原电池原理设计实验证实:PH = 10的条件下实验Ⅳ确实可以发生I—能被O2氧化为I2的反应,如图所示:

据此分析,试剂1是
实验现象:电流表指针偏转,左侧电极附近溶液变蓝(±<30 min )。
③综合实验现象。说明I—被空气氧化的影响因素及对应关系为
(3)测定NaI溶液中I—含量。
量取25.00 mL,NaI溶液于250mL锥形瓶中,分别加入少量稀H2SO4和稍过量的NH4Fe(SO4)2·12H2O溶液,摇匀。小火加热蒸发至碘完全升华,取下锥形瓶冷却后,用c mol· L-1酸性标准KMnO4溶液进行滴定至终点,重复3次。平均每次消耗KMnO4溶液VmL(已知反应:2Fe3+ +2I—=2Fe2++ I2 、5Fe2++
 +8H+=5Fe3++Mn2+ +4H2O)。
+8H+=5Fe3++Mn2+ +4H2O)。①该实验达到滴定终点时,现象为
②根据滴定有关数据,该NaI溶液中I—含量是
您最近一年使用:0次
4 . 某小组为探究Mg与NH4Cl溶液反应机理,常温下进行以下实验。实验中所取镁粉质量均为0.5g,分别加入到选取的实验试剂中。
资料:①CH3COONH4溶液呈中性。
②Cl-对该反应几乎无影响。
(1)经检验实验2中刺激性气味气体为NH3,检验方法是____ 。用排水法收集一小试管产生的气体,经检验小试管中气体为H2。
(2)已知灰白色沉淀中含有Mg2+、OH-。为研究固体成分,进行实验:将生成的灰白色固体洗涤数次,至洗涤液中滴加AgNO3溶液后无明显浑浊。将洗涤后固体溶于稀HNO3,再滴加AgNO3溶液,出现白色沉淀。推测沉淀中含有____ ,灰白色固体可能是____ (填化学式)。
(3)甲同学认为实验2比实验1反应剧烈的原因是NH4Cl溶液中c(H+)大,与Mg反应快。用化学用语解释NH4Cl溶液显酸性的原因是_____ 。
(4)乙同学通过实验3证明甲同学的说法不合理 。
①试剂X是_______ 。
②由实验3获取的证据为_______ 。
(5)为进一步探究实验2反应剧烈的原因,进行实验4。
依据上述实验,可以得出Mg能与 反应生成H2。乙同学认为该方案不严谨,需要补充的实验方案是
反应生成H2。乙同学认为该方案不严谨,需要补充的实验方案是_______ 。
(6)由以上实验可以得出的结论是_______ 。
资料:①CH3COONH4溶液呈中性。
②Cl-对该反应几乎无影响。
| 实验 | 实验试剂 | 实验现象 |
| 1 | 5mL蒸馏水 | 反应缓慢,有少量气泡产生(经检验为H2) |
| 2 | 5mL 1.0 mol/L NH4Cl溶液(pH=4.6) | 剧烈反应,产生刺激性气味气体和灰白色难溶固体 |
(2)已知灰白色沉淀中含有Mg2+、OH-。为研究固体成分,进行实验:将生成的灰白色固体洗涤数次,至洗涤液中滴加AgNO3溶液后无明显浑浊。将洗涤后固体溶于稀HNO3,再滴加AgNO3溶液,出现白色沉淀。推测沉淀中含有
(3)甲同学认为实验2比实验1反应剧烈的原因是NH4Cl溶液中c(H+)大,与Mg反应快。用化学用语解释NH4Cl溶液显酸性的原因是
(4)乙同学通过实验3证明甲同学的说法
| 实验 | 实验装置 |
| 3 | 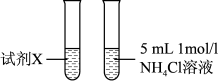 |
②由实验3获取的证据为
(5)为进一步探究实验2反应剧烈的原因,进行实验4。
| 实验 | 实验试剂 | 实验现象 |
| 4 | 5 mL NH4Cl乙醇溶液 | 有无色无味气体产生(经检验为H2) |
 反应生成H2。乙同学认为该方案不严谨,需要补充的实验方案是
反应生成H2。乙同学认为该方案不严谨,需要补充的实验方案是(6)由以上实验可以得出的结论是
您最近一年使用:0次
5 . 某实验小组在电压12V电流3A的条件下电解2mol/L的氯化铜溶液并探究其产物的性质。
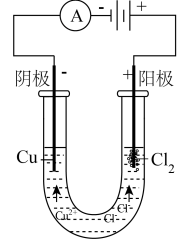
(1)根据电解原理,预测:阴极发生的实验现象是______ 。阳极发生的电极反应式为_______ 。电解氯化铜溶液总的化学方程式为_______ 。
(2)小组同学在实际电解过程中,意外的观察到下表的实验现象:
实验小组学生对阴极区产生异常现象的原因进行了探究:
资料1:CuCl是白色的难溶物,用Cu还原CuCl2溶液可以得到CuCl沉淀,它易溶于浓盐酸,用水稀释CuCl的浓盐酸溶液则又析出CuCl白色沉淀。
资料2:[CuCl2.CuCl2(H2O)]-(棕褐色) CuCl+Cu2++3Cl-+H2O。
CuCl+Cu2++3Cl-+H2O。
Ⅰ.探究阴极表面产生的白色物质:
①根据资料写出Cu还原CuCl2溶液反应的化学方程式______ 。
②学生为了确定阴极产物进行实验A:取2mol/L的CuCl2溶液,加入铜粉,充分振荡,几分钟后,试管底有白色沉淀生成,过滤出白色固体,加入浓盐酸,固体溶解,加水稀释,又析出白色沉淀。
如果要确认阴极产生的白色沉淀是CuCl,还需要进行对照实验B,该实验的设计方案是______ 。
实验结论:通过实验A和实验B的对比,可以确定阴极产生的白色固体是CuCl。
Ⅱ.探究阴极区域溶液呈现棕褐色的原因:
猜想1:可能是Cu2+与高浓度的Cl-发生络合反应所致。
实验C:向2mol/L的CuCl2溶液中加入______ ,溶液呈现绿色,没有变成棕褐色。
实验结论:溶液颜色呈现棕褐色______ (填“是”或者“不是”)由于Cu2+与高浓度的Cl-发生络合反应所致。
猜想2:棕褐色溶液可能与+1价Cu有关。
实验D:用铜粉和2mol/L的CuCl2溶液反应制备[CuCl2•CuCl2(H2O)],取少量该标准溶液与实验中得到的棕褐色溶液进行对照实验。
步骤一:配制标准[CuCl2.CuCl2(H2O)]-棕褐色溶液进行稀释,实验流程如图所示:
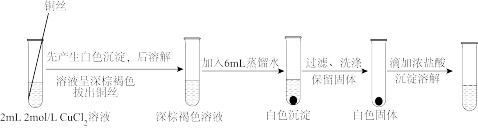
步骤二:取阴极附近的棕褐色溶液,重复上述实验进行对照,请画出对照实验的流程图______ 。
实验结论:通过对照实验,确认棕褐色溶液与+1价Cu有关。

(1)根据电解原理,预测:阴极发生的实验现象是
(2)小组同学在实际电解过程中,意外的观察到下表的实验现象:
条件 | 电极 | 现象 |
| 电压12V 电流3A | 阴极 | 3min后,附近溶液变成棕褐色。30min后,溶液变成深棕褐色。电极底部表面有少量红色金属生成,还有少量白色物质。 |
| 阳极 | 开始出现少量气泡,后来气泡增多。 |
实验小组学生对阴极区产生异常现象的原因进行了探究:
资料1:CuCl是白色的难溶物,用Cu还原CuCl2溶液可以得到CuCl沉淀,它易溶于浓盐酸,用水稀释CuCl的浓盐酸溶液则又析出CuCl白色沉淀。
资料2:[CuCl2.CuCl2(H2O)]-(棕褐色)
 CuCl+Cu2++3Cl-+H2O。
CuCl+Cu2++3Cl-+H2O。Ⅰ.探究阴极表面产生的白色物质:
①根据资料写出Cu还原CuCl2溶液反应的化学方程式
②学生为了确定阴极产物进行实验A:取2mol/L的CuCl2溶液,加入铜粉,充分振荡,几分钟后,试管底有白色沉淀生成,过滤出白色固体,加入浓盐酸,固体溶解,加水稀释,又析出白色沉淀。
如果要确认阴极产生的白色沉淀是CuCl,还需要进行对照实验B,该实验的设计方案是
实验结论:通过实验A和实验B的对比,可以确定阴极产生的白色固体是CuCl。
Ⅱ.探究阴极区域溶液呈现棕褐色的原因:
猜想1:可能是Cu2+与高浓度的Cl-发生络合反应所致。
实验C:向2mol/L的CuCl2溶液中加入
实验结论:溶液颜色呈现棕褐色
猜想2:棕褐色溶液可能与+1价Cu有关。
实验D:用铜粉和2mol/L的CuCl2溶液反应制备[CuCl2•CuCl2(H2O)],取少量该标准溶液与实验中得到的棕褐色溶液进行对照实验。
步骤一:配制标准[CuCl2.CuCl2(H2O)]-棕褐色溶液进行稀释,实验流程如图所示:

步骤二:取阴极附近的棕褐色溶液,重复上述实验进行对照,请画出对照实验的流程图
实验结论:通过对照实验,确认棕褐色溶液与+1价Cu有关。
您最近一年使用:0次
解题方法
6 . 工业上处理含苯酚废水的过程如下。回答下列问题:
I.测定废水中苯酚的含量。
测定原理: +3Br2→
+3Br2→ ↓+3HBr
↓+3HBr
测定步骤:
步骤1:准确量取25.00mL待测废水于250mL锥形瓶中。
步骤2:将5.00mLamol/L浓溴水(过量)迅速加入到锥形瓶中,塞紧瓶塞,振荡。
步骤3:打开瓶塞,向锥形瓶中迅速加入bmL0.10mol/LKI溶液(过量),塞紧瓶塞,振荡。
步骤4:以淀粉作指示剂,用0.010mol/LNa2S2O3标准溶液滴定至终点,消耗Na2S2O3标准溶液V1mL。(反应原理:I2+2Na2S2O3=2NaI+Na2S4O6)
把待测废水换为蒸馏水,重复上述各步骤(即进行空白实验),消耗Na2S2O3标准溶液V2mL(以上数据均已扣除干扰因素)。
(1)步骤1中量取待测废水所用仪器是_________ 。
(2)步骤2中塞紧瓶塞的原因是_________ 。
(3)步骤4中滴定终点的现象为_________ 。
(4)该废水中苯酚的含量为_________ mg/L(用含V1、V2的代数式表示)。
(5)如果“步骤4”滴定至终点时仰视读数,则测得消耗Na2S2O3标准溶液的体积_____ V1mL(填“偏大”、“偏小”或“无影响”,下同);如果空白实验中的“步骤2”忘记塞紧瓶塞,则测得的废水中苯酚的含量_________ 。
II.处理废水。
采用Ti基PbO2为阳极,不锈钢为阴极,含苯酚的废水为电解液,通过电解,阳极上产生羟基(•OH),阴极上产生H2O2。通过交替排列的阴阳两极的协同作用,在各自区域将苯酚深度氧化为CO2和H2O。
(6)写出阳极的电极反应式:_________ 。
(7)写出苯酚在阴极附近被H2O2深度氧化的化学方程式:_________ 。
I.测定废水中苯酚的含量。
测定原理:
 +3Br2→
+3Br2→ ↓+3HBr
↓+3HBr测定步骤:
步骤1:准确量取25.00mL待测废水于250mL锥形瓶中。
步骤2:将5.00mLamol/L浓溴水(过量)迅速加入到锥形瓶中,塞紧瓶塞,振荡。
步骤3:打开瓶塞,向锥形瓶中迅速加入bmL0.10mol/LKI溶液(过量),塞紧瓶塞,振荡。
步骤4:以淀粉作指示剂,用0.010mol/LNa2S2O3标准溶液滴定至终点,消耗Na2S2O3标准溶液V1mL。(反应原理:I2+2Na2S2O3=2NaI+Na2S4O6)
把待测废水换为蒸馏水,重复上述各步骤(即进行空白实验),消耗Na2S2O3标准溶液V2mL(以上数据均已扣除干扰因素)。
(1)步骤1中量取待测废水所用仪器是
(2)步骤2中塞紧瓶塞的原因是
(3)步骤4中滴定终点的现象为
(4)该废水中苯酚的含量为
(5)如果“步骤4”滴定至终点时仰视读数,则测得消耗Na2S2O3标准溶液的体积
II.处理废水。
采用Ti基PbO2为阳极,不锈钢为阴极,含苯酚的废水为电解液,通过电解,阳极上产生羟基(•OH),阴极上产生H2O2。通过交替排列的阴阳两极的协同作用,在各自区域将苯酚深度氧化为CO2和H2O。
(6)写出阳极的电极反应式:
(7)写出苯酚在阴极附近被H2O2深度氧化的化学方程式:
您最近一年使用:0次
解题方法
7 . 工业上处理含苯酚废水的过程如下。回答下列问题:
Ⅰ.测定废水中苯酚的含量。
测定原理:

测定步骤:
步骤1:准确量取 待测废水于
待测废水于 锥形瓶中。
锥形瓶中。
步骤2:将
 浓溴水(量)迅速加入到锥形瓶中,塞紧瓶塞,振荡。
浓溴水(量)迅速加入到锥形瓶中,塞紧瓶塞,振荡。
步骤3:打开瓶塞,向锥形瓶中迅速加入

 溶液(过量),塞紧瓶塞,振荡。
溶液(过量),塞紧瓶塞,振荡。
步骤4:滴入2~3滴指示剂,再用
 标准溶液滴定至终点,消耗
标准溶液滴定至终点,消耗 溶液
溶液 (反应原理:
(反应原理: )。待测废水换为蒸馏水,重复上述步骤(即进行空白实验),消耗
)。待测废水换为蒸馏水,重复上述步骤(即进行空白实验),消耗 溶液
溶液 。
。
(1)“步骤1”量取待测废水所用仪器是________ 。
(2)为了防止溴的挥发,上述步骤中采取的措施包括迅速加入试剂和________ 。
(3)“步骤4”滴定终点的现象为________ 。
(4)该废水中苯酚的含量为________  (用含
(用含 、
、 的代数式表示)。如果空白实验中“步骤2”忘记塞紧瓶塞,则测得的废水中苯酚的含量
的代数式表示)。如果空白实验中“步骤2”忘记塞紧瓶塞,则测得的废水中苯酚的含量________ (填“偏高”“偏低”或“无影响”,下同);如果空白实验中“步骤4”滴定至终点时俯视读数,则测得的废水中苯酚的含量________ 。
Ⅱ.处理废水。采用 基
基 为阳极,不锈钢为阴极,含苯酚的废水为电解液,通过电解,阳极上产生羟基(·
为阳极,不锈钢为阴极,含苯酚的废水为电解液,通过电解,阳极上产生羟基(· ),阴极上产生
),阴极上产生 。通过交排列的阴阳两极的协同作用,在各自区域将苯酚深度氧化为
。通过交排列的阴阳两极的协同作用,在各自区域将苯酚深度氧化为 和
和 。
。
(5)写出阳极的电极反应式:________ 。
(6)写出苯酚在阴极附近被 深度氧化的化学方程式:
深度氧化的化学方程式:________ 。
Ⅰ.测定废水中苯酚的含量。
测定原理:

测定步骤:
步骤1:准确量取
 待测废水于
待测废水于 锥形瓶中。
锥形瓶中。步骤2:将

 浓溴水(量)迅速加入到锥形瓶中,塞紧瓶塞,振荡。
浓溴水(量)迅速加入到锥形瓶中,塞紧瓶塞,振荡。步骤3:打开瓶塞,向锥形瓶中迅速加入


 溶液(过量),塞紧瓶塞,振荡。
溶液(过量),塞紧瓶塞,振荡。步骤4:滴入2~3滴指示剂,再用

 标准溶液滴定至终点,消耗
标准溶液滴定至终点,消耗 溶液
溶液 (反应原理:
(反应原理: )。待测废水换为蒸馏水,重复上述步骤(即进行空白实验),消耗
)。待测废水换为蒸馏水,重复上述步骤(即进行空白实验),消耗 溶液
溶液 。
。(1)“步骤1”量取待测废水所用仪器是
(2)为了防止溴的挥发,上述步骤中采取的措施包括迅速加入试剂和
(3)“步骤4”滴定终点的现象为
(4)该废水中苯酚的含量为
 (用含
(用含 、
、 的代数式表示)。如果空白实验中“步骤2”忘记塞紧瓶塞,则测得的废水中苯酚的含量
的代数式表示)。如果空白实验中“步骤2”忘记塞紧瓶塞,则测得的废水中苯酚的含量Ⅱ.处理废水。采用
 基
基 为阳极,不锈钢为阴极,含苯酚的废水为电解液,通过电解,阳极上产生羟基(·
为阳极,不锈钢为阴极,含苯酚的废水为电解液,通过电解,阳极上产生羟基(· ),阴极上产生
),阴极上产生 。通过交排列的阴阳两极的协同作用,在各自区域将苯酚深度氧化为
。通过交排列的阴阳两极的协同作用,在各自区域将苯酚深度氧化为 和
和 。
。(5)写出阳极的电极反应式:
(6)写出苯酚在阴极附近被
 深度氧化的化学方程式:
深度氧化的化学方程式:
您最近一年使用:0次
2020高三·全国·专题练习
解题方法
8 . 水中的溶解氧是水生生物生存不可缺少的条件。某课外小组采用碘量法测定学校周边河水中的溶解氧。实验步骤及测定原理如下:
Ⅰ.取样、氧的固定
用溶解氧瓶采集水样。记录大气压及水体温度。将水样与Mn(OH)2碱性悬浊液(含有KI)混合,反应生成MnO(OH)2,实现氧的固定。
Ⅱ.酸化、滴定
将固氧后的水样酸化,MnO(OH)2被I−还原为Mn2+,在暗处静置5 min,然后用标准Na2S2O3溶液滴定生成的I2(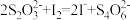 )。
)。
回答下列问题:
(1)“氧的固定”中发生反应的化学方程式为_______________ 。
(2)Na2S2O3溶液不稳定,使用前需标定。配制该溶液时需要的玻璃仪器有烧杯、玻璃棒、试剂瓶和____________ ;蒸馏水必须经过煮沸、冷却后才能使用,其目的是杀菌、除____ 及二氧化碳。
(3)取100.00 mL水样经固氧、酸化后,用a mol·L−1Na2S2O3溶液滴定,以淀粉溶液作指示剂,终点现象为_________ ;若消耗Na2S2O3溶液的体积为b mL,则水样中溶解氧的含量为_________ mg·L−1。
(4)上述滴定完成时,若滴定管尖嘴处留有气泡会导致测量结果偏___________ 。(填“高”或“低”)
Ⅰ.取样、氧的固定
用溶解氧瓶采集水样。记录大气压及水体温度。将水样与Mn(OH)2碱性悬浊液(含有KI)混合,反应生成MnO(OH)2,实现氧的固定。
Ⅱ.酸化、滴定
将固氧后的水样酸化,MnO(OH)2被I−还原为Mn2+,在暗处静置5 min,然后用标准Na2S2O3溶液滴定生成的I2(
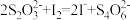 )。
)。回答下列问题:
(1)“氧的固定”中发生反应的化学方程式为
(2)Na2S2O3溶液不稳定,使用前需标定。配制该溶液时需要的玻璃仪器有烧杯、玻璃棒、试剂瓶和
(3)取100.00 mL水样经固氧、酸化后,用a mol·L−1Na2S2O3溶液滴定,以淀粉溶液作指示剂,终点现象为
(4)上述滴定完成时,若滴定管尖嘴处留有气泡会导致测量结果偏
您最近一年使用:0次
9 . 牛奶和奶粉中添加三聚氰胺,主要是因为它能冒充蛋白质。已知三聚氰胺中含有碳、氢、氮三种元素,其相对分子质量为126,为测定三聚氰胺的组成,用下列各仪器装置,在过量的氧气流中将2.52g三聚氰胺样品氧化成CO2、H2O和N2,装置F中CuO的作用是氧化没有燃烧完全的CO。回答下列问题:
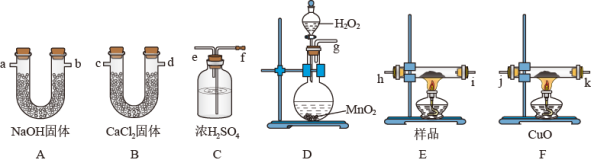
(1)产生的氧气按从左向右流向,所选装置各导管的连接顺序是:g接 、 接 、 接j、k接 、 接 ;___
(2)装置C的作用是___ ;装置D中发生反应的化学方程式是___ ;
(3)实验前后称得A、B两装置的质量分别增加2.64g和1.08g,则三聚氰胺分子中碳、氢、氮的原子个数比为___ ;
(4)目前较多采用以尿素为原料,在0.1MPa下,390℃左右时,以硅胶做催化剂合成三聚氰胺。反应过程中,除生成CO2外,还生成一种使湿润的红色石蕊试纸变蓝的气体,试写出制备三聚氰胺的化学方程式(有机物可用分子式表示)___ ;
(5)按(1)的连接方法,此实验装置存在的缺点是___ ,原因是___ 。

(1)产生的氧气按从左向右流向,所选装置各导管的连接顺序是:g接 、 接 、 接j、k接 、 接 ;
(2)装置C的作用是
(3)实验前后称得A、B两装置的质量分别增加2.64g和1.08g,则三聚氰胺分子中碳、氢、氮的原子个数比为
(4)目前较多采用以尿素为原料,在0.1MPa下,390℃左右时,以硅胶做催化剂合成三聚氰胺。反应过程中,除生成CO2外,还生成一种使湿润的红色石蕊试纸变蓝的气体,试写出制备三聚氰胺的化学方程式(有机物可用分子式表示)
(5)按(1)的连接方法,此实验装置存在的缺点是
您最近一年使用:0次
名校
10 . 砷为VA族元素,金属冶炼过程产生的含砷有毒废弃物需处理与检测。
I.冶炼废水中砷元素主要以亚砷酸(H3AsO3)形式存在,可用化学沉降法处理酸性高浓度含砷废水,其工艺流程如图:
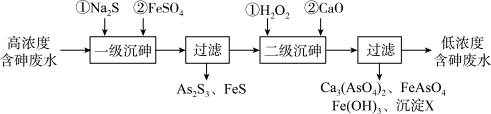
已知:①As2S3与过量的S2-存在以下反应:As2S3(s)+3S2-(aq) 2AsS33-(aq);
2AsS33-(aq);
②亚砷酸盐的溶解性大于相应砷酸盐。
(1)亚砷酸中砷元素的化合价为____ ;砷酸的第一步电离方程式为______ 。
(2)“一级沉砷”中FeSO4的作用是_____ ;“二级沉砷”中H2O2与含砷物质反应的化学方程式为_______ 。
(3)沉淀X为____ (填化学式)。
Ⅱ.冶炼废渣中的砷元素主要以As2S3的形式存在,粉碎后与锌粉混合,加入H2SO4共热,生成AsH3气体。将AsH3气体通入AgNO3溶液中,生成银镜和As2O3。
(4)AsH3的电子式为______ 。
I.冶炼废水中砷元素主要以亚砷酸(H3AsO3)形式存在,可用化学沉降法处理酸性高浓度含砷废水,其工艺流程如图:

已知:①As2S3与过量的S2-存在以下反应:As2S3(s)+3S2-(aq)
 2AsS33-(aq);
2AsS33-(aq);②亚砷酸盐的溶解性大于相应砷酸盐。
(1)亚砷酸中砷元素的化合价为
(2)“一级沉砷”中FeSO4的作用是
(3)沉淀X为
Ⅱ.冶炼废渣中的砷元素主要以As2S3的形式存在,粉碎后与锌粉混合,加入H2SO4共热,生成AsH3气体。将AsH3气体通入AgNO3溶液中,生成银镜和As2O3。
(4)AsH3的电子式为
您最近一年使用:0次
2019-09-27更新
|
339次组卷
|
2卷引用:河北省秦皇岛市六校2020届高三上学期期初检测联考化学试题



