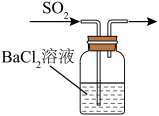
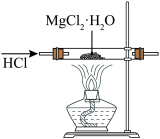
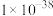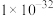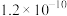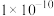1 . 下列选用的仪器和装置能达到实验目的的是
| A | B |
|
|
| 如图所示,关闭弹簧夹检查装置的气密性 | 用上图所示装置吸收 |
| C | D |
|
|
| 检验溴乙烷与NaOH醇溶液共热产生的乙烯 | 制取无水 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
2 . 某小组以废铁屑(久置但未生锈)为原料制备Fe(NO3)3,并利用配制的Fe(NO3)3标准溶液对“硫酸亚铁补铁剂”中铁元素的含量进行测定,实验过程如下:
【实验Ⅰ】Fe(NO3)3·9H2O的制备___________ ;稀硝酸要足量的目的有:①确保铁元素转化成Fe3+,②___________ 。
(2)操作A为在足量稀硝酸存在下蒸发浓缩、冷却结晶、过滤、洗涤、干燥。操作A需要用到的玻璃仪器有烧杯、漏斗、酒精灯、干燥器、___________ 。
【实验Ⅱ】标准Fe(NO3)3溶液的配制。
准确称取0.8080g Fe(NO3)3·9H2O配成100mL 0.02000mol/L溶液。
(3)下列操作会导致所配Fe(NO3)3溶液浓度偏低的是___________(填字母)。
【实验Ⅲ】绘制Fe3+标准溶液与吸光度A(对特定波长光的吸收程度,数值与有色物质的浓度大小有关)的标准曲线。
①分别向6个100mL容量瓶中加入0.50、0.75、1.00、1.25、1.50、2.00mL实验Ⅱ中标定的浓度为0.0200mol·L-1的Fe(NO3)3标准溶液,然后分别加入1.50mL某浓度KSCN溶液,用蒸馏水定容。
②将配好的溶液加入10mL比色皿中,分别测定其吸光度,所得数据如下表所示:
___________ ,b=___________ 。
【实验Ⅳ】“硫酸亚铁补铁剂”中铁元素含量的测定
①取1.000g补铁剂样品,溶解后再加入足量H2O2溶液充分反应后配成100mL溶液。
②取1.0mL上一步所配溶液于100mL容量瓶中,加入1.50mL某浓度KSCN溶液,用蒸馏水定容。
③将最终配好的溶液加到10mL比色皿中,在与【实验Ⅲ】步骤②中相同条件下测得溶液吸光度A=0.35。
(5)“硫酸亚铁补铁剂”中铁元素的质量分数为___________ %。
(6)下列操作中有利于更准确测得补铁剂中的铁元素含量的有___________(填字母)。
【实验Ⅰ】Fe(NO3)3·9H2O的制备

(2)操作A为在足量稀硝酸存在下蒸发浓缩、冷却结晶、过滤、洗涤、干燥。操作A需要用到的玻璃仪器有烧杯、漏斗、酒精灯、干燥器、
【实验Ⅱ】标准Fe(NO3)3溶液的配制。
准确称取0.8080g Fe(NO3)3·9H2O配成100mL 0.02000mol/L溶液。
(3)下列操作会导致所配Fe(NO3)3溶液浓度偏低的是___________(填字母)。
| A.溶液未恢复室温就注入容量瓶定容 |
| B.定容时俯视液面 |
| C.摇匀后发现液面低于刻度线,于是加水至刻度线 |
| D.容量瓶底部残留少量的蒸馏水而未做干燥处理 |
【实验Ⅲ】绘制Fe3+标准溶液与吸光度A(对特定波长光的吸收程度,数值与有色物质的浓度大小有关)的标准曲线。
①分别向6个100mL容量瓶中加入0.50、0.75、1.00、1.25、1.50、2.00mL实验Ⅱ中标定的浓度为0.0200mol·L-1的Fe(NO3)3标准溶液,然后分别加入1.50mL某浓度KSCN溶液,用蒸馏水定容。
②将配好的溶液加入10mL比色皿中,分别测定其吸光度,所得数据如下表所示:
| 比色管编号 | S1 | S2 | S3 | S4 | S₅ | S6 |
| Fe(NO3)3溶液/mL | 0.50 | 0.75 | 1.00 | 1.25 | 1.50 | 2.00 |
| c(Fe3+)/(10-4mol·L-1) | 1 | 1.5 | 2 | 2.5 | 3 | 4 |
| 吸光度A | 0.12 | 0.17 | 0.22 | 0.27 | 0.32 | 0.42 |

【实验Ⅳ】“硫酸亚铁补铁剂”中铁元素含量的测定
①取1.000g补铁剂样品,溶解后再加入足量H2O2溶液充分反应后配成100mL溶液。
②取1.0mL上一步所配溶液于100mL容量瓶中,加入1.50mL某浓度KSCN溶液,用蒸馏水定容。
③将最终配好的溶液加到10mL比色皿中,在与【实验Ⅲ】步骤②中相同条件下测得溶液吸光度A=0.35。
(5)“硫酸亚铁补铁剂”中铁元素的质量分数为
(6)下列操作中有利于更准确测得补铁剂中的铁元素含量的有___________(填字母)。
| A.提前除去【实验Ⅰ】溶解铁屑所用硝酸中的Fe3+杂质 |
| B.用浓硝酸溶液代替【实验Ⅳ】中所用的H2O2溶液 |
| C.整个实验中均采用相同浓度的KSCN溶液 |
| D.对每一份溶液平行测定多次吸光度A,取平均值作结果 |
您最近一年使用:0次
3 . 实验室利用如图左侧装置测量锌的相对原子质量。 纯锌与
纯锌与 反应(设锌全部参加反应,产生气体在量程范围内,气体的密度为0.0893g/L)。请回答下列问题。
反应(设锌全部参加反应,产生气体在量程范围内,气体的密度为0.0893g/L)。请回答下列问题。

(1)检验该装置的气密性的方法是___________ 。
(2)实验结束,恢复到室温后测定C中收集到液体的体积为 ,则锌的相对原子质量表达式为
,则锌的相对原子质量表达式为___________ 。如果锌的质量是准确的,用如图左侧所示的装置测得锌的相对原子质量可能偏小,请说明原因:___________ 。
(3)若气体测量装置部分改为如图右侧甲、乙管的装置,要保证容器内气压与大气压一致的操作是___________ ,读数时注意视线___________ 。
 纯锌与
纯锌与 反应(设锌全部参加反应,产生气体在量程范围内,气体的密度为0.0893g/L)。请回答下列问题。
反应(设锌全部参加反应,产生气体在量程范围内,气体的密度为0.0893g/L)。请回答下列问题。
(1)检验该装置的气密性的方法是
(2)实验结束,恢复到室温后测定C中收集到液体的体积为
 ,则锌的相对原子质量表达式为
,则锌的相对原子质量表达式为(3)若气体测量装置部分改为如图右侧甲、乙管的装置,要保证容器内气压与大气压一致的操作是
您最近一年使用:0次
解题方法
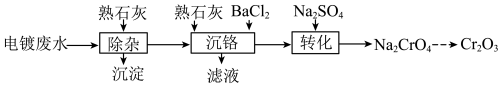
4 . 以电镀废水(主要成分为 及少量
及少量 )为原料获得
)为原料获得 的过程如下:
的过程如下:
已知:①常温下, 易溶于水。
易溶于水。
部分难溶物的溶度积常数如下表:
|
|
|
| |
|
|
|
|
|
②Cr(Ⅵ)在酸性条件下主要以 (橙红色)的形式存在,pH增大转化为
(橙红色)的形式存在,pH增大转化为 (黄色)。
(黄色)。 ,Cr(Ⅵ)较易还原生成
,Cr(Ⅵ)较易还原生成 (绿色)。
(绿色)。
③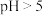 时
时 完全转化为
完全转化为 ,
, 时
时 开始转化为
开始转化为 。
。
(1)“除杂”时调节废水pH将其中
 除去(浓度小于
除去(浓度小于 mol⋅L
mol⋅L ),需加入熟石灰控制废水pH大于
),需加入熟石灰控制废水pH大于(2)“沉铬”时先加入
 调节废水pH,再加入
调节废水pH,再加入 使废水中的Cr(Ⅵ)转化为
使废水中的Cr(Ⅵ)转化为 。调节后的废水pH对Cr(Ⅵ)沉淀率的影响如图所示。
。调节后的废水pH对Cr(Ⅵ)沉淀率的影响如图所示。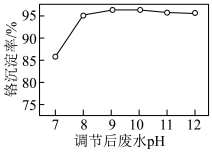
①沉铬过程中将 转化为
转化为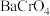 反应的化学方程式为
反应的化学方程式为
②废水 时,铬沉淀率随pH减小而下降的原因是
时,铬沉淀率随pH减小而下降的原因是
③在废水中加入 沉淀前后废水pH
沉淀前后废水pH
(3)“转化”时将
 转化为
转化为 。
。 的转化率随着
的转化率随着 浓度的变化如图所示。当
浓度的变化如图所示。当 浓度超过0.450 mol⋅L
浓度超过0.450 mol⋅L 时,Cr(Ⅵ)的转化率随
时,Cr(Ⅵ)的转化率随 浓度增大变化不明显,其原因是
浓度增大变化不明显,其原因是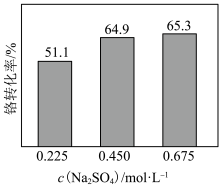
(4)请补充完整由
 溶液制取
溶液制取 的实验方案:向
的实验方案:向 溶液中,
溶液中, 。(可选用的仪器与药品:
。(可选用的仪器与药品: 、稀
、稀 、NaOH溶液)
、NaOH溶液)
您最近一年使用:0次
2024-03-26更新
|
622次组卷
|
2卷引用:江苏省苏锡常镇四市2024届高三一模考试化学试题
名校
解题方法
5 . “消洗灵”(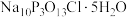 )具有消毒、杀菌、漂白和洗涤等综合功效,是一种广谱、高效、低毒的消毒洗涤剂。某兴趣小组实验室中利用反应
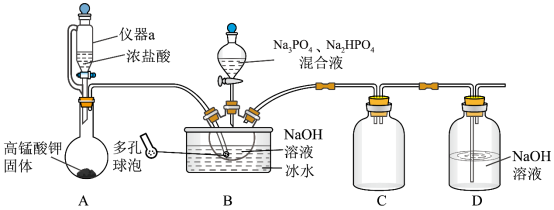
)具有消毒、杀菌、漂白和洗涤等综合功效,是一种广谱、高效、低毒的消毒洗涤剂。某兴趣小组实验室中利用反应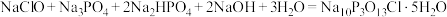 制备“消洗灵”,反应装置如图所示(夹持装置略)。
制备“消洗灵”,反应装置如图所示(夹持装置略)。
已知: 与
与 溶液在加热的条件下反应生成
溶液在加热的条件下反应生成 和
和 ;
;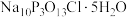 中的Cl显+1价。
中的Cl显+1价。
回答下列问题:
(1)仪器a的名称是___________ ,装置A中发生反应的离子方程式为___________ 。
(2)装置B中采用多孔球泡的目的是___________ 。
(3)打开仪器a的活塞及活塞K,制备 碱性溶液;关闭仪器a的活塞及活塞K,打开装置B中分液漏斗活塞;一段时间后,装置B中溶液经“系列操作”,得到粗产品。
碱性溶液;关闭仪器a的活塞及活塞K,打开装置B中分液漏斗活塞;一段时间后,装置B中溶液经“系列操作”,得到粗产品。
①上述装置存在一处缺陷,会使“消洗灵”(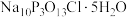 )的产率降低,改进的方法是
)的产率降低,改进的方法是___________ 。
②装置B用冰水浴的原因是___________ 。
(4)利用滴定法测定产品的纯度(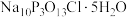 的摩尔质量为
的摩尔质量为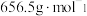 )。实验方案如下:
)。实验方案如下:
I.取 产品试样溶于蒸馏水中配成
产品试样溶于蒸馏水中配成 溶液;
溶液;
Ⅱ.量取 。待测液于锥形瓶中,加入
。待测液于锥形瓶中,加入 硫酸溶液、
硫酸溶液、 溶液(过量),暗处静置
溶液(过量),暗处静置 ;
;
Ⅲ.滴加2-3滴淀粉溶液,用 标准溶液滴定,发生反应
标准溶液滴定,发生反应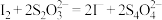 。平行滴定三次,平均消耗
。平行滴定三次,平均消耗 标准溶液。
标准溶液。
① 标准溶液应放在
标准溶液应放在___________ (填“碱”或“酸”)式滴定管中。
②该产品的纯度为___________ (保留三位有效数字)。
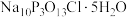 )具有消毒、杀菌、漂白和洗涤等综合功效,是一种广谱、高效、低毒的消毒洗涤剂。某兴趣小组实验室中利用反应
)具有消毒、杀菌、漂白和洗涤等综合功效,是一种广谱、高效、低毒的消毒洗涤剂。某兴趣小组实验室中利用反应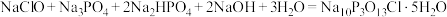 制备“消洗灵”,反应装置如图所示(夹持装置略)。
制备“消洗灵”,反应装置如图所示(夹持装置略)。
已知:
 与
与 溶液在加热的条件下反应生成
溶液在加热的条件下反应生成 和
和 ;
;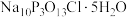 中的Cl显+1价。
中的Cl显+1价。回答下列问题:
(1)仪器a的名称是
(2)装置B中采用多孔球泡的目的是
(3)打开仪器a的活塞及活塞K,制备
 碱性溶液;关闭仪器a的活塞及活塞K,打开装置B中分液漏斗活塞;一段时间后,装置B中溶液经“系列操作”,得到粗产品。
碱性溶液;关闭仪器a的活塞及活塞K,打开装置B中分液漏斗活塞;一段时间后,装置B中溶液经“系列操作”,得到粗产品。①上述装置存在一处缺陷,会使“消洗灵”(
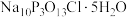 )的产率降低,改进的方法是
)的产率降低,改进的方法是②装置B用冰水浴的原因是
(4)利用滴定法测定产品的纯度(
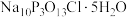 的摩尔质量为
的摩尔质量为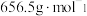 )。实验方案如下:
)。实验方案如下:I.取
 产品试样溶于蒸馏水中配成
产品试样溶于蒸馏水中配成 溶液;
溶液;Ⅱ.量取
 。待测液于锥形瓶中,加入
。待测液于锥形瓶中,加入 硫酸溶液、
硫酸溶液、 溶液(过量),暗处静置
溶液(过量),暗处静置 ;
;Ⅲ.滴加2-3滴淀粉溶液,用
 标准溶液滴定,发生反应
标准溶液滴定,发生反应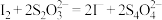 。平行滴定三次,平均消耗
。平行滴定三次,平均消耗 标准溶液。
标准溶液。①
 标准溶液应放在
标准溶液应放在②该产品的纯度为
您最近一年使用:0次
名校
6 . 下列实验方案可以得到白色纯净的 Fe(OH)2 的是
| A.在 FeCl2 溶液上加一层苯,然后将滴管插入到 FeCl2 溶液液面以下,慢慢滴加 NaOH溶液(溶液中不能有气泡,配制 FeCl2 溶液和 NaOH 溶液的蒸馏水必须加热煮沸) |
| B.将铁粉与稀硫酸充分反应,然后再加入过量的氨水 |
| C.在 Fe2(SO4)3 溶料中加入过量的铁粉,过滤,在滤液中加入过量的 NaOH 溶液 |
| D.在生成 Fe(OH)3 的悬浊液中加过量的铁粉 |
您最近一年使用:0次
2021-06-30更新
|
798次组卷
|
6卷引用:黑龙江省大庆市大庆中学2023-2024学年高一下学期开学化学试题
黑龙江省大庆市大庆中学2023-2024学年高一下学期开学化学试题江苏省常州市新桥镇高中2020-2021学年高一下学期期末考试化学试题(已下线)3.1.1 铁及其氧化物、氢氧化物-2021-2022学年高一化学课后培优练(人教版2019必修第一册)(已下线)新人教必修1第3章第一节第2课时铁的氧化物和氢氧化物(课后)(已下线)第三章 铁 金属材料(A卷·知识通关练)-【单元测试】2022-2023学年高一化学分层训练AB卷(人教版2019必修第一册)山东省菏泽市第一中学2023-2024学年高一上学期第三次月考化学试题
名校
解题方法
7 . 以废弃小铁钉和赤铁矿渣(主要成分为Fe2O3、SiO2和少量Al2O3)为原料均能制备FeSO4·7H2O晶体。
(1)取4g废弃小铁钉,先用浓度为10%的碳酸钠溶液清除油渍,然后用倾斜法倒去碳酸钠溶液,用蒸馏水洗涤2-3次后,再加到如图所示的三颈烧瓶中,再加入15mL4.6mol·L-1的硫酸溶液。控制70~80℃水浴加热10~15分钟,将所得溶液经趁热过滤、冷却结晶、过滤、洗涤等操作,得到FeSO4·7H2O晶体。_____ 。
②用冷水洗涤FeSO4·7H2O晶体的操作是_____ 。
③将FeSO4·7H2O晶体在隔绝空气条件下加热到800℃,生成红棕色固体,写出反应方程式_____ 。
(2)以赤铁矿渣为原料制备FeSO4·7H2O晶体,请补充完整相应的实验方案:取一定量的赤铁矿渣,_____ ,向滤液中加乙醇,在恒温水浴槽中冷却结晶,过滤,用丙酮洗涤,干燥。
已知该实验中pH=3.5时,Fe3+沉淀完全;pH=4.1时,Al3+开始沉淀。实验中必须使用的试剂:1.0mol·L-1H2SO4、1.0mol·L-1NaOH、铁粉。
(3)通过下列方法测定产品纯度:准确称取3.000gFeSO4·7H2O样品,加适量水溶解,配成100mL溶液,取20.00mL溶液置于锥形瓶中,用0.02000mol·L-1的酸性KMnO4标准溶液滴定(杂质不与酸性KMnO4标准溶液反应),经3次测定,每次消耗KMnO4溶液的体积如下:
通过计算确定产品中FeSO4·7H2O的质量分数为_____ (写出具体计算过程)。
(1)取4g废弃小铁钉,先用浓度为10%的碳酸钠溶液清除油渍,然后用倾斜法倒去碳酸钠溶液,用蒸馏水洗涤2-3次后,再加到如图所示的三颈烧瓶中,再加入15mL4.6mol·L-1的硫酸溶液。控制70~80℃水浴加热10~15分钟,将所得溶液经趁热过滤、冷却结晶、过滤、洗涤等操作,得到FeSO4·7H2O晶体。

②用冷水洗涤FeSO4·7H2O晶体的操作是
③将FeSO4·7H2O晶体在隔绝空气条件下加热到800℃,生成红棕色固体,写出反应方程式
(2)以赤铁矿渣为原料制备FeSO4·7H2O晶体,请补充完整相应的实验方案:取一定量的赤铁矿渣,
已知该实验中pH=3.5时,Fe3+沉淀完全;pH=4.1时,Al3+开始沉淀。实验中必须使用的试剂:1.0mol·L-1H2SO4、1.0mol·L-1NaOH、铁粉。
(3)通过下列方法测定产品纯度:准确称取3.000gFeSO4·7H2O样品,加适量水溶解,配成100mL溶液,取20.00mL溶液置于锥形瓶中,用0.02000mol·L-1的酸性KMnO4标准溶液滴定(杂质不与酸性KMnO4标准溶液反应),经3次测定,每次消耗KMnO4溶液的体积如下:
| 实验序号 | 1 | 2 | 3 |
| 消耗KMnO4溶液体积 | 19.98mL | 20.58mL | 20.02mL |
您最近一年使用:0次
2021-02-15更新
|
615次组卷
|
3卷引用:大题02 化学实验综合题(分类过关)-【大题精做】冲刺2024年高考化学大题突破+限时集训(新高考专用)
(已下线)大题02 化学实验综合题(分类过关)-【大题精做】冲刺2024年高考化学大题突破+限时集训(新高考专用)江苏省G4(苏州中学、盐城中学、扬州中学、常州中学)2021届高三上学期期末调研化学试题江苏省扬州中学2021-2022学年高二上学期期中考试化学试题
名校
8 . 硫代硫酸钠晶体(Na2S2O3∙5H2O,M=248g∙mol−1)可用作定影剂、还原剂。回答下列问题:
(1)已知:Na2S2O3为易溶于水的固体,往Na2S2O3溶液中加入稀盐酸会发生歧化反应 +2H+=S↓+SO2↑+2H2O。BaS2O3为难溶于水的固体。市售硫代硫酸钠中常含有硫酸根杂质,选用下列试剂设计实验方案进行检验:
+2H+=S↓+SO2↑+2H2O。BaS2O3为难溶于水的固体。市售硫代硫酸钠中常含有硫酸根杂质,选用下列试剂设计实验方案进行检验:
试剂:稀盐酸、稀H2SO4、BaCl2溶液、Na2CO3溶液、H2O2溶液
(2)利用K2Cr2O7标准溶液定量测定硫代硫酸钠的纯度。测定步骤如下:
①溶液配制:称取1.2000g某硫代硫酸钠晶体样品,用新煮沸并冷却的蒸馏水在______ 中溶解,完全溶解后,全部转移至100mL_______ 中,加蒸馏水至______ 。
②滴定:取0.00950mol∙L−1的K2Cr2O7(强氧化性物质,其还原产物为Cr3+)标准溶液20.00mL,硫酸酸化后加入过量KI(强还原性物质),发生反应的离子方程式为_____ 然后用硫代硫酸钠样品溶液滴定至淡黄绿色,发生反应I2+2 =
=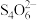 +2I-加入淀粉溶液作为指示剂,继续滴定,当溶液由蓝色变为无色且2半分钟不复原,即为终点。平行滴定3次,样品溶液的平均用量为24.80mL,则样品纯度为
+2I-加入淀粉溶液作为指示剂,继续滴定,当溶液由蓝色变为无色且2半分钟不复原,即为终点。平行滴定3次,样品溶液的平均用量为24.80mL,则样品纯度为_____ %(保留1位小数)。
(1)已知:Na2S2O3为易溶于水的固体,往Na2S2O3溶液中加入稀盐酸会发生歧化反应
 +2H+=S↓+SO2↑+2H2O。BaS2O3为难溶于水的固体。市售硫代硫酸钠中常含有硫酸根杂质,选用下列试剂设计实验方案进行检验:
+2H+=S↓+SO2↑+2H2O。BaS2O3为难溶于水的固体。市售硫代硫酸钠中常含有硫酸根杂质,选用下列试剂设计实验方案进行检验:试剂:稀盐酸、稀H2SO4、BaCl2溶液、Na2CO3溶液、H2O2溶液
实验步骤 | 现象 |
①取少量样品,加入除氧蒸馏水 | ②固体完全溶解得无色澄清溶液 |
③ | ④有淡黄色沉淀和刺激性气体产生 |
⑤静置, | ⑥ |
①溶液配制:称取1.2000g某硫代硫酸钠晶体样品,用新煮沸并冷却的蒸馏水在
②滴定:取0.00950mol∙L−1的K2Cr2O7(强氧化性物质,其还原产物为Cr3+)标准溶液20.00mL,硫酸酸化后加入过量KI(强还原性物质),发生反应的离子方程式为
 =
=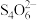 +2I-加入淀粉溶液作为指示剂,继续滴定,当溶液由蓝色变为无色且2半分钟不复原,即为终点。平行滴定3次,样品溶液的平均用量为24.80mL,则样品纯度为
+2I-加入淀粉溶液作为指示剂,继续滴定,当溶液由蓝色变为无色且2半分钟不复原,即为终点。平行滴定3次,样品溶液的平均用量为24.80mL,则样品纯度为
您最近一年使用:0次
2020-12-28更新
|
97次组卷
|
2卷引用:重庆市乌江新高考协作体2023-2024学年高二下学期5月月考化学试题
名校
解题方法
9 . 某小组以Ba(OH)2、水、H2SO4、Na2SO4为实验对象探究离子反应发生的条件。
(1) Ba(OH)2与H2SO4在溶液中能发生__________ 反应。
a.置换反应 b.酸碱中和反应 c.复分解反应
(2) ①中灯泡不亮而②中加H2O后灯泡变亮的原因是加水后,Ba(OH)2发生了_______________ 。
(3) 用离子方程式 解释过程I中灯泡变暗的原因_______________ 。
(4) 实验2:用Na2SO4溶液替代稀H2SO4,重复实验进行对照。加入Na2SO4溶液过程中灯泡不熄灭,原因是_____ 。
通过实验1和2可知:离子反应发生的条件之一是生成沉淀。
(5) 在两份完全相同的Ba(OH)2溶液中,分别滴入H2SO4和NaHSO4溶液(说明:等体积溶液含H2SO4和NaHSO4微粒数相同),其导电能力随滴入溶液体积变化的曲线如图所示。
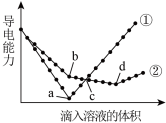
下列分析不正确 的是__________ 。
A. ①代表滴加H2SO4溶液的变化曲线
B. b点,溶液中大量存在的离子是Na+、OH-、SO
C. c点,两份溶液中含有相同量的OH-
D. a、d两点对应的溶液均显中性
| 实验1:向烧杯中 | |
 | ①Ba(OH)2粉末:灯泡不亮 ②加入蒸馏水:灯泡变亮 ③逐滴滴加0.1 mol/L H2SO4,灯泡变化如下: 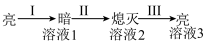 |
a.置换反应 b.酸碱中和反应 c.复分解反应
(2) ①中灯泡不亮而②中加H2O后灯泡变亮的原因是加水后,Ba(OH)2发生了
(3) 用
(4) 实验2:用Na2SO4溶液替代稀H2SO4,重复实验进行对照。加入Na2SO4溶液过程中灯泡不熄灭,原因是
通过实验1和2可知:离子反应发生的条件之一是生成沉淀。
(5) 在两份完全相同的Ba(OH)2溶液中,分别滴入H2SO4和NaHSO4溶液(说明:等体积溶液含H2SO4和NaHSO4微粒数相同),其导电能力随滴入溶液体积变化的曲线如图所示。

下列分析
A. ①代表滴加H2SO4溶液的变化曲线
B. b点,溶液中大量存在的离子是Na+、OH-、SO

C. c点,两份溶液中含有相同量的OH-
D. a、d两点对应的溶液均显中性
您最近一年使用:0次
2020-11-10更新
|
419次组卷
|
5卷引用:江西省兴国中学2023-2024学年高一下学期第一次月考(开学)化学试题
江西省兴国中学2023-2024学年高一下学期第一次月考(开学)化学试题北京交通大学附属中学2020-2021学年高一上学期期中考试化学试题(已下线)专题卷一 离子反应(A卷)-2021-2022学年高一化学优选好题单元专题双测卷(人教版2019必修第一册)北京市中关村中学2021-2022学年高一上学期期中考试化学试题黑龙江省绥化市第一中学2021-2022学年高一上学期期中考试化学试卷
10 . 为研究铜与浓硫酸的反应,实验小组同学进行如图实验,下列说法错误的是

| A.F中可以盛放酸性KMnO4溶液 |
| B.为确认有硫酸铜生成,可向反应后的A中加水 |
| C.此实验设计不能排除浓硫酸中的水是否影响B装置现象的判断 |
| D.可通过D中固体不变色而E中溶液褪色的现象证明浓硫酸中硫元素的氧化性强于氢元素 |
您最近一年使用:0次
2020-05-17更新
|
177次组卷
|
5卷引用:河北省石家庄市第二中学2023-2024学年高一下学期学情调研化学试题