名校
解题方法
1 . 从海水中不仅可获得淡水,而且可按如图工艺流程提取溴和镁。
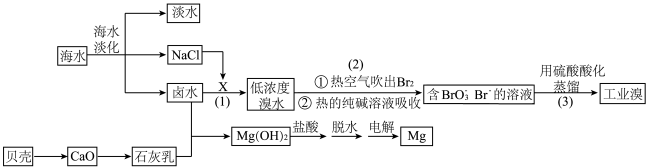
回答下列问题:
(1)海水淡化的方法有___________ 、电渗析法和反渗透法。
(2)步骤(1)中的X是一种黄绿色单质,X的电子式为___________ ,制备X的方法是电解饱和 溶液,电解时的离子方程式为
溶液,电解时的离子方程式为___________ 。
(3)检验某 溶液中是否混有
溶液中是否混有 的方法是
的方法是___________ 。
(4)溴单质与热的纯碱溶液反应有气体生成,该反应的化学方程式为___________ 。
(5)步骤(3)发生反应的离子方程式为___________ 。
(6)写出冶练金属镁的化学方程式:___________ 。

回答下列问题:
(1)海水淡化的方法有
(2)步骤(1)中的X是一种黄绿色单质,X的电子式为
 溶液,电解时的离子方程式为
溶液,电解时的离子方程式为(3)检验某
 溶液中是否混有
溶液中是否混有 的方法是
的方法是(4)溴单质与热的纯碱溶液反应有气体生成,该反应的化学方程式为
(5)步骤(3)发生反应的离子方程式为
(6)写出冶练金属镁的化学方程式:
您最近一年使用:0次
2023-07-07更新
|
144次组卷
|
2卷引用:河南省新乡市2022-2023学年高一下学期7月期末考试化学试题
名校
2 . 海洋中有丰富的食品、矿产、能源、药物和水产等资源,下图为海水综合利用的部分流程。回答下列问题:
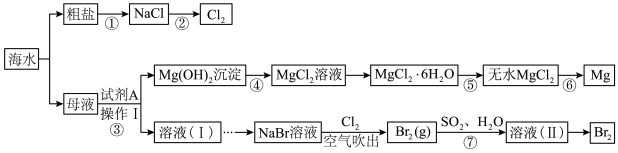
(1)粗盐中可溶性杂质离子包含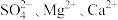 。要除去这些杂质离子得到精盐水,加入试剂的顺序可为
。要除去这些杂质离子得到精盐水,加入试剂的顺序可为_______ (填字母)。
a.NaOH溶液、BaCl2溶液、Na2CO3溶液、盐酸
b.NaOH溶液、Na2CO3溶液、BaCl2溶液、盐酸
c.BaCl2溶液、Na2CO3溶液、NaOH溶液、盐酸
(2)步骤③加入的试剂A是_______ ,然后进行的操作Ⅰ是_______ 。
(3)步骤①~⑦中,涉及氧化还原反应的步骤有_______ 。
(4)步骤⑥的化学方程式为_______ 。
(5)步骤⑦的离子方程式为_______ 。

(1)粗盐中可溶性杂质离子包含
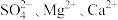 。要除去这些杂质离子得到精盐水,加入试剂的顺序可为
。要除去这些杂质离子得到精盐水,加入试剂的顺序可为a.NaOH溶液、BaCl2溶液、Na2CO3溶液、盐酸
b.NaOH溶液、Na2CO3溶液、BaCl2溶液、盐酸
c.BaCl2溶液、Na2CO3溶液、NaOH溶液、盐酸
(2)步骤③加入的试剂A是
(3)步骤①~⑦中,涉及氧化还原反应的步骤有
(4)步骤⑥的化学方程式为
(5)步骤⑦的离子方程式为
您最近一年使用:0次
解题方法
3 . 海洋资源的利用具有广阔前景。
(1)无需经过化学变化就能从海水中获得的物质是_______(填序号)
(2)下图是从海水中提取粗溴的主要流程

①从海水中提取溴的主要步骤是向浓缩的海水中通入氯气,将溴离子氧化,该反应的离子方程式是_______ 。
②可用热空气吹出溴是因为溴的_______ (选填编号)
A.熔点较低 B.熔点较高 C.沸点较低 D.沸点较高
(3)海带灰中富含以I-形式存在的碘元素。实验室提取I2的途径如下所示:
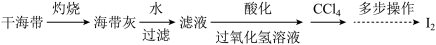
①灼烧海带至灰烬时所用的主要仪器名称是_______ 。
②向酸化的滤液中加过氧化氢溶液,写出该反应的离子方程式_______ 。反应结束后,再加入CCl4作萃取剂,振荡、静置,该步操作用到的仪器名称为_______ ,可以观察到CCl4层呈_______ 色。
(1)无需经过化学变化就能从海水中获得的物质是_______(填序号)
| A.Cl2 | B.淡水 | C.烧碱 | D.食盐 |

①从海水中提取溴的主要步骤是向浓缩的海水中通入氯气,将溴离子氧化,该反应的离子方程式是
②可用热空气吹出溴是因为溴的
A.熔点较低 B.熔点较高 C.沸点较低 D.沸点较高
(3)海带灰中富含以I-形式存在的碘元素。实验室提取I2的途径如下所示:
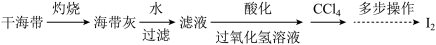
①灼烧海带至灰烬时所用的主要仪器名称是
②向酸化的滤液中加过氧化氢溶液,写出该反应的离子方程式
您最近一年使用:0次
4 . 以海水为基本原料可制取单质钠、氯气、纯碱等重要的化工产品,其中一种工艺流程如图所示(粗盐中的杂质主要是 、
、 ):
):

回答下列问题:
(1)利用盐田获得粗盐的过程主要发生的是_______ (填“物理变化”或“化学变化”),试剂X、Y的化学式分别为_______ (按加入的先后顺序写)。
(2)调pH之前必须进行的一项操作的名称是_______ ;生成小苏打的离子方程式是_______ 。
(3)由精盐制备钠的化学方程式是_______ 。
 、
、 ):
):
回答下列问题:
(1)利用盐田获得粗盐的过程主要发生的是
(2)调pH之前必须进行的一项操作的名称是
(3)由精盐制备钠的化学方程式是
您最近一年使用:0次
5 . 某NaCl样品中含有少量Na2CO3、Na2SO4和不溶于水的杂质,为了提纯NaCl,设计如下流程:

请据此回答下列问题:
(1)步骤①需要2次用到玻璃棒,其作用分别为_______ 、_______ ;
(2)步骤②中加入试剂I时反应的化学方程式为_______ 、_______ ;
(3)检验 沉淀完全的方法是取少量混合物A,
沉淀完全的方法是取少量混合物A,_______ ;步骤③的目的是_______ ;
(4)试剂III是_______ (填名称),加入它的目的是_______ ;
(5)步骤⑤需用玻璃棒不断搅拌,其目的是_______ 。

请据此回答下列问题:
(1)步骤①需要2次用到玻璃棒,其作用分别为
(2)步骤②中加入试剂I时反应的化学方程式为
(3)检验
 沉淀完全的方法是取少量混合物A,
沉淀完全的方法是取少量混合物A,(4)试剂III是
(5)步骤⑤需用玻璃棒不断搅拌,其目的是
您最近一年使用:0次
2021-09-22更新
|
133次组卷
|
2卷引用:河南省郑州市天一联考2020-2021学年高一上学期第一次月考化学试题
解题方法
6 . 阳离子交换膜法电解饱和食盐水、具有综合能耗低、环境污染小等优点。生产流程如图所示:

(1)粗盐提纯后还含有Ca2+、Mg2+及SO 等杂质离子,电解之前需要精制食盐水。除去粗盐中杂质离子的试剂的加入顺序是
等杂质离子,电解之前需要精制食盐水。除去粗盐中杂质离子的试剂的加入顺序是___________ (填写字母序号),过滤,再加入适量盐酸。
a.NaOH b. BaCl2 c.Na2 CO3
(2)电解饱和食盐水的化学方程式为_____________ 。电解一段时间后 , 若向浓烧碱溶液中通入CO2气体,使所得溶液c(HCO ):c(CO
):c(CO )=2∶1,则此时溶液中的c(H+)=
)=2∶1,则此时溶液中的c(H+)=_______ mol·L-1(室温下,H2CO3 Ka1=4×10-7, Ka2=5×10-11)
(3)电解结束后,能够脱去阳极液中游离氯的试剂或方法是________ (填字母序号)。
a.Na2SO3 b.NaNO3 c.热空气吹出 d.降低阳极区液面上方的气压
(4)食盐水中的I-若进入电解槽,可被电解产生的Cl2氧化为ICl,并进一步转化为IO 。IO
。IO 可继续被氧化为高碘酸根(IO
可继续被氧化为高碘酸根(IO ),与Na+结合生成溶解度较小的NaIO4沉积于阳离子交换膜上,影响膜的寿命。
),与Na+结合生成溶解度较小的NaIO4沉积于阳离子交换膜上,影响膜的寿命。
①ICl为有毒的黑色晶体,可用氢氧化钠溶液吸收,请写出相应的离子反应方程式:________ 。
②请写出NaIO3被 Cl2氧化为NaIO4的化学反应方程式为____________ 。
(5)研究表明食盐水中I-含量≤0.2 mg•L-1时对离子交换膜影响可忽略。现将1m3含I-浓度为1.47 mg•L-1 的食盐水进行处理,为达到使用标准,理论上至少 需要0.05 mol•L-1 NaClO溶液_________ L。(已知NaClO的反应产物为NaCl,溶液体积变化忽略不计)

(1)粗盐提纯后还含有Ca2+、Mg2+及SO
 等杂质离子,电解之前需要精制食盐水。除去粗盐中杂质离子的试剂的加入顺序是
等杂质离子,电解之前需要精制食盐水。除去粗盐中杂质离子的试剂的加入顺序是a.NaOH b. BaCl2 c.Na2 CO3
(2)电解饱和食盐水的化学方程式为
 ):c(CO
):c(CO )=2∶1,则此时溶液中的c(H+)=
)=2∶1,则此时溶液中的c(H+)=(3)电解结束后,能够脱去阳极液中游离氯的试剂或方法是
a.Na2SO3 b.NaNO3 c.热空气吹出 d.降低阳极区液面上方的气压
(4)食盐水中的I-若进入电解槽,可被电解产生的Cl2氧化为ICl,并进一步转化为IO
 。IO
。IO 可继续被氧化为高碘酸根(IO
可继续被氧化为高碘酸根(IO ),与Na+结合生成溶解度较小的NaIO4沉积于阳离子交换膜上,影响膜的寿命。
),与Na+结合生成溶解度较小的NaIO4沉积于阳离子交换膜上,影响膜的寿命。①ICl为有毒的黑色晶体,可用氢氧化钠溶液吸收,请写出相应的离子反应方程式:
②请写出NaIO3被 Cl2氧化为NaIO4的化学反应方程式为
(5)研究表明食盐水中I-含量≤0.2 mg•L-1时对离子交换膜影响可忽略。现将1m3含I-浓度为1.47 mg•L-1 的食盐水进行处理,为达到使用标准,理论上
您最近一年使用:0次
2020-12-28更新
|
106次组卷
|
2卷引用:河南省漯河市2021届高三上学期期末考试化学试题
7 . 海水是巨大的资源宝库,从海水中提取食盐和溴的过程如图:

(1)为除去粗盐中的杂质( 、
、 、
、 ),加入的试剂顺序正确的是
),加入的试剂顺序正确的是______ (填序号)。
A.NaOH溶液→ 溶液→
溶液→ 溶液→过滤后加盐酸
溶液→过滤后加盐酸
B. 溶液→NaOH溶液→
溶液→NaOH溶液→ 溶液→过滤后加盐酸
溶液→过滤后加盐酸
C.NaOH溶液→ 溶液→
溶液→ 溶液→过滤后加盐酸
溶液→过滤后加盐酸
D. 溶液→NaOH溶液→
溶液→NaOH溶液→ 溶液→过滤后加盐酸
溶液→过滤后加盐酸
(2)制备钠单质的方法之一是电解熔融NaCl,写出电解的化学方程式:_________ 。
(3)某化学兴趣小组的同学为了了解从工业溴中提纯溴的方法,查阅了有关资料; 的沸点为59℃,微溶于水,有毒性和强腐蚀性。他们参观生产过程后,设计了如图实验装置:
的沸点为59℃,微溶于水,有毒性和强腐蚀性。他们参观生产过程后,设计了如图实验装置:
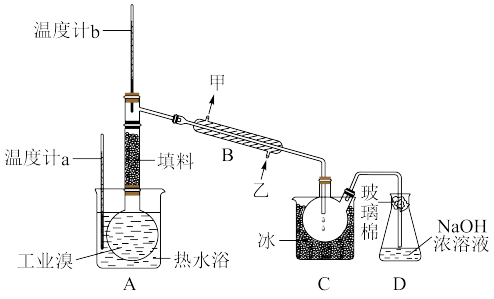
①图中仪器B的名称是_______ ,冷却水的出口为________ (填“甲”或“乙”)。
②C中液体的颜色为________ 。
③D装置的作用是_________ 。
(4)已知某溶液中 、
、 、
、 的物质的量之比为2:3:4,现欲使溶液中的
的物质的量之比为2:3:4,现欲使溶液中的 、
、 、
、 的物质的量之比变成4:3:2,那么需要通入
的物质的量之比变成4:3:2,那么需要通入 的物质的量是原溶液中
的物质的量是原溶液中 的物质的量的
的物质的量的______ (填序号)。
A. B.
B. C.
C. D.
D.

(1)为除去粗盐中的杂质(
 、
、 、
、 ),加入的试剂顺序正确的是
),加入的试剂顺序正确的是A.NaOH溶液→
 溶液→
溶液→ 溶液→过滤后加盐酸
溶液→过滤后加盐酸B.
 溶液→NaOH溶液→
溶液→NaOH溶液→ 溶液→过滤后加盐酸
溶液→过滤后加盐酸C.NaOH溶液→
 溶液→
溶液→ 溶液→过滤后加盐酸
溶液→过滤后加盐酸D.
 溶液→NaOH溶液→
溶液→NaOH溶液→ 溶液→过滤后加盐酸
溶液→过滤后加盐酸(2)制备钠单质的方法之一是电解熔融NaCl,写出电解的化学方程式:
(3)某化学兴趣小组的同学为了了解从工业溴中提纯溴的方法,查阅了有关资料;
 的沸点为59℃,微溶于水,有毒性和强腐蚀性。他们参观生产过程后,设计了如图实验装置:
的沸点为59℃,微溶于水,有毒性和强腐蚀性。他们参观生产过程后,设计了如图实验装置:
①图中仪器B的名称是
②C中液体的颜色为
③D装置的作用是
(4)已知某溶液中
 、
、 、
、 的物质的量之比为2:3:4,现欲使溶液中的
的物质的量之比为2:3:4,现欲使溶液中的 、
、 、
、 的物质的量之比变成4:3:2,那么需要通入
的物质的量之比变成4:3:2,那么需要通入 的物质的量是原溶液中
的物质的量是原溶液中 的物质的量的
的物质的量的A.
 B.
B. C.
C. D.
D.
您最近一年使用:0次
2020-09-25更新
|
462次组卷
|
2卷引用:河南省豫西名校2020-2021学年高一下期第二次联考化学试题
解题方法
8 . 为了除掉粗盐中的Ca2+、Mg2+、SO 以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(所加的试剂BaCl2、Na2CO3、NaOH均稍过量):
以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(所加的试剂BaCl2、Na2CO3、NaOH均稍过量):
称取粗盐





 精盐。
精盐。
(1)实验中,在溶解、过滤、蒸发三个步骤的操作中都要用到玻璃棒,分别说明这三种情况下使用玻璃棒的作用,溶解时________ ;过滤时_______ ;蒸发时________ 。
(2)②③④步操作中所加入的试剂各是什么?_______________ 。
(3)判断BaCl2已过量的方法是_____________________ 。
 以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(所加的试剂BaCl2、Na2CO3、NaOH均稍过量):
以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(所加的试剂BaCl2、Na2CO3、NaOH均稍过量):称取粗盐






 精盐。
精盐。(1)实验中,在溶解、过滤、蒸发三个步骤的操作中都要用到玻璃棒,分别说明这三种情况下使用玻璃棒的作用,溶解时
(2)②③④步操作中所加入的试剂各是什么?
(3)判断BaCl2已过量的方法是
您最近一年使用:0次
解题方法
9 . 海水是宝贵的资源宝库,目前氯碱工业、海水提镁、海水提溴为人类提供了大量工业原料。下图是海水综合利用的部分流程图,据图回答问题:
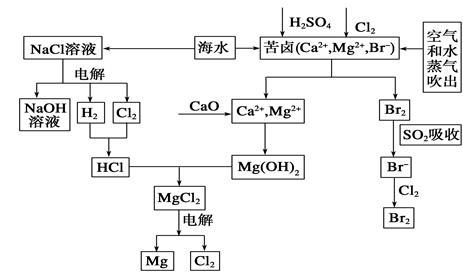
(1)由海水晒制的粗盐中含有Ca2+、Mg2+、SO42-等离子,为除去这些离子,所加试剂及其先后顺序为(写化学式)_________________________ 。
(2)①目前较先进的电解制碱法是离子交换膜电解法,即用阳离子交换膜把电解槽隔成阴极室和阳极室,其作用是____________________ ,电解饱和食盐水的化学反应方程式为___________________ 。
②制取MgCl2的过程中涉及反应:MgCl2·6H2O MgCl2+6H2O,该反应要在HCl气氛中进行,原因是
MgCl2+6H2O,该反应要在HCl气氛中进行,原因是__________ 。
(3)苦卤中通入Cl2已经置换出Br2,为什么吹出后用SO2吸收转化为Br-再用Cl2置换______________ ,由此判断Cl2、Br2、SO2的氧化性由强到弱的顺序为________ 。
(4)也有工艺是在吹出Br2后用碳酸钠溶液吸收,形成溴化钠和溴酸钠,同时有CO2放出。该反应的离子方程式是_________________ ;最后再用H2SO4处理得到Br2,该反应的离子方程式是__________________ 。

(1)由海水晒制的粗盐中含有Ca2+、Mg2+、SO42-等离子,为除去这些离子,所加试剂及其先后顺序为(写化学式)
(2)①目前较先进的电解制碱法是离子交换膜电解法,即用阳离子交换膜把电解槽隔成阴极室和阳极室,其作用是
②制取MgCl2的过程中涉及反应:MgCl2·6H2O
 MgCl2+6H2O,该反应要在HCl气氛中进行,原因是
MgCl2+6H2O,该反应要在HCl气氛中进行,原因是(3)苦卤中通入Cl2已经置换出Br2,为什么吹出后用SO2吸收转化为Br-再用Cl2置换
(4)也有工艺是在吹出Br2后用碳酸钠溶液吸收,形成溴化钠和溴酸钠,同时有CO2放出。该反应的离子方程式是
您最近一年使用:0次



