解题方法
1 . 水荒目前已成为世界性的问题,是制约社会进步和经济发展的瓶颈。海水淡化是获得淡水的重要途径,下列不属于海水淡化方法的是
| A.过滤法 | B.电渗析法 | C.离子交换法 | D.蒸馏法 |
您最近一年使用:0次
名校
解题方法
2 . 为了除去粗盐中的CaCl2、MgCl2、Na2SO4及泥沙,可将粗盐溶于水,通过如下几个实验步骤,可制得纯净的食盐水:①加入稍过量的Na2CO3溶液;②加入稍过量的NaOH溶液;③加入稍过量的BaCl2溶液;④滴入稀盐酸至无气泡产生;⑤过滤,不正确的操作顺序是
| A.③②①⑤④ | B.②①③⑤④ | C.③①②⑤④ | D.②③①⑤④ |
您最近一年使用:0次
2021-05-01更新
|
341次组卷
|
24卷引用:【全国百强校】辽宁省师范大学附属中学2018-2019学年高一上学期期中考试化学试题
【全国百强校】辽宁省师范大学附属中学2018-2019学年高一上学期期中考试化学试题安徽省亳州市2016-2017学年高一上学期期中考试化学试题湖北省宜昌市葛洲坝中学2017-2018学年高一9月月考化学试题山西省运城中学、芮城中学2017-2018学年高一上学期期中联考化学试题【全国百强校】甘肃省静宁县第一中学2018-2019学年高一上学期期中考试化学试题【全国百强校】安徽省合肥市第一六八中学2018-2019学年高一上学期一月调研性检测化学试题山西运城河东学校2018-2019学年高一第一学期9月月考化学试题江苏省沭阳县修远中学2019-2020学年高一上学期10月月考化学试题陕西省咸阳市武功县普集高级中学2019-2020学年高一上学期第一次月考化学试题湖北省黄冈市麻城实验高中2019-2020学年高一10月月考试化学试题新疆石河子第二中学2019-2020学年高一上学期第一次阶段考试化学试题江苏省扬州市邗江中学2019-2020学年高一上学期期中考试化学试题江苏省苏北县2019-2020学年高一上学期学情调研化学试题山东省德州市夏津县双语中学2019-2020学年高一12月月考化学试题(已下线)【南昌新东方】2019 进贤一中 高一上第一次月考四川省广安代市中学2020-2021学年高一上学期第一次月考化学试题湖北省利川市第五中学2019年-2020学年高一上学期期中考试化学试题河北省石家庄外国语学校2018-2019学年高一上学期期末化学试题江西省赣州市信丰中学2020-2021学年高一上学期第一次月考化学(A卷) 试题(已下线)专题11 自然资源的开发利用【专项训练】-2020-2021学年高一化学下学期期末专项复习(人教版2019必修第二册)宁夏海原第一中学2021-2022学年高一上学期第一次月考化学试题四川省江油中学2021-2022学年高一上学期10月月考化学试题宁夏银川唐徕回民中学2021-2022学年高一上学期期末考试化学试题江苏省徐州市2022-2023学年高一上学期阶段测试(一)化学试题
名校
解题方法
3 . 海洋中有丰富的食品、矿业、能源、药物和水产资源,下图为海水利用的部分过程。有关说法错误的是
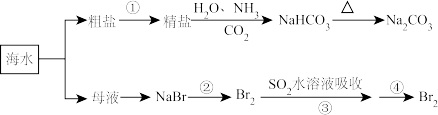

| A.制取NaHCO3的反应是利用其溶解度较小 |
| B.侯氏制碱过程中应先通NH3再通CO2 |
| C.在第②③④步骤中,溴元素均被氧化 |
| D.③④的目的是进行溴的富集 |
您最近一年使用:0次
2021-01-19更新
|
503次组卷
|
13卷引用:辽宁省实验中学2021届高三上学期第一次阶段测试化学试题
辽宁省实验中学2021届高三上学期第一次阶段测试化学试题黑龙江省哈尔滨师范大学附属中学2020届高三上学期期中考试化学试题黑龙江省顶级名校2020届高三上学期期中考试化学试题黑龙江省安达市第七中学2020届高三上学期第二次模拟考试化学试题河北省承德第一中学2020届高三上学期第三次月考化学试题江西名师联盟2020届高三第一次模拟测试化学试题河南省焦作市博爱英才学校2021届高三开学考试化学试题(已下线)【南昌新东方】7. 2020 高三 南昌八中 期中 左佳鑫上海市黄浦区2021届高三一模化学试题(已下线)热点5 常见元素及其化合物的性质与相互转化-2021年高考化学专练【热点·重点·难点】(新高考)福建省莆田锦江中学2020-2021学年高一上学期期末考试化学试题(已下线)考向06 钠及其重要化合物-备战2022年高考化学一轮复习考点微专题湖南省衡阳市衡阳县第一中学2022届高三下学期第二次模考试化学试题
名校
4 . 我国有丰富的海水资源,开发和利用海水资源是当前科学研究的一项重要任务,如图是海水综合利用的一个方面。
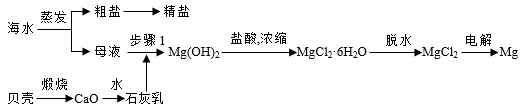
(1)步骤1中分离操作的名称是___________ ,发生反应的化学方程式是:___________
(2)粗盐中含Ca2+、Mg2+、SO 等杂质,需要提纯后才能综合利用。粗盐提纯的步骤有:①加入过量的Na2CO3溶液;②加入过量的BaCl2溶液;③加入过量的NaOH溶液;④调节溶液的pH等于7;⑤溶解;⑥过滤;⑦蒸发。正确的操作顺序是
等杂质,需要提纯后才能综合利用。粗盐提纯的步骤有:①加入过量的Na2CO3溶液;②加入过量的BaCl2溶液;③加入过量的NaOH溶液;④调节溶液的pH等于7;⑤溶解;⑥过滤;⑦蒸发。正确的操作顺序是___________ (填写序号字母)。
a.⑥⑤②③①⑥④⑦ b.⑤①②③⑥④⑦
c.⑤②①③④⑥⑦ d.⑤③②①⑥④⑦
(3)操作步骤④调节溶液pH时,应加入___________ ,写出一个有关的化学方程式是___________ 。
(4)操作⑤溶解;⑥过滤;⑦蒸发都用到一种玻璃仪器是___________ ,简述以上⑥过滤操作中如何洗涤沉淀。___________

(1)步骤1中分离操作的名称是
(2)粗盐中含Ca2+、Mg2+、SO
 等杂质,需要提纯后才能综合利用。粗盐提纯的步骤有:①加入过量的Na2CO3溶液;②加入过量的BaCl2溶液;③加入过量的NaOH溶液;④调节溶液的pH等于7;⑤溶解;⑥过滤;⑦蒸发。正确的操作顺序是
等杂质,需要提纯后才能综合利用。粗盐提纯的步骤有:①加入过量的Na2CO3溶液;②加入过量的BaCl2溶液;③加入过量的NaOH溶液;④调节溶液的pH等于7;⑤溶解;⑥过滤;⑦蒸发。正确的操作顺序是a.⑥⑤②③①⑥④⑦ b.⑤①②③⑥④⑦
c.⑤②①③④⑥⑦ d.⑤③②①⑥④⑦
(3)操作步骤④调节溶液pH时,应加入
(4)操作⑤溶解;⑥过滤;⑦蒸发都用到一种玻璃仪器是
您最近一年使用:0次
2020-12-22更新
|
485次组卷
|
4卷引用:福建师范大学第二附属中学2019-2020学年高一上学期期中考试化学试题
福建师范大学第二附属中学2019-2020学年高一上学期期中考试化学试题辽宁省渤海大学附属高级中学2021-2022学年高一下学期第二次阶段性考试化学试题(已下线)专题13 化学实验基础-备战2021届高考化学二轮复习题型专练湖北省潜江市园林高级中学2021-2022学年高一下学期五月月考化学试题
名校
解题方法
5 . 辛勤劳动才能创造美好生活。如图所示劳动场景中,不涉及氧化还原反应的是( )
| A | B | C | D |
|
|
|
|
| 海水晒盐 | 冶炼钢铁 | 古法酿酒 | 用过氧乙酸消毒 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2020-09-29更新
|
188次组卷
|
4卷引用:辽宁省大连市普兰店区第三十八中学2020-2021学年高二上学期开学考试化学试题
6 . 海洋中有丰富的资源,如图为海水资源利用的部分过程。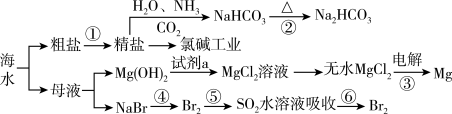
下列有关说法正确的是

下列有关说法正确的是
| A.用加热的方法可以除去Na2CO3中混有的杂质NaHCO3 |
| B.第②~⑥步均发生了氧化还原反应 |
| C.在第④⑤⑥步中溴元素均被氧化 |
| D.工业上通过电解饱和MgCl2溶液制取金属镁 |
您最近一年使用:0次
2020-09-03更新
|
120次组卷
|
2卷引用:广西壮族自治区河池市2019-2020学年高一下学期期末教学质量检测化学试题
解题方法
7 . 积极主动学习化学知识,培养提高学科核心素养,发挥化学学科的重要作用,科学、安全、有效和合理地开发自然资源和使用各种化学品,实现人类可持续发展。以“陆、海、空”即物质的固、液、气三种状态为线索,理解和记忆一些常识性化学知识是有效的学习方式之一。
(1)工业上所说的“三废”是指________ 。
(2)石油经常压蒸馏和减压蒸馏可得到________ 、________ 、________ 三种状态的产品。
(3)正常雨水的pH约为5.6,是因为空气中含有________ 气体的缘故;海水中的镁元素处于________ (填“游离态”或“化合态”)从海水中提取氯化镁的反应________ (填“是”或“不是”)氧化还原反应;无论海水资源还是陆上矿物资源,工业上冶炼镁、钾和钠的常用方法是________ 。
(4)以乙烯制环氧乙烷,有两种方法(环氧乙烷沸点10.4℃,与水任意比互溶)
方法一:总反应为CH2=CH2+Cl2+Ca(OH)2→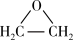 +CaCl2+H2O
+CaCl2+H2O
方法二:2CH2=CH2+O2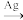 2
2 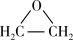
相对方法一,方法二通常条件反应混合物状态单一,产物易液化分离,除此之外的突出优点是:________ 。
(1)工业上所说的“三废”是指
(2)石油经常压蒸馏和减压蒸馏可得到
(3)正常雨水的pH约为5.6,是因为空气中含有
(4)以乙烯制环氧乙烷,有两种方法(环氧乙烷沸点10.4℃,与水任意比互溶)
方法一:总反应为CH2=CH2+Cl2+Ca(OH)2→
 +CaCl2+H2O
+CaCl2+H2O方法二:2CH2=CH2+O2
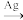 2
2 
相对方法一,方法二通常条件反应混合物状态单一,产物易液化分离,除此之外的突出优点是:
您最近一年使用:0次
解题方法
8 . 利用海水可以提取溴和镁,提取过程如图。
I
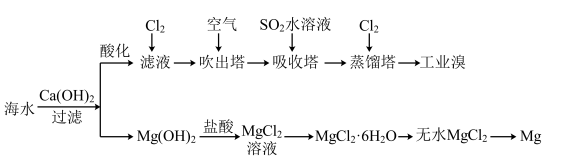
(1)提取溴的过程中,经过两次Br-→Br2转化的目的是______ ,吸收塔中发生反应的离子方程式是__________ 。
(2)从MgCl2溶液中得到MgCl2·6H2O晶体的主要操作是____ 、浓缩、冷却、______ 、过滤、洗涤、干燥。
II以食盐为原料进行生产并综合利用的某些过程如图所示。

(1)除去粗盐中的Ca2+、Mg2+和SO 离子,加入下列沉淀剂的顺序是(填序号)
离子,加入下列沉淀剂的顺序是(填序号)____ 。
a.BaCl2 b.Na2CO3
(2)NaHCO3制取Na2CO3化学方程式是_____ 。
(3)将滤液的pH调至酸性除去的离子是______ 。
(4)若向分离出NaHCO3晶体后的母液中加入过量生石灰,则可获得一种可以循环使用的物质,其化学式是_____ 。
(5)工业上,可以用纯碱代替烧碱生产某些化工产品。如用饱和纯碱溶液与Cl2反应制取有效成分为NaClO的消毒液,其反应的离子方程式是_______ 。(已知碳酸的酸性强于次氯酸)。
I

(1)提取溴的过程中,经过两次Br-→Br2转化的目的是
(2)从MgCl2溶液中得到MgCl2·6H2O晶体的主要操作是
II以食盐为原料进行生产并综合利用的某些过程如图所示。

(1)除去粗盐中的Ca2+、Mg2+和SO
 离子,加入下列沉淀剂的顺序是(填序号)
离子,加入下列沉淀剂的顺序是(填序号)a.BaCl2 b.Na2CO3
(2)NaHCO3制取Na2CO3化学方程式是
(3)将滤液的pH调至酸性除去的离子是
(4)若向分离出NaHCO3晶体后的母液中加入过量生石灰,则可获得一种可以循环使用的物质,其化学式是
(5)工业上,可以用纯碱代替烧碱生产某些化工产品。如用饱和纯碱溶液与Cl2反应制取有效成分为NaClO的消毒液,其反应的离子方程式是
您最近一年使用:0次
9 . 通过海水晾晒可得粗盐,粗盐除NaCl外,还含有MgCl2、CaCl2、Na2SO4以及泥沙等杂质,粗盐精制的实验流程如下。下列说法不正确 的是( )


| A.在第①步中使用玻璃棒搅拌可加速粗盐溶解 |
| B.第⑤步操作是过滤 |
| C.在第②③④⑥步通过加入化学试剂除杂,加入试剂顺序为:NaOH溶液→Na2CO3溶液→BaCl2溶液→稀盐酸 |
| D.除去MgCl2的化学方程式为:MgCl2 + 2NaOH =Mg(OH)2↓+ 2NaCl |
您最近一年使用:0次
2020-06-18更新
|
474次组卷
|
10卷引用:辽宁省大连市大连海湾高级中学2019-2020学年高一下学期第一次质量检测化学试题
辽宁省大连市大连海湾高级中学2019-2020学年高一下学期第一次质量检测化学试题宁夏贺兰县景博中学2019-2020学年高一上学期第一次月考化学试题辽宁省六校2020-2021学年高一下学期期中联考化学试题辽宁省朝阳市凌源市2021-2022学年高一下学期第二次联考化学试题吉林省长白实验中学2020-2021学年高一下学期第一次月考化学试题内蒙古包头市一机一中2021-2022学年高一上学期10月月考化学试题四川省广安市邻水实验学校2021-2022学年高一上学期第一次月考化学试题广东省惠州市博罗县2021-2022学年高一下学期期中考试化学试题广东省惠州市博罗县2021-2022学年高一下学期期中考试化学试题黑龙江省大庆市东风中学2021-2022学年高二下学期第一次月考化学试题
名校
解题方法
10 . 海水化学资源开发利用的部分过程如图所示,下列说法正确的是
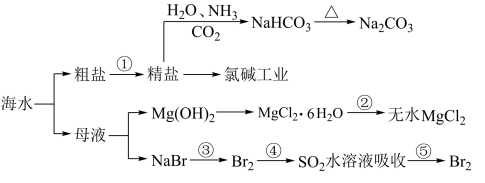

| A.用澄清的石灰水可鉴别NaHCO3和Na2CO3 |
| B.从海水中得到粗盐主要是通过蒸发操作实现的 |
| C.在步骤③,中可通入Cl2使溴离子被还原为Br2 |
| D.在步骤④中,SO2水溶液吸收Br2后,溶液的pH增大 |
您最近一年使用:0次
2020-06-15更新
|
425次组卷
|
8卷引用:辽宁省海城市南台高级中学2019-2020学年高一下学期期末考试化学试题







