名校
解题方法
1 . 海洋资源的利用具有广阔前景。
(1)无需经过化学变化就能从海水中获得的物质是___________ (填序号)。
A.食盐 B.淡水 C.烧碱 D.纯碱 E.溴
(2)大量的镁从海水中提取,一种工业制备无水氯化镁的工艺流程如下:
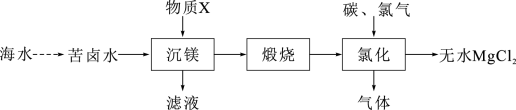
工业上常用“沉镁”物质X的是___________ ,“氯化”过程中的气态副产物常用作还原剂,“氯化”发生的化学方程式是___________ 。
(3)海带中含有碘元素。实验室提取碘的步骤如下所示:

①灼烧海带至灰烬时所用的主要仪器名称是_______ 。海带灰中含有硫酸镁、碳酸钠等,在实验步骤___________ (填序号)中实现与碘分离。
②写出步骤④反应的离子方程式_______ 。反应结束后,再加入CCl4作萃取剂,振荡、静置,可以观察到CCl4层呈___________ 色。
③请设计实验检验用CCl4提取碘后的水溶液中是否还含有碘单质___________ (包括实验步骤、现象及结论)。
(1)无需经过化学变化就能从海水中获得的物质是
A.食盐 B.淡水 C.烧碱 D.纯碱 E.溴
(2)大量的镁从海水中提取,一种工业制备无水氯化镁的工艺流程如下:

工业上常用“沉镁”物质X的是
(3)海带中含有碘元素。实验室提取碘的步骤如下所示:

①灼烧海带至灰烬时所用的主要仪器名称是
②写出步骤④反应的离子方程式
③请设计实验检验用CCl4提取碘后的水溶液中是否还含有碘单质
您最近一年使用:0次
2022-09-21更新
|
346次组卷
|
3卷引用:内蒙古通辽市开鲁县第一中学2022-2023学年高二上学期期末考试化学试题
2 . 碘(紫黑色固体,微溶于水)及其化合物广泛用于医药、染料等方面。工业上从含碘海水中制备 的一种方法如图所示。已知氧化性
的一种方法如图所示。已知氧化性 ,还原性
,还原性 。回答下列问题:
。回答下列问题:
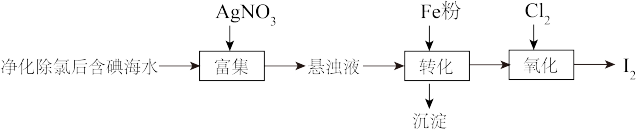
(1)海带中含有丰富的碘元素,处理时应将海带放入_______ (填仪器名称)中进行灼烧得含 的灰烬。
的灰烬。
(2)转化过程加入的Fe粉是过量的,发生的反应为: 。若往转化所得的沉淀中加入稀硫酸,反应的离子方程式为
。若往转化所得的沉淀中加入稀硫酸,反应的离子方程式为_______ ;若要检验转化过程所加Fe粉是否过量,可取适量转化所得的溶液于试管中,加入_______ 溶液,观察现象。
(3)氧化过程可以用适量的酸化的 代替
代替 ,则该反应的离子方程式为
,则该反应的离子方程式为_______ 。用 做氧化剂时也需控制
做氧化剂时也需控制 的用量,若反应物
的用量,若反应物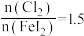 时,氧化产物为
时,氧化产物为 和
和_______ ,当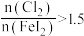 ,
, 会被过量的
会被过量的 进一步氧化从而导致单质碘的收率会降低。
进一步氧化从而导致单质碘的收率会降低。
(4)实验室从含碘废液(除 外,还含有
外,还含有 、
、 、
、 等)中回收碘,其实验过程如图所示:
等)中回收碘,其实验过程如图所示:
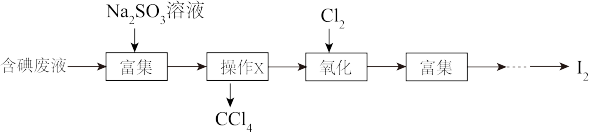
①操作X的名称为_______ 。
②向含碘废液中加入稍过量的 溶液,将废液中的
溶液,将废液中的 还原为
还原为 ,该操作的目的是
,该操作的目的是_______ 。
③氧化时,在三颈烧瓶中将含 的水溶液用盐酸调至pH约为2,缓慢通入
的水溶液用盐酸调至pH约为2,缓慢通入 ,在40℃左右反应(实验装置如图所示)。实验控制在较低温度下进行的原因可能是
,在40℃左右反应(实验装置如图所示)。实验控制在较低温度下进行的原因可能是_______ 。(选填字母编号)
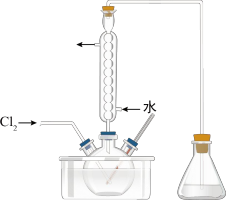
A.增大 的溶解度 B.防止
的溶解度 B.防止 的升华 C.防止水发生分解
的升华 C.防止水发生分解
 的一种方法如图所示。已知氧化性
的一种方法如图所示。已知氧化性 ,还原性
,还原性 。回答下列问题:
。回答下列问题:
(1)海带中含有丰富的碘元素,处理时应将海带放入
 的灰烬。
的灰烬。(2)转化过程加入的Fe粉是过量的,发生的反应为:
 。若往转化所得的沉淀中加入稀硫酸,反应的离子方程式为
。若往转化所得的沉淀中加入稀硫酸,反应的离子方程式为(3)氧化过程可以用适量的酸化的
 代替
代替 ,则该反应的离子方程式为
,则该反应的离子方程式为 做氧化剂时也需控制
做氧化剂时也需控制 的用量,若反应物
的用量,若反应物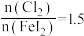 时,氧化产物为
时,氧化产物为 和
和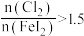 ,
, 会被过量的
会被过量的 进一步氧化从而导致单质碘的收率会降低。
进一步氧化从而导致单质碘的收率会降低。(4)实验室从含碘废液(除
 外,还含有
外,还含有 、
、 、
、 等)中回收碘,其实验过程如图所示:
等)中回收碘,其实验过程如图所示:
①操作X的名称为
②向含碘废液中加入稍过量的
 溶液,将废液中的
溶液,将废液中的 还原为
还原为 ,该操作的目的是
,该操作的目的是③氧化时,在三颈烧瓶中将含
 的水溶液用盐酸调至pH约为2,缓慢通入
的水溶液用盐酸调至pH约为2,缓慢通入 ,在40℃左右反应(实验装置如图所示)。实验控制在较低温度下进行的原因可能是
,在40℃左右反应(实验装置如图所示)。实验控制在较低温度下进行的原因可能是
A.增大
 的溶解度 B.防止
的溶解度 B.防止 的升华 C.防止水发生分解
的升华 C.防止水发生分解
您最近一年使用:0次
名校
解题方法
3 . 海洋是一座巨大的化学资源宝库,从海水中或海产品中提取多种化学物质。
I.试剂级 可用海盐(含泥沙、海藻、
可用海盐(含泥沙、海藻、 等杂质)为原料制备。制备流程如下:
等杂质)为原料制备。制备流程如下:
(1)
焙炒海盐的目的是___________ 。
(2)根据除杂原理、预期沉淀的离子,填写合适的试剂。
其中步骤2和步骤3是否可以颠倒,请给出解释:___________ 。
(3)以氯化钠为原料设计了“黑笔写红字”的趣味实验。滤纸先用氯化钠、无色酚酞的混合液浸湿,然后平铺在一块铂片上,接通电源后,用铅笔在滤纸上写字,会出现红色字迹。下列叙述正确的是___________。

Ⅱ.实验室模拟工业从海藻中提碘的流程如图:
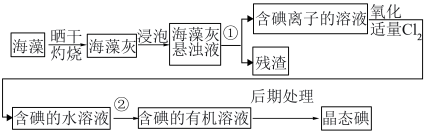
(4)选择合适实验操作名称填入流程图中:①___________ ,②___________ 。(可多选)
A.溶解 B.过滤 C.萃取 D.分液
(5)从“含碘的有机溶液”中回收溶剂,并得到碘单质,可选用如下图装置完成。装置中间部分是“冷凝管”,请描述该装置中有明显的错误,请写出任一种错误___________ 。
(6)
装置 中,温度计所处的正确位置是
中,温度计所处的正确位置是___________ 。(选填编号)

Ⅲ.某化学研究性学习小组模拟工业上从浓缩的海水(海水中富含 )中提取液溴的过程,设计了如下实验装置(夹持装置略去)和操作流程。已知:
)中提取液溴的过程,设计了如下实验装置(夹持装置略去)和操作流程。已知: 的沸点为
的沸点为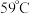 ,微溶于水,有毒。
,微溶于水,有毒。
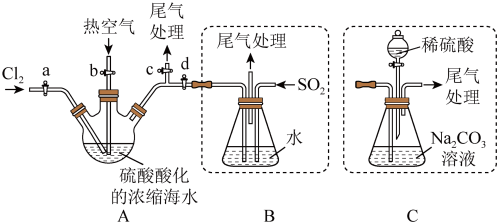
①连接 与B,关闭活塞b、d,,打开活塞a、c,向A中缓慢通入
与B,关闭活塞b、d,,打开活塞a、c,向A中缓慢通入 至反应完全:
至反应完全:
②关闭活塞a、c,打开活塞b、d,向A中鼓入足量热空气:
③进行步骤②的同时,向B中通入足量 ;
;
④关闭活塞b,打开活塞a,再通过A向B中缓慢通入足量 ;
;
⑤将B中所得液体进行萃取分液,蒸馏并收集液溴
请回答下列问题:
(7)步骤②中鼓入热空气的作用为___________ 。
(8)进行步骤③时,B中尾气可用___________吸收处理。
(9)若直接连接A与C,进行步骤①和②,充分反应后,向锥形瓶中流加稀硫酸,再经步骤⑤,也能制得液溴。滴加稀硫酸之前,c中反应生成了NaBrO3、 、
、 ,则该反应的化学方程式为
,则该反应的化学方程式为___________ 。
(10)与B装置相比,采用C装置的优点为___________ 。
I.试剂级
 可用海盐(含泥沙、海藻、
可用海盐(含泥沙、海藻、 等杂质)为原料制备。制备流程如下:
等杂质)为原料制备。制备流程如下:(1)

焙炒海盐的目的是
(2)根据除杂原理、预期沉淀的离子,填写合适的试剂。
| 实验步骤 | 试剂 | 预期沉淀的离子 |
| 步骤1 | 略过量 |  、 、 |
| 步骤2 | 略过量 |  |
| 步骤3 | 略过量 |  |
(3)以氯化钠为原料设计了“黑笔写红字”的趣味实验。滤纸先用氯化钠、无色酚酞的混合液浸湿,然后平铺在一块铂片上,接通电源后,用铅笔在滤纸上写字,会出现红色字迹。下列叙述正确的是___________。

| A.铂片上发生还原反应 |
| B.铂片端作阴极 |
| C.铅笔端有少量的氯气产生 |
| D.a连接的是电源负极 |
Ⅱ.实验室模拟工业从海藻中提碘的流程如图:

(4)选择合适实验操作名称填入流程图中:①
A.溶解 B.过滤 C.萃取 D.分液
(5)从“含碘的有机溶液”中回收溶剂,并得到碘单质,可选用如下图装置完成。装置中间部分是“冷凝管”,请描述该装置中有明显的错误,请写出任一种错误
(6)

装置
 中,温度计所处的正确位置是
中,温度计所处的正确位置是
Ⅲ.某化学研究性学习小组模拟工业上从浓缩的海水(海水中富含
 )中提取液溴的过程,设计了如下实验装置(夹持装置略去)和操作流程。已知:
)中提取液溴的过程,设计了如下实验装置(夹持装置略去)和操作流程。已知: 的沸点为
的沸点为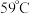 ,微溶于水,有毒。
,微溶于水,有毒。
①连接
 与B,关闭活塞b、d,,打开活塞a、c,向A中缓慢通入
与B,关闭活塞b、d,,打开活塞a、c,向A中缓慢通入 至反应完全:
至反应完全:②关闭活塞a、c,打开活塞b、d,向A中鼓入足量热空气:
③进行步骤②的同时,向B中通入足量
 ;
;④关闭活塞b,打开活塞a,再通过A向B中缓慢通入足量
 ;
;⑤将B中所得液体进行萃取分液,蒸馏并收集液溴
请回答下列问题:
(7)步骤②中鼓入热空气的作用为
(8)进行步骤③时,B中尾气可用___________吸收处理。
| A.水 | B.浓硫酸 | C. 溶液 溶液 | D.饱和 溶液 溶液 |
(9)若直接连接A与C,进行步骤①和②,充分反应后,向锥形瓶中流加稀硫酸,再经步骤⑤,也能制得液溴。滴加稀硫酸之前,c中反应生成了NaBrO3、
 、
、 ,则该反应的化学方程式为
,则该反应的化学方程式为(10)与B装置相比,采用C装置的优点为
您最近一年使用:0次
解题方法
4 .  常用于制药和食品添加剂。以海带为原料提取高纯度碘单质并制备
常用于制药和食品添加剂。以海带为原料提取高纯度碘单质并制备 的一种流程如下:
的一种流程如下:
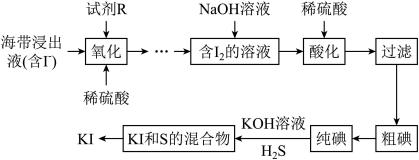
回答下列问题:
(1)“酸化”时稀硫酸的作用是___________ 。
(2)分离 和S的混合物得到
和S的混合物得到 溶液的试剂和方法如下,正确的是
溶液的试剂和方法如下,正确的是___________ (填标号)。
(3)利用下图装置完成 与
与 反应制备
反应制备 。
。

① 溶液的作用是
溶液的作用是___________ (用离子方程式表示)。
②三颈烧瓶中产生 的正确操作顺序为
的正确操作顺序为___________ (填标号)。
a.旋开活塞K,通入 b.加入稀硫酸 c.加入
b.加入稀硫酸 c.加入 溶液
溶液
(4)产品纯度测定。
准确称取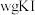 样品溶于水配成
样品溶于水配成 溶液,量取
溶液,量取 溶液于锥形瓶中,加入足量用稀硫酸酸化的
溶液于锥形瓶中,加入足量用稀硫酸酸化的 溶液,摇匀,置于电热板上加热煮沸(常补加热水以保持溶液体积基本不变)。待紫色碘蒸气消失后,再煮沸5分钟,取下放置几分钟,冷却至室温。加入适量的硫酸和磷酸的混合液,用
溶液,摇匀,置于电热板上加热煮沸(常补加热水以保持溶液体积基本不变)。待紫色碘蒸气消失后,再煮沸5分钟,取下放置几分钟,冷却至室温。加入适量的硫酸和磷酸的混合液,用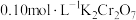 标准溶液反应至完全(还原产物只有
标准溶液反应至完全(还原产物只有 ),消耗标准溶液
),消耗标准溶液 。该
。该 产品的纯度为
产品的纯度为___________ (用含w,V的式子表示)。
 常用于制药和食品添加剂。以海带为原料提取高纯度碘单质并制备
常用于制药和食品添加剂。以海带为原料提取高纯度碘单质并制备 的一种流程如下:
的一种流程如下:
回答下列问题:
(1)“酸化”时稀硫酸的作用是
(2)分离
 和S的混合物得到
和S的混合物得到 溶液的试剂和方法如下,正确的是
溶液的试剂和方法如下,正确的是| 选项 | 试剂 | 方法 |
| a | 二硫化碳 | 分液 |
| b | 酒精 | 分液 |
| c |  溶液 溶液 | 过滤 |
(3)利用下图装置完成
 与
与 反应制备
反应制备 。
。
①
 溶液的作用是
溶液的作用是②三颈烧瓶中产生
 的正确操作顺序为
的正确操作顺序为a.旋开活塞K,通入
 b.加入稀硫酸 c.加入
b.加入稀硫酸 c.加入 溶液
溶液(4)产品纯度测定。
准确称取
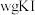 样品溶于水配成
样品溶于水配成 溶液,量取
溶液,量取 溶液于锥形瓶中,加入足量用稀硫酸酸化的
溶液于锥形瓶中,加入足量用稀硫酸酸化的 溶液,摇匀,置于电热板上加热煮沸(常补加热水以保持溶液体积基本不变)。待紫色碘蒸气消失后,再煮沸5分钟,取下放置几分钟,冷却至室温。加入适量的硫酸和磷酸的混合液,用
溶液,摇匀,置于电热板上加热煮沸(常补加热水以保持溶液体积基本不变)。待紫色碘蒸气消失后,再煮沸5分钟,取下放置几分钟,冷却至室温。加入适量的硫酸和磷酸的混合液,用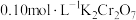 标准溶液反应至完全(还原产物只有
标准溶液反应至完全(还原产物只有 ),消耗标准溶液
),消耗标准溶液 。该
。该 产品的纯度为
产品的纯度为
您最近一年使用:0次
5 . 围绕海水的综合利用,化学课外兴趣小组进行下列实验:
(1)模拟工业制备氯气
装置如图所示,接通电源,当观察到石墨电极与滤纸接触的区域有细小的气泡产生时,停止通电。将pH试纸分别放在a、b处滤纸上,观察颜色变化。
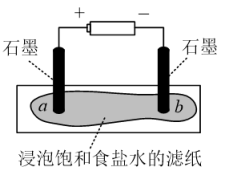
①在上述实验中观察a处pH试纸中心呈白色,边缘有一圈淡淡的红色,b处pH试纸呈___________ 色。
②实验结束后,将滤纸对折,使a、b处充分接触,可将a处残余的Cl2进一步处理。此时发生反应的化学反应方程式是___________ 。
(2)模拟反萃取法提取碘实验流程如下图:
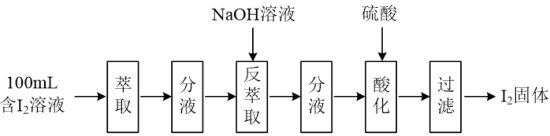
①“萃取”操作时须使用的玻璃仪器有烧杯、玻璃棒和___________ 。
②“反萃取”操作时溶液中有I-、IO 生成。“酸化”步骤发生反应的离子反应方程式为
生成。“酸化”步骤发生反应的离子反应方程式为___________ 。
(3)模拟浓海水提取镁实验流程如下图:
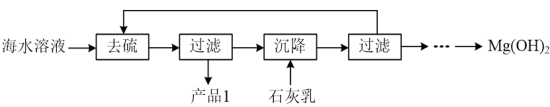
说明:模拟浓海水成分配制的“海水溶液”主要成分如下:
①产品1的化学式为___________ 。
②沉降阶段主要的化学反应方程式为___________ 。
(1)模拟工业制备氯气
装置如图所示,接通电源,当观察到石墨电极与滤纸接触的区域有细小的气泡产生时,停止通电。将pH试纸分别放在a、b处滤纸上,观察颜色变化。

①在上述实验中观察a处pH试纸中心呈白色,边缘有一圈淡淡的红色,b处pH试纸呈
②实验结束后,将滤纸对折,使a、b处充分接触,可将a处残余的Cl2进一步处理。此时发生反应的化学反应方程式是
(2)模拟反萃取法提取碘实验流程如下图:

①“萃取”操作时须使用的玻璃仪器有烧杯、玻璃棒和
②“反萃取”操作时溶液中有I-、IO
 生成。“酸化”步骤发生反应的离子反应方程式为
生成。“酸化”步骤发生反应的离子反应方程式为(3)模拟浓海水提取镁实验流程如下图:

说明:模拟浓海水成分配制的“海水溶液”主要成分如下:
| 离子 | Na+ | Mg2+ | Cl- | SO |
| 浓度/(g·L-1) | 63.7 | 28.8 | 144.6 | 46.4 |
②沉降阶段主要的化学反应方程式为
您最近一年使用:0次
6 . 海带中含有丰富的碘元素(以I-形式存在)。工业中提取碘的流程如图:
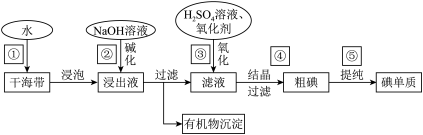
(1)写出步骤③中加硫酸溶液的目的_______ 。
(2)步骤⑤中所涉及的实验操作名称_______ 。
(3)若在实验室中,用分液漏斗、苯(密度比水小,且不溶于水)来提取碘水中的I2,加入少量苯,充分振荡静置后的现象是_______ 。
(4)检验某无色溶液中是否含有I-,所用试剂不合理的是_______ 。
A.淀粉溶液和氯水 B. KBr和稀HCl
C.氯水和四氯化碳 D. KIO3和醋酸
(5)图中有关从海带中提取碘的实验原理和装置能达到实验目的是_____

A.用装置甲灼烧碎海带
B.用装置乙过滤海带灰的浸泡液
C.用装置丙制备用于氧化浸泡液中的氯气
D.用装置丁吸收氧化浸泡液后的尾气

(1)写出步骤③中加硫酸溶液的目的
(2)步骤⑤中所涉及的实验操作名称
(3)若在实验室中,用分液漏斗、苯(密度比水小,且不溶于水)来提取碘水中的I2,加入少量苯,充分振荡静置后的现象是
(4)检验某无色溶液中是否含有I-,所用试剂不合理的是
A.淀粉溶液和氯水 B. KBr和稀HCl
C.氯水和四氯化碳 D. KIO3和醋酸
(5)图中有关从海带中提取碘的实验原理和装置能达到实验目的是

A.用装置甲灼烧碎海带
B.用装置乙过滤海带灰的浸泡液
C.用装置丙制备用于氧化浸泡液中的氯气
D.用装置丁吸收氧化浸泡液后的尾气
您最近一年使用:0次
名校
7 . “海带提碘”中,下列关于装置和操作的说法正确的是
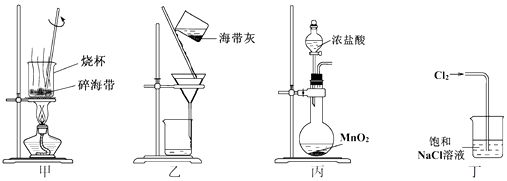

| A.用装置甲灼烧碎海带 |
| B.用装置乙过滤海带灰的浸泡液 |
| C.用装置丙制备Cl2,用于氧化浸泡液中I- |
| D.用装置丁吸收尾气中的Cl2 |
您最近一年使用:0次
2020-12-08更新
|
499次组卷
|
3卷引用:甘肃省岷县第二中学2020-2021学年高一上学期期末考试化学试题



