解题方法
1 .  常用于制药和食品添加剂。以海带为原料提取高纯度碘单质并制备
常用于制药和食品添加剂。以海带为原料提取高纯度碘单质并制备 的一种流程如下:
的一种流程如下:
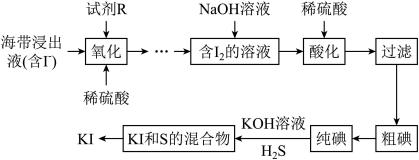
回答下列问题:
(1)“酸化”时稀硫酸的作用是___________ 。
(2)分离 和S的混合物得到
和S的混合物得到 溶液的试剂和方法如下,正确的是
溶液的试剂和方法如下,正确的是___________ (填标号)。
(3)利用下图装置完成 与
与 反应制备
反应制备 。
。

① 溶液的作用是
溶液的作用是___________ (用离子方程式表示)。
②三颈烧瓶中产生 的正确操作顺序为
的正确操作顺序为___________ (填标号)。
a.旋开活塞K,通入 b.加入稀硫酸 c.加入
b.加入稀硫酸 c.加入 溶液
溶液
(4)产品纯度测定。
准确称取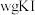 样品溶于水配成
样品溶于水配成 溶液,量取
溶液,量取 溶液于锥形瓶中,加入足量用稀硫酸酸化的
溶液于锥形瓶中,加入足量用稀硫酸酸化的 溶液,摇匀,置于电热板上加热煮沸(常补加热水以保持溶液体积基本不变)。待紫色碘蒸气消失后,再煮沸5分钟,取下放置几分钟,冷却至室温。加入适量的硫酸和磷酸的混合液,用
溶液,摇匀,置于电热板上加热煮沸(常补加热水以保持溶液体积基本不变)。待紫色碘蒸气消失后,再煮沸5分钟,取下放置几分钟,冷却至室温。加入适量的硫酸和磷酸的混合液,用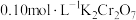 标准溶液反应至完全(还原产物只有
标准溶液反应至完全(还原产物只有 ),消耗标准溶液
),消耗标准溶液 。该
。该 产品的纯度为
产品的纯度为___________ (用含w,V的式子表示)。
 常用于制药和食品添加剂。以海带为原料提取高纯度碘单质并制备
常用于制药和食品添加剂。以海带为原料提取高纯度碘单质并制备 的一种流程如下:
的一种流程如下:
回答下列问题:
(1)“酸化”时稀硫酸的作用是
(2)分离
 和S的混合物得到
和S的混合物得到 溶液的试剂和方法如下,正确的是
溶液的试剂和方法如下,正确的是| 选项 | 试剂 | 方法 |
| a | 二硫化碳 | 分液 |
| b | 酒精 | 分液 |
| c |  溶液 溶液 | 过滤 |
(3)利用下图装置完成
 与
与 反应制备
反应制备 。
。
①
 溶液的作用是
溶液的作用是②三颈烧瓶中产生
 的正确操作顺序为
的正确操作顺序为a.旋开活塞K,通入
 b.加入稀硫酸 c.加入
b.加入稀硫酸 c.加入 溶液
溶液(4)产品纯度测定。
准确称取
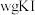 样品溶于水配成
样品溶于水配成 溶液,量取
溶液,量取 溶液于锥形瓶中,加入足量用稀硫酸酸化的
溶液于锥形瓶中,加入足量用稀硫酸酸化的 溶液,摇匀,置于电热板上加热煮沸(常补加热水以保持溶液体积基本不变)。待紫色碘蒸气消失后,再煮沸5分钟,取下放置几分钟,冷却至室温。加入适量的硫酸和磷酸的混合液,用
溶液,摇匀,置于电热板上加热煮沸(常补加热水以保持溶液体积基本不变)。待紫色碘蒸气消失后,再煮沸5分钟,取下放置几分钟,冷却至室温。加入适量的硫酸和磷酸的混合液,用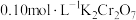 标准溶液反应至完全(还原产物只有
标准溶液反应至完全(还原产物只有 ),消耗标准溶液
),消耗标准溶液 。该
。该 产品的纯度为
产品的纯度为
您最近一年使用:0次
2 . 海带中含有丰富的碘,某中学实验小组为了提取和检验海带灰中的碘,设计了以下实验流程。(已知:海带灰中的碘元素主要以 形式存在)
形式存在)
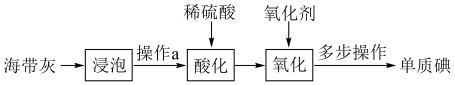
(1)“浸泡”时需充分搅拌,并将悬浊液煮沸2~3分钟,主要的目的是___________ (写一条即可)。
(2)操作a需要用到的玻璃仪器,除烧杯外,还需要___________ 。
(3)“酸化”时需要稀硫酸,回答下列有关问题:
①配制 稀硫酸,需要质量分数为98%的浓硫酸(密度:
稀硫酸,需要质量分数为98%的浓硫酸(密度: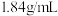 )的体积约为
)的体积约为___________  。(已知:用量筒取用浓硫酸)
。(已知:用量筒取用浓硫酸)
②配制过程的部分操作如下图,则操作步骤的正确顺序为___________ 。(用字母序号表示)
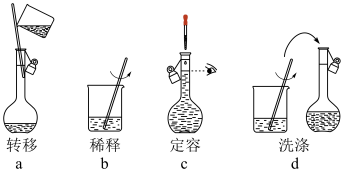
③下列有关配制上述稀硫酸的描述正确的是___________
A.稀释时将蒸馏水缓缓注入盛有浓硫酸的烧杯中
B.溶液未冷却至室温,立即转移、定容
C.定容时俯视容量瓶的刻度线,导致所配溶液的浓度偏大
D.将所配的稀硫酸分装于带橡胶塞的广口瓶中
(4)“氧化”时氧化剂的选择将影响实验结果。
①若选用 ,“氧化”时发生反应的离子方程式为
,“氧化”时发生反应的离子方程式为___________ 。
②若选用 ,过量的
,过量的 可将碘单质氧化成
可将碘单质氧化成 ,其反应的化学方程式为
,其反应的化学方程式为___________ 。
(5)检验“氧化”后的水溶液中是否含有单质碘的实验操作方法___________ 。
 形式存在)
形式存在)
(1)“浸泡”时需充分搅拌,并将悬浊液煮沸2~3分钟,主要的目的是
(2)操作a需要用到的玻璃仪器,除烧杯外,还需要
(3)“酸化”时需要稀硫酸,回答下列有关问题:
①配制
 稀硫酸,需要质量分数为98%的浓硫酸(密度:
稀硫酸,需要质量分数为98%的浓硫酸(密度: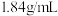 )的体积约为
)的体积约为 。(已知:用量筒取用浓硫酸)
。(已知:用量筒取用浓硫酸)②配制过程的部分操作如下图,则操作步骤的正确顺序为

③下列有关配制上述稀硫酸的描述正确的是
A.稀释时将蒸馏水缓缓注入盛有浓硫酸的烧杯中
B.溶液未冷却至室温,立即转移、定容
C.定容时俯视容量瓶的刻度线,导致所配溶液的浓度偏大
D.将所配的稀硫酸分装于带橡胶塞的广口瓶中
(4)“氧化”时氧化剂的选择将影响实验结果。
①若选用
 ,“氧化”时发生反应的离子方程式为
,“氧化”时发生反应的离子方程式为②若选用
 ,过量的
,过量的 可将碘单质氧化成
可将碘单质氧化成 ,其反应的化学方程式为
,其反应的化学方程式为(5)检验“氧化”后的水溶液中是否含有单质碘的实验操作方法
您最近一年使用:0次
解题方法
3 . 碘及其化合物广泛用于医药、染料等方面。回答下列问题:
Ⅰ. 的一种制备方法如下图所示:
的一种制备方法如下图所示:

(1)“富集”步骤中,生成的黄色固体为______ (填化学式)。
(2)“氧化”步骤中的离子方程式为______ 。
Ⅱ.下图是利用海带浸取原液制备 的甲、乙两种实验方案:
的甲、乙两种实验方案:
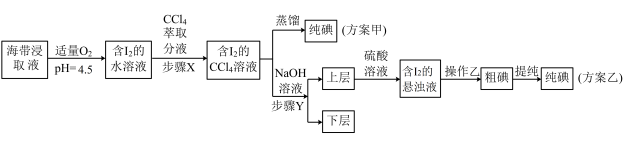
已知:① ;
;
②碘微溶于水,从 左右开始升华;
左右开始升华; 的沸点是
的沸点是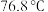 。
。
(3)海带浸取原液在酸性条件下被 氧化的离子方程式是
氧化的离子方程式是______ 。
(4)步骤 需要用到的仪器有
需要用到的仪器有______ (从下列图中选择,写出仪器名称)。
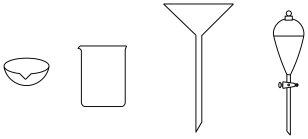
(5)“含 的悬浊液”中,水溶液的主要溶质是
的悬浊液”中,水溶液的主要溶质是______ (填化学式)。
(6)操作乙的名称是______ 。
(7)方案甲中采用“蒸馏”不合理,理由是______ 。
Ⅰ.
 的一种制备方法如下图所示:
的一种制备方法如下图所示:
(1)“富集”步骤中,生成的黄色固体为
(2)“氧化”步骤中的离子方程式为
Ⅱ.下图是利用海带浸取原液制备
 的甲、乙两种实验方案:
的甲、乙两种实验方案:
已知:①
 ;
;②碘微溶于水,从
 左右开始升华;
左右开始升华; 的沸点是
的沸点是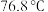 。
。(3)海带浸取原液在酸性条件下被
 氧化的离子方程式是
氧化的离子方程式是(4)步骤
 需要用到的仪器有
需要用到的仪器有
(5)“含
 的悬浊液”中,水溶液的主要溶质是
的悬浊液”中,水溶液的主要溶质是(6)操作乙的名称是
(7)方案甲中采用“蒸馏”不合理,理由是
您最近一年使用:0次
名校
4 . 碘在科研与生活中有重要作用。
Ⅰ.实验室按如下实验流程提取海带中的碘。___________ (从下列图中选择,写出名称)。___________ 。
(3)海带灰中含有的其他可溶性无机盐,是在___________ (从以上流程中选填实验操作名称)中实现与碘分离。
Ⅱ.测定反应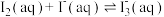 的平衡常数K
的平衡常数K
常温下,取2个碘量瓶分别加入下表中的药品,振荡半小时,均有少量固体不溶。取一定体积的上层清液,加入淀粉作指示剂,用c1 mol L-1 Na2S2O3溶液进行滴定(发生反应
L-1 Na2S2O3溶液进行滴定(发生反应 ),测定
),测定 和
和 的总浓度,进而可以测得K。
的总浓度,进而可以测得K。
(注:在本实验中,认为碘在水中和KI溶液中达到饱和时,它们的碘分子浓度c(I2)相等)
(4)Na2S2O3溶液也可以滴定 的原因是
的原因是___________ (用平衡移动原理回答);滴定终点的实验现象为___________ 。
(5)实验I中,c( )=
)=___________ mol/L(用含c1、c2、c3或c4的式子表示,下同),反应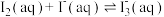 的平衡常数K=
的平衡常数K=___________ 。
(6)若所加的碘偏少,导致实验I中碘量瓶振荡半小时后无固体剩余(不饱和),而实验Ⅱ的碘量瓶中仍有固体不溶,则测得的K将___________ (填“偏大”、“偏小”或“无影响”)。
Ⅰ.实验室按如下实验流程提取海带中的碘。


(3)海带灰中含有的其他可溶性无机盐,是在
Ⅱ.测定反应
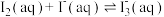 的平衡常数K
的平衡常数K常温下,取2个碘量瓶分别加入下表中的药品,振荡半小时,均有少量固体不溶。取一定体积的上层清液,加入淀粉作指示剂,用c1 mol
 L-1 Na2S2O3溶液进行滴定(发生反应
L-1 Na2S2O3溶液进行滴定(发生反应 ),测定
),测定 和
和 的总浓度,进而可以测得K。
的总浓度,进而可以测得K。(注:在本实验中,认为碘在水中和KI溶液中达到饱和时,它们的碘分子浓度c(I2)相等)
| 碘量瓶 (实验Ⅰ) | 碘量瓶 (实验Ⅱ) | |
| 药品 | 0.5 g研细的碘,100 mL c2 mol L-1 KI L-1 KI | 0.5 g研细的碘,100 mL H2O |
| I2和I3-的总浓度 | c3 mol L-1 L-1 | c4 mol L-1 L-1 |
 的原因是
的原因是(5)实验I中,c(
 )=
)=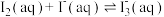 的平衡常数K=
的平衡常数K=(6)若所加的碘偏少,导致实验I中碘量瓶振荡半小时后无固体剩余(不饱和),而实验Ⅱ的碘量瓶中仍有固体不溶,则测得的K将
您最近一年使用:0次



