解题方法
1 . 球上99%的溴存在于海水中,故溴也被称为海洋元素,溴主要用于制造汽油抗爆剂、药品、试剂和农药等。以海水提盐后得到的苦卤为原料,提取溴的流程如图所示。
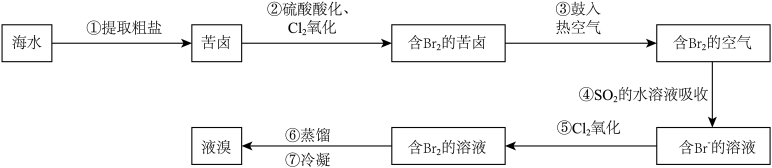
已知:Br2+SO2+2H2O= H2SO4+2HBr。
(1)苦卤可用作提取溴的原料的原因是:_______ 。
(2)写出步骤②中通入Cl2反应的离子方程式:_______ 。
(3)步骤③用热空气将溴吹出制成粗溴,是因为_______(填编号)。
(4)步骤④将Br2转化为Br-,是利用了SO2的_______ 性。
(5)设计一个简单实验,说明溴的活动性大于碘单质:_______ 。

已知:Br2+SO2+2H2O= H2SO4+2HBr。
(1)苦卤可用作提取溴的原料的原因是:
(2)写出步骤②中通入Cl2反应的离子方程式:
(3)步骤③用热空气将溴吹出制成粗溴,是因为_______(填编号)。
| A.Br2的化学性质稳定 | B.Br2沸点低,易挥发 |
| C.Br2易升华 | D.Br2不溶于水 |
(5)设计一个简单实验,说明溴的活动性大于碘单质:
您最近一年使用:0次
2 . 海洋中蕴含丰富的资源。
I.利用海水提取淡水、溴、镁和碘的部分过程如图所示:
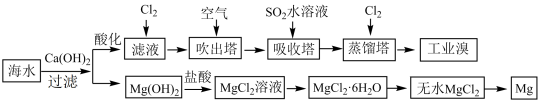
(1)海水中部分离子的含量如下:
其中,Mg2+的物质的量浓度是_______ mol/L。海水淡化的方法有_______ 、离子交换法和电渗析法等。
(2)滤液中通入Cl2后发生反应的离子方程式为_______
(3)提取溴元素时,热空气吹出并用SO2水溶液吸收的目的是_______ ,然后再通入Cl2。
(4)若要提取1mol溴,理论上至少需要标准状况下Cl2的体积为_______ L(忽略Cl2的溶解)。
(5)由无水MgCl2制取Mg的化学方程式为_______ 。
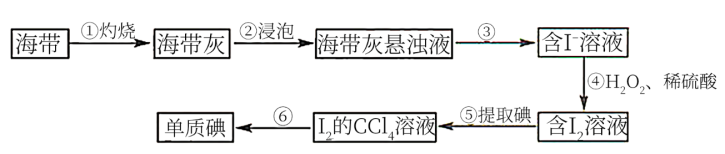
II.海带中含有丰富的碘元素。从海带中提取碘单质的工业生产流程如图所示:
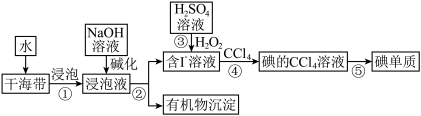
(6)步骤②的操作是_______
(7)步骤③反应的离子方程式有H++OH-=H2O和_______ 。
(8)步骤④还可以选用的试剂是_______ (填字母序号)。
A.苯 B.乙醇 C.己烷 D.乙酸
I.利用海水提取淡水、溴、镁和碘的部分过程如图所示:

(1)海水中部分离子的含量如下:
| 成分 | 含量(mg/L) | 成分 | 含量(mg/L) |
| Na+ | 10560 | Cl- | 18980 |
| Mg2+ | 1272 | Br- | 64 |
| Ca2+ | 400 |  | 2560 |
(2)滤液中通入Cl2后发生反应的离子方程式为
(3)提取溴元素时,热空气吹出并用SO2水溶液吸收的目的是
(4)若要提取1mol溴,理论上至少需要标准状况下Cl2的体积为
(5)由无水MgCl2制取Mg的化学方程式为
II.海带中含有丰富的碘元素。从海带中提取碘单质的工业生产流程如图所示:

(6)步骤②的操作是
(7)步骤③反应的离子方程式有H++OH-=H2O和
(8)步骤④还可以选用的试剂是
A.苯 B.乙醇 C.己烷 D.乙酸
您最近一年使用:0次
名校
3 . 碘元素是人体中重要的微量元素之一,被称为“智力元素”。实验室从海带中提取碘单质的操作流程如图所示。下列说法正确的是


| A.步骤①的操作名称是研磨 |
| B.步骤③中玻璃棒的作用是搅拌 |
C.步骤④中理论上每生成 ,需消耗 ,需消耗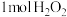 |
D.步骤⑤可以选用 或乙醇 或乙醇 |
您最近一年使用:0次
2023-07-09更新
|
222次组卷
|
2卷引用:广东省肇庆市2022-2023学年高一下学期期末教学质量检测化学试题
解题方法
4 . I.海洋是人类的巨大宝库,在淡水资源短缺的今天,对海水(含 、
、 、
、 、
、 、
、 、
、 等)进行淡化处理是获得淡水的一种重要途径,水的净化处理是一项极为常见而又重要的工作。
等)进行淡化处理是获得淡水的一种重要途径,水的净化处理是一项极为常见而又重要的工作。
(1)在净水过程中需用到混凝剂,混凝剂除去悬浮物质的过程中发生了_______ (填“物理”“化学”或“物理和化学”)变化,其中不能作为混凝剂使用的是_______ (填字母)。
a.硫酸铝 b.氧化铝 c.明矾 d.氯化铁
(2)最早用于海水淡化的方法是蒸馏法,其原理是_______ 。此方法需要大量的能源,现代蒸馏法可利用太阳能提供蒸馏所需要的能量,此过程中的能量转化形式为_______ 。
II.实验室中从海带里提取碘的部分流程如图所示。
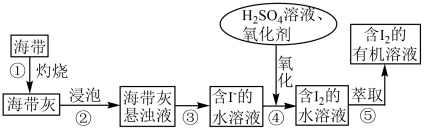
(3)步骤①灼烧海带需要用到的仪器除酒精灯、三脚架和玻璃棒之外,还要用到的仪器有____ 。
(4)步骤③操作的名称为_______ 。
(5)步骤④中通常用双氧水做氧化剂,反应的离子方程式为_______ 。
(6)下列可以用作步骤⑤的萃取剂的是_______ (填字母)。
a.烧碱溶液 b.乙醇 c.四氯化碳 d.苯
 、
、 、
、 、
、 、
、 、
、 等)进行淡化处理是获得淡水的一种重要途径,水的净化处理是一项极为常见而又重要的工作。
等)进行淡化处理是获得淡水的一种重要途径,水的净化处理是一项极为常见而又重要的工作。(1)在净水过程中需用到混凝剂,混凝剂除去悬浮物质的过程中发生了
a.硫酸铝 b.氧化铝 c.明矾 d.氯化铁
(2)最早用于海水淡化的方法是蒸馏法,其原理是
II.实验室中从海带里提取碘的部分流程如图所示。

(3)步骤①灼烧海带需要用到的仪器除酒精灯、三脚架和玻璃棒之外,还要用到的仪器有
(4)步骤③操作的名称为
(5)步骤④中通常用双氧水做氧化剂,反应的离子方程式为
(6)下列可以用作步骤⑤的萃取剂的是
a.烧碱溶液 b.乙醇 c.四氯化碳 d.苯
您最近一年使用:0次
5 . 海带中含有碘元素,从海带中提取碘的实验过程如下所示。
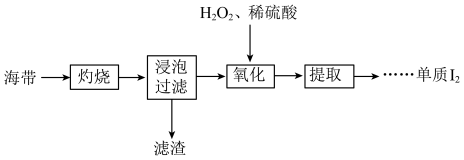
(1)“灼烧”时用到下列仪器中的___________。
(2)“浸泡过滤”后滤液中含有I-,“氧化”的离子方程式为___________ 。
(3)检验“氧化”产生I2的操作:取“氧化”后的少量溶液于试管中,___________ (实验操作及现象)。
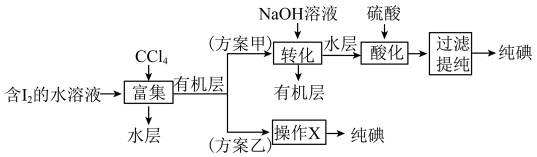
(4)“提取”存在以下两种方案。
已知: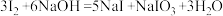 ;酸性条件下,I2在水溶液中的溶解度很小。
;酸性条件下,I2在水溶液中的溶解度很小。
①方案乙中“操作X”的名称是___________ 。
②方案甲中,“酸化”步骤氧化剂与还原剂物质的量之比为___________ 。
③该流程可循环利用的物质是___________ 。
④采用方案乙得到纯碘的产率较低,原因是___________ 。

(1)“灼烧”时用到下列仪器中的___________。
| A.酒精灯 | B.漏斗 | C.蒸发皿 | D.坩埚 |
(3)检验“氧化”产生I2的操作:取“氧化”后的少量溶液于试管中,
(4)“提取”存在以下两种方案。

已知:
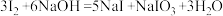 ;酸性条件下,I2在水溶液中的溶解度很小。
;酸性条件下,I2在水溶液中的溶解度很小。①方案乙中“操作X”的名称是
②方案甲中,“酸化”步骤氧化剂与还原剂物质的量之比为
③该流程可循环利用的物质是
④采用方案乙得到纯碘的产率较低,原因是
您最近一年使用:0次
解题方法
6 . 按要求回答下列问题:
Ⅰ.某同学依据反应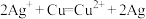 设计的原电池如图所示。
设计的原电池如图所示。
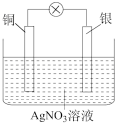
(1)负极上发生的电极反应为_______ 。
(2)溶液中 流向
流向_______ (填“ ”或“
”或“ ”)电极。
”)电极。
(3)当反应进行一段时间后取出电极材料,测得某一电极增重了5.4g,则反应中转移的电子数目是_______  。
。
Ⅱ.海带中含有非富的确元素,某化学研究性学习小组用如图流程从海带中提取碘:
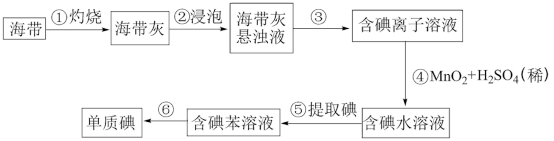
(1)步骤①灼烧海带时,除需要三脚架、泥三角、酒精灯外,还需要用到的实验仪器是_______ (填字母)。
A.烧杯 B.蒸发皿 C.坩埚 D.干燥器:
(2)步骤③、⑥的实验操作名称分别是_______ 、_______ 。步骤⑤中,除选择用苯来提取碘,还可选择的试剂是_______ (填字母)。
A.酒精 B.醋酸 C.四氯化碳
Ⅰ.某同学依据反应
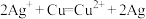 设计的原电池如图所示。
设计的原电池如图所示。
(1)负极上发生的电极反应为
(2)溶液中
 流向
流向 ”或“
”或“ ”)电极。
”)电极。(3)当反应进行一段时间后取出电极材料,测得某一电极增重了5.4g,则反应中转移的电子数目是
 。
。Ⅱ.海带中含有非富的确元素,某化学研究性学习小组用如图流程从海带中提取碘:

(1)步骤①灼烧海带时,除需要三脚架、泥三角、酒精灯外,还需要用到的实验仪器是
A.烧杯 B.蒸发皿 C.坩埚 D.干燥器:
(2)步骤③、⑥的实验操作名称分别是
A.酒精 B.醋酸 C.四氯化碳
您最近一年使用:0次
解题方法
7 . 海带、紫菜等藻类植物中含有丰富的碘元素。其中海带产量高、价格低,常用作提取碘单质的原料。请根据以下流程图,回答下列问题。

(1)操作①主要使用下列仪器中的______ (填仪器名称)。
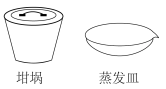
(2)操作③的名称为______ 。
(3)步骤④中加入足量 溶液的目的是将
溶液的目的是将 氧化为
氧化为 。转化中可用
。转化中可用______ (填“ ”或“
”或“ ”)替代
”)替代 ,替代后发生的离子方程式为
,替代后发生的离子方程式为______ 。
(4)含 溶液中加入淀粉溶液,溶液呈
溶液中加入淀粉溶液,溶液呈______ 色。
(5)加碘食盐中的碘,指的是______ (填“ ”或“
”或“ ”)。
”)。

(1)操作①主要使用下列仪器中的

(2)操作③的名称为
(3)步骤④中加入足量
 溶液的目的是将
溶液的目的是将 氧化为
氧化为 。转化中可用
。转化中可用 ”或“
”或“ ”)替代
”)替代 ,替代后发生的离子方程式为
,替代后发生的离子方程式为(4)含
 溶液中加入淀粉溶液,溶液呈
溶液中加入淀粉溶液,溶液呈(5)加碘食盐中的碘,指的是
 ”或“
”或“ ”)。
”)。
您最近一年使用:0次
解题方法
8 . 下列获取物质的方案不合理的是
A. |
B. |
C. |
D.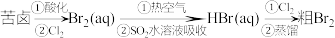 |
您最近一年使用:0次
9 . 碘是人体必需的生命元素,对人类的生长发育起着重要作用。碘主要存在于海带、海水和盐矿中。从海带中提取碘的实验过程如图所示。
已知:① 的升华温度:45℃~77℃;②
的升华温度:45℃~77℃;② 沸点:76.8℃。回答下列问题:
沸点:76.8℃。回答下列问题:
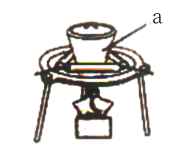
(1)步骤①灼烧海带,实验室通常在如图所示装置中进行,仪器a的名称为___________ 。
(2)步骤③涉及的操作名称为___________ ,实验室进行该操作时用到的玻璃仪器有___________ 。
(3)步骤④中涉及的主要反应的离子方程式为___________ 。
(4)海带灰中还含有其他可溶性无机盐类(硫酸盐、硝酸盐、碳酸盐等),这些盐类是在流程图中的第___________ 步(填编号)与碘分离,若要使碘尽可能地完全转移,应采取的操作是___________ 。
(5)步骤⑥将 与
与 分离可以采用
分离可以采用___________ (填“常压”或“减压”)蒸馏方法,原因是___________ 。
(6)若实验室称得海带的质量为m g,提取单质碘的过程中,碘损失了n%,最后得到单质碘b g,则海带中碘的百分含量为___________ (用含m、n、b的式子表示)

已知:①
 的升华温度:45℃~77℃;②
的升华温度:45℃~77℃;② 沸点:76.8℃。回答下列问题:
沸点:76.8℃。回答下列问题:(1)步骤①灼烧海带,实验室通常在如图所示装置中进行,仪器a的名称为

(2)步骤③涉及的操作名称为
(3)步骤④中涉及的主要反应的离子方程式为
(4)海带灰中还含有其他可溶性无机盐类(硫酸盐、硝酸盐、碳酸盐等),这些盐类是在流程图中的第
(5)步骤⑥将
 与
与 分离可以采用
分离可以采用(6)若实验室称得海带的质量为m g,提取单质碘的过程中,碘损失了n%,最后得到单质碘b g,则海带中碘的百分含量为
您最近一年使用:0次
名校
解题方法
10 . 某学习小组按如下实验流程探究海带中碘含量的测定和碘的提取。
Ⅰ.碘含量的测定

(1)灼烧海带实验用到的主要的含硅酸盐的仪器有酒精灯、玻璃棒、___________ 、___________ 等。
(2)仪器A的名称为:___________ 。
(3)碘浓度还可用色度计测定吸光度,吸光度越大碘浓度越大。用色度计测得某碘溶液的吸光度后,利用以溶液吸光度为纵坐标、碘浓度(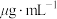 )为横坐标的标准曲线图,可以得出被测溶液碘浓度。为了绘制标准曲线图,取0.10g碘单质,用100mL容量瓶配成碘的
)为横坐标的标准曲线图,可以得出被测溶液碘浓度。为了绘制标准曲线图,取0.10g碘单质,用100mL容量瓶配成碘的 溶液,再从中取出0.10mL加入
溶液,再从中取出0.10mL加入 中配得第一份4.00mL碘的
中配得第一份4.00mL碘的 标准溶液。用色度计测其吸光度,得到标准曲线的第一个坐标点,该坐标点的横坐标是
标准溶液。用色度计测其吸光度,得到标准曲线的第一个坐标点,该坐标点的横坐标是___________ 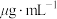 。(注:
。(注: )
)
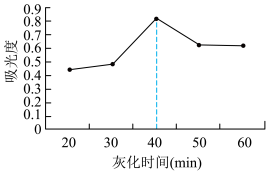
(4)课题组在其他实验条件相同情况下,研究了不同灰化时间(干海带灼烧成灰的时间)对碘提取效果的影响。其结果如图所示。灰化时间超过40min,测得碘的含量逐渐降低,原因是___________ 。
Ⅱ.碘的提取
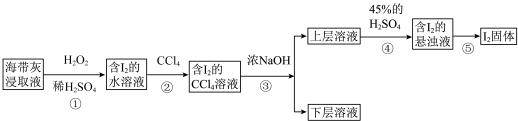
某同学另取海带原液设计如下实验方案提取碘:
步骤③的离子反应方程式为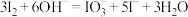
(5)步骤①中发生反应的离子方程式为___________ 。
(6)向含有 的水溶液中加入
的水溶液中加入 振荡静置后的实验现象为
振荡静置后的实验现象为___________ 。
(7)步骤④发生反应的离子方程式为___________ 。
Ⅰ.碘含量的测定

(1)灼烧海带实验用到的主要的含硅酸盐的仪器有酒精灯、玻璃棒、
(2)仪器A的名称为:
(3)碘浓度还可用色度计测定吸光度,吸光度越大碘浓度越大。用色度计测得某碘溶液的吸光度后,利用以溶液吸光度为纵坐标、碘浓度(
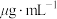 )为横坐标的标准曲线图,可以得出被测溶液碘浓度。为了绘制标准曲线图,取0.10g碘单质,用100mL容量瓶配成碘的
)为横坐标的标准曲线图,可以得出被测溶液碘浓度。为了绘制标准曲线图,取0.10g碘单质,用100mL容量瓶配成碘的 溶液,再从中取出0.10mL加入
溶液,再从中取出0.10mL加入 中配得第一份4.00mL碘的
中配得第一份4.00mL碘的 标准溶液。用色度计测其吸光度,得到标准曲线的第一个坐标点,该坐标点的横坐标是
标准溶液。用色度计测其吸光度,得到标准曲线的第一个坐标点,该坐标点的横坐标是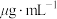 。(注:
。(注: )
)(4)课题组在其他实验条件相同情况下,研究了不同灰化时间(干海带灼烧成灰的时间)对碘提取效果的影响。其结果如图所示。灰化时间超过40min,测得碘的含量逐渐降低,原因是

Ⅱ.碘的提取
某同学另取海带原液设计如下实验方案提取碘:

步骤③的离子反应方程式为
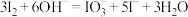
(5)步骤①中发生反应的离子方程式为
(6)向含有
 的水溶液中加入
的水溶液中加入 振荡静置后的实验现象为
振荡静置后的实验现象为(7)步骤④发生反应的离子方程式为
您最近一年使用:0次



