名校
1 . 根据侯德榜制碱法原理并参考下表的数据,实验室制备纯碱  的主要步骤是:将配制好的饱和
的主要步骤是:将配制好的饱和 溶液倒入烧杯中加热,控制温度在
溶液倒入烧杯中加热,控制温度在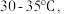 搅拌下分批加入研细的
搅拌下分批加入研细的 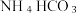 固体,加料完毕后,继续保温 30分钟,静置、过滤得
固体,加料完毕后,继续保温 30分钟,静置、过滤得  晶体。用少量蒸馏水洗涤除去杂质,抽干后,转入蒸发皿中,灼烧2小时,制得
晶体。用少量蒸馏水洗涤除去杂质,抽干后,转入蒸发皿中,灼烧2小时,制得 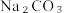 固体。
固体。
四种盐在不同温度下的溶解度(g/100g水)表
 会有分解
会有分解
请回答:
(1)反应温度控制在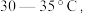 是因为若高于
是因为若高于 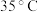 ;则
;则___________ ,若低于 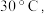 则
则___________ ;为控制此温度范围,采取的加热方法为___________ 。
(2)加料完毕后,继续保温30分钟,目的是___________ 。静置后只析出  晶体的原因是
晶体的原因是___________ 。用蒸馏水洗涤  品体的目的是除去
品体的目的是除去___________ 杂质(以化学式表示)。
(3)过滤所得的母液中含有___________ (以化学式表示),需加入___________ ,并作进一步处理,使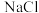 溶液循环使用,同时可回收
溶液循环使用,同时可回收 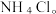
(4)测试纯碱产品中 含量的方法是:准确称取纯碱样品
含量的方法是:准确称取纯碱样品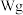 ,放入锥形瓶中加蒸馏水溶解,加 1~2滴酚酞指示剂,用物质的量浓度为
,放入锥形瓶中加蒸馏水溶解,加 1~2滴酚酞指示剂,用物质的量浓度为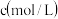 的
的 溶液滴定至溶液由红色到无色(指示
溶液滴定至溶液由红色到无色(指示 反应的终点),所用
反应的终点),所用 溶液体积为
溶液体积为 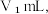 再加 1~2 滴甲基橙指示剂,继续用
再加 1~2 滴甲基橙指示剂,继续用 溶液滴定至溶液由黄变橙,所
溶液滴定至溶液由黄变橙,所 溶液总体积为
溶液总体积为 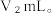 、写出纯碱样品中
、写出纯碱样品中  质量分数的计算式:
质量分数的计算式: 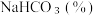 =
=___________ 。
 的主要步骤是:将配制好的饱和
的主要步骤是:将配制好的饱和 溶液倒入烧杯中加热,控制温度在
溶液倒入烧杯中加热,控制温度在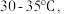 搅拌下分批加入研细的
搅拌下分批加入研细的 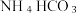 固体,加料完毕后,继续保温 30分钟,静置、过滤得
固体,加料完毕后,继续保温 30分钟,静置、过滤得  晶体。用少量蒸馏水洗涤除去杂质,抽干后,转入蒸发皿中,灼烧2小时,制得
晶体。用少量蒸馏水洗涤除去杂质,抽干后,转入蒸发皿中,灼烧2小时,制得 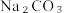 固体。
固体。四种盐在不同温度下的溶解度(g/100g水)表
| 盐 溶解度 温度 | 0℃ | 10℃ | 20℃ | 30℃ | 40℃ | 50℃ | 60℃ | 100℃ |
| NaCl | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 | 37.3 | 39.8 |
| NH₄HCO₃ | 11.9 | 15.8 | 21.0 | 27.0 | -① | — | — | — |
| NaHCO₃ | 6.9 | 8.1 | 9.6 | 11.1 | 12.7 | 14.5 | 16.4 | — |
| NH₄Cl | 29.4 | 33.3 | 37.2 | 41.4 | 45.8 | 50.4 | 55.3 | 77.3 |
 会有分解
会有分解请回答:
(1)反应温度控制在
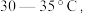 是因为若高于
是因为若高于 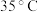 ;则
;则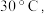 则
则(2)加料完毕后,继续保温30分钟,目的是
 晶体的原因是
晶体的原因是 品体的目的是除去
品体的目的是除去(3)过滤所得的母液中含有
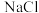 溶液循环使用,同时可回收
溶液循环使用,同时可回收 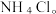
(4)测试纯碱产品中
 含量的方法是:准确称取纯碱样品
含量的方法是:准确称取纯碱样品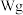 ,放入锥形瓶中加蒸馏水溶解,加 1~2滴酚酞指示剂,用物质的量浓度为
,放入锥形瓶中加蒸馏水溶解,加 1~2滴酚酞指示剂,用物质的量浓度为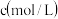 的
的 溶液滴定至溶液由红色到无色(指示
溶液滴定至溶液由红色到无色(指示 反应的终点),所用
反应的终点),所用 溶液体积为
溶液体积为 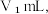 再加 1~2 滴甲基橙指示剂,继续用
再加 1~2 滴甲基橙指示剂,继续用 溶液滴定至溶液由黄变橙,所
溶液滴定至溶液由黄变橙,所 溶液总体积为
溶液总体积为 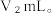 、写出纯碱样品中
、写出纯碱样品中  质量分数的计算式:
质量分数的计算式: 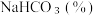 =
=
您最近一年使用:0次
名校
解题方法
2 . 回答下列问题
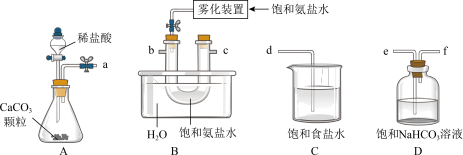
(1)侯德榜先生发明的侯氏制碱法为我国纯碱工业和经济发展做出了重要贡献.某化学兴趣小组在实验室中模拟并改进侯氏制碱法制备 。
。
①如图B中饱和氨盐水是在饱和食盐水中通入氨气形成的,使用雾化装置的优点是______ 。
②向饱和氨盐水中通入二氧化碳,利用 在溶液中溶解度较小,析出
在溶液中溶解度较小,析出 .生成
.生成 的总反应的化学方程式为
的总反应的化学方程式为______ 。
③A~D中选择合适的仪器制备 ,正确的连接顺序是
,正确的连接顺序是______ (按气流方向,用小写字母表示),最后通入NaOH溶液。
(2)实验室需配制240mL1.0mol/L 溶液,请回答下列问题:
溶液,请回答下列问题:
①实验中除了用到托盘天平、药匙、量筒、烧杯、玻璃棒、胶头滴管外,还需用到的玻璃仪器有______ 。
②通过计算可知,该实验需要用托盘天平称量______ g 。
。
③实际配得溶液的浓度小于1.0mo/L,原因不可能的是______ (填序号)。
a.转移溶液前容量瓶内有少量蒸馏水
b.定容摇匀后,发现液面下降,继续加水至刻度线
c.定容时仰视刻度线
(3) 与砂糖混用可以作补血剂,工业上用
与砂糖混用可以作补血剂,工业上用 溶液和
溶液和 溶液发生复分解反应制备.(已知溶液pH大于8.8时,
溶液发生复分解反应制备.(已知溶液pH大于8.8时, 转化为
转化为 沉淀,实验中所用
沉淀,实验中所用 溶液的pH=10)。
溶液的pH=10)。
①上述制备 沉淀时的具体操作是将
沉淀时的具体操作是将______ 溶液缓慢加入盛有______ 溶液的烧杯中,过滤、洗涤、干燥。
②将 溶液缓慢加入到盛有
溶液缓慢加入到盛有 ,溶液的烧杯中也能得到
,溶液的烧杯中也能得到 沉淀,同时在实验中观察到有无色无味的气体产生,该反应的离子方程式为
沉淀,同时在实验中观察到有无色无味的气体产生,该反应的离子方程式为______ 。
(4)某同学在常温下,向100mLNaOH溶液中通入一定量的 气体制备
气体制备 溶液。为测定溶液成分,该同学向所得溶液中逐滴加入0.3mol/L的盐酸,用压强传感器测得压强随盐酸体积的变化曲线如图所示(不考虑
溶液。为测定溶液成分,该同学向所得溶液中逐滴加入0.3mol/L的盐酸,用压强传感器测得压强随盐酸体积的变化曲线如图所示(不考虑 溶于水)
溶于水)______ 。
②该同学使用的NaOH溶液的物质的量浓度为______ mol/L。
(1)侯德榜先生发明的侯氏制碱法为我国纯碱工业和经济发展做出了重要贡献.某化学兴趣小组在实验室中模拟并改进侯氏制碱法制备
 。
。①如图B中饱和氨盐水是在饱和食盐水中通入氨气形成的,使用雾化装置的优点是
②向饱和氨盐水中通入二氧化碳,利用
 在溶液中溶解度较小,析出
在溶液中溶解度较小,析出 .生成
.生成 的总反应的化学方程式为
的总反应的化学方程式为③A~D中选择合适的仪器制备
 ,正确的连接顺序是
,正确的连接顺序是
(2)实验室需配制240mL1.0mol/L
 溶液,请回答下列问题:
溶液,请回答下列问题:①实验中除了用到托盘天平、药匙、量筒、烧杯、玻璃棒、胶头滴管外,还需用到的玻璃仪器有
②通过计算可知,该实验需要用托盘天平称量
 。
。③实际配得溶液的浓度小于1.0mo/L,原因不可能的是
a.转移溶液前容量瓶内有少量蒸馏水
b.定容摇匀后,发现液面下降,继续加水至刻度线
c.定容时仰视刻度线
(3)
 与砂糖混用可以作补血剂,工业上用
与砂糖混用可以作补血剂,工业上用 溶液和
溶液和 溶液发生复分解反应制备.(已知溶液pH大于8.8时,
溶液发生复分解反应制备.(已知溶液pH大于8.8时, 转化为
转化为 沉淀,实验中所用
沉淀,实验中所用 溶液的pH=10)。
溶液的pH=10)。①上述制备
 沉淀时的具体操作是将
沉淀时的具体操作是将②将
 溶液缓慢加入到盛有
溶液缓慢加入到盛有 ,溶液的烧杯中也能得到
,溶液的烧杯中也能得到 沉淀,同时在实验中观察到有无色无味的气体产生,该反应的离子方程式为
沉淀,同时在实验中观察到有无色无味的气体产生,该反应的离子方程式为(4)某同学在常温下,向100mLNaOH溶液中通入一定量的
 气体制备
气体制备 溶液。为测定溶液成分,该同学向所得溶液中逐滴加入0.3mol/L的盐酸,用压强传感器测得压强随盐酸体积的变化曲线如图所示(不考虑
溶液。为测定溶液成分,该同学向所得溶液中逐滴加入0.3mol/L的盐酸,用压强传感器测得压强随盐酸体积的变化曲线如图所示(不考虑 溶于水)
溶于水)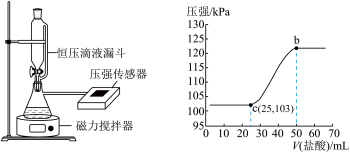
②该同学使用的NaOH溶液的物质的量浓度为
您最近一年使用:0次
2023-05-24更新
|
179次组卷
|
2卷引用:天津市九校2023届高三联考模拟考试化学试题
3 . 化工专家侯德榜发明的侯氏制碱法为我国纯碱工业和国民经济发展做出了重要贡献。
Ⅰ.某化学兴趣小组在实验室中模拟并改进侯氏制碱法制备NaHCO3,进一步处理得到产品Na2CO3和NH4Cl,实验流程如图:
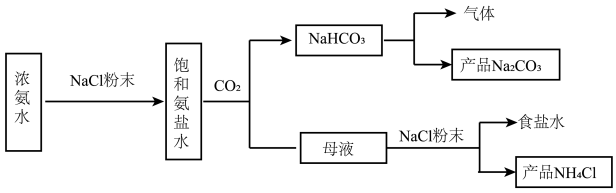
回答下列问题:
(1)从A~E中选择合适的仪器制备NaHCO3,正确的连接顺序是___________ (按气流方向,用小写字母表示)。
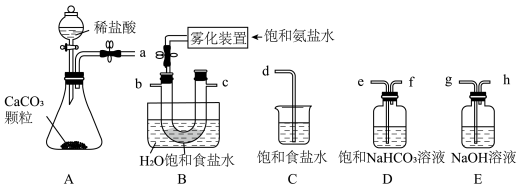
(2)B中使用雾化装置的优点是___________ 。
(3)生成 NaHCO3的总反应的化学方程式为___________ 。
(4)反应完成后,将B中U形管内的混合物处理得到固体NaHCO3和滤液:
①对固体NaHCO3充分加热,产生的气体先通过足量浓硫酸,再通过足量Na2O2,Na2O2增重0.14g,则固体NaHCO3的质量为___________ g。
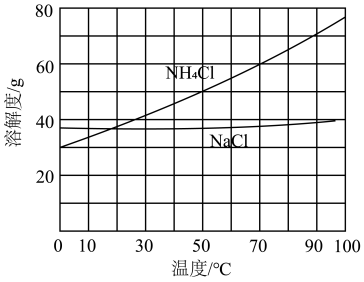
②向滤液中加入NaCl粉末,存在NaCl(s)+NH4Cl(aq)=NaCl(aq)+NH4Cl(s)过程。为使NH4Cl沉淀充分析出并分离,根据NaCl和NH4Cl溶解度曲线,需采用的操作为___________ 、___________ 、洗涤、干燥。
Ⅱ.利用侯德榜原理制备的纯碱中含有少量NaCl等杂质,利用下列装置可用来测定纯碱中的Na2CO3的质量分数。实验步骤如下:
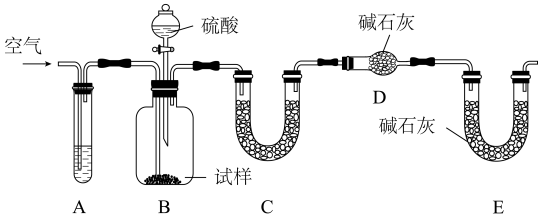
①如图所示,组装好实验仪器,并检查其气密性;
②准确称取盛有碱石灰的干燥管D的质量m1 g;
③准确称取 纯碱,并将其放进广口瓶B内;
纯碱,并将其放进广口瓶B内;
④从分液漏斗中缓缓滴入一定量的稀硫酸,并从前端缓缓地鼓入空气,至B反应器中不再产生气体为止:
⑤准确称取干燥管D的总质量m2 g
根据上述实验,回答下列问题:
(5)该实验进行到操作④时,要缓缓鼓入空气,鼓入空气的作用_____ 。装置A中的液体应选用___________ 。
(6)装置C中盛放的试剂可以是_____ (填选项)。
A.无水硫酸铜 B.浓硫酸 C.无水氯化钙 D.五氧化二磷 E.碱石灰
(7)根据此实验,计算出纯碱中Na2CO3的质量分数为___________ (用m1、m2、n表示)。如果缺少装置E,则实验所得纯碱样品的纯度会___________ (“偏高”、“偏低”、或“无影响”)。
Ⅰ.某化学兴趣小组在实验室中模拟并改进侯氏制碱法制备NaHCO3,进一步处理得到产品Na2CO3和NH4Cl,实验流程如图:

回答下列问题:
(1)从A~E中选择合适的仪器制备NaHCO3,正确的连接顺序是

(2)B中使用雾化装置的优点是
(3)生成 NaHCO3的总反应的化学方程式为
(4)反应完成后,将B中U形管内的混合物处理得到固体NaHCO3和滤液:
①对固体NaHCO3充分加热,产生的气体先通过足量浓硫酸,再通过足量Na2O2,Na2O2增重0.14g,则固体NaHCO3的质量为
②向滤液中加入NaCl粉末,存在NaCl(s)+NH4Cl(aq)=NaCl(aq)+NH4Cl(s)过程。为使NH4Cl沉淀充分析出并分离,根据NaCl和NH4Cl溶解度曲线,需采用的操作为

Ⅱ.利用侯德榜原理制备的纯碱中含有少量NaCl等杂质,利用下列装置可用来测定纯碱中的Na2CO3的质量分数。实验步骤如下:

①如图所示,组装好实验仪器,并检查其气密性;
②准确称取盛有碱石灰的干燥管D的质量m1 g;
③准确称取
 纯碱,并将其放进广口瓶B内;
纯碱,并将其放进广口瓶B内;④从分液漏斗中缓缓滴入一定量的稀硫酸,并从前端缓缓地鼓入空气,至B反应器中不再产生气体为止:
⑤准确称取干燥管D的总质量m2 g
根据上述实验,回答下列问题:
(5)该实验进行到操作④时,要缓缓鼓入空气,鼓入空气的作用
(6)装置C中盛放的试剂可以是
A.无水硫酸铜 B.浓硫酸 C.无水氯化钙 D.五氧化二磷 E.碱石灰
(7)根据此实验,计算出纯碱中Na2CO3的质量分数为
您最近一年使用:0次
名校
4 . I.侯德榜对索尔维制碱法进行了改进,将合成氨工业与纯碱工业联合,发明了侯氏制碱法,又称联合制碱法,生产流程如图所示(  代表所需物质,
代表所需物质,  代表产品)请回答下列问题:
代表产品)请回答下列问题:

(1)产品 C 的名称为_______ ,所需物质 B的电子式为_______ 。
(2)NH3、物质 B 与母液反应的化学方程式为_______ 。操作X 的名称是_______ 。
II.利用侯氏制碱法制备的纯碱中含有少量 杂质, 利用下列装置可用来测定纯碱中的Na2CO3 的质量分数。
杂质, 利用下列装置可用来测定纯碱中的Na2CO3 的质量分数。

实验步骤如下:
① 如图所示,组装好实验仪器,并检查其气密性;
② 准确称取盛有碱石灰的干燥管D 的质量(设为 )
)
③ 准确称取一定量的纯碱(设为 ),并将其放进广口瓶 B 内;
),并将其放进广口瓶 B 内;
④ 从分液漏斗中缓缓滴入一定量的稀硫酸,并从前端缓缓地鼓入空气,至 B 反应器中不再产生气体为止;
⑤ 准确称取干燥管D 的总质量(设为 ) 根据上述实验,请回答下列问题:
) 根据上述实验,请回答下列问题:
(3)该实验进行到操作④时,要缓缓鼓入空气,鼓入空气的作用是_______ 。装置A 中的液体应选用_______ 。
(4)装置B 与D 之间必须添加一装置 C,否则会使测定结果偏高。在空白框内画出该装置C_______ ,装置中盛放的是_______ 。
(5)根据此实验,计算出纯碱中 的质量分数为
的质量分数为_______ (用m1,m2,n表示)。如果缺少装置 E,则实验所得纯碱样品的纯度会_______ (填“偏高”、“偏低”或“无影响”)。
 代表所需物质,
代表所需物质,  代表产品)请回答下列问题:
代表产品)请回答下列问题:
(1)产品 C 的名称为
(2)NH3、物质 B 与母液反应的化学方程式为
II.利用侯氏制碱法制备的纯碱中含有少量
 杂质, 利用下列装置可用来测定纯碱中的Na2CO3 的质量分数。
杂质, 利用下列装置可用来测定纯碱中的Na2CO3 的质量分数。
实验步骤如下:
① 如图所示,组装好实验仪器,并检查其气密性;
② 准确称取盛有碱石灰的干燥管D 的质量(设为
 )
)③ 准确称取一定量的纯碱(设为
 ),并将其放进广口瓶 B 内;
),并将其放进广口瓶 B 内;④ 从分液漏斗中缓缓滴入一定量的稀硫酸,并从前端缓缓地鼓入空气,至 B 反应器中不再产生气体为止;
⑤ 准确称取干燥管D 的总质量(设为
 ) 根据上述实验,请回答下列问题:
) 根据上述实验,请回答下列问题:(3)该实验进行到操作④时,要缓缓鼓入空气,鼓入空气的作用是
(4)装置B 与D 之间必须添加一装置 C,否则会使测定结果偏高。在空白框内画出该装置C
(5)根据此实验,计算出纯碱中
 的质量分数为
的质量分数为
您最近一年使用:0次
2021-01-19更新
|
248次组卷
|
2卷引用:天津市南开区2021届高三上学期期末考试化学试题
5 . 我国化学家侯德榜发明了联合制碱法,对世界制碱工业做出了巨大贡献。联合制碱法的主要过程如图所示(部分物质已略去)。
资料:部分气体的溶解度
NH3:1:700 CO2:1:1
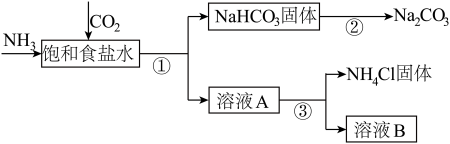
(1)①~③所涉及的操作方法中,包含过滤的是___ (填序号)。
(2)原料CO2可高温煅烧贝壳所得,请写出化学方程式___ 。
(3)根据图,将①中化学方程式补充完整:NH3+CO2+ + =NaHCO3↓+______ 。
(4)②中产生的CO2可循环利用,②中化学方程式为__ 。
资料:部分气体的溶解度
NH3:1:700 CO2:1:1

(1)①~③所涉及的操作方法中,包含过滤的是
(2)原料CO2可高温煅烧贝壳所得,请写出化学方程式
(3)根据图,将①中化学方程式补充完整:NH3+CO2+ + =NaHCO3↓+___
(4)②中产生的CO2可循环利用,②中化学方程式为
您最近一年使用:0次
2020-11-16更新
|
207次组卷
|
2卷引用:天津市红桥区2020-2021学年高一上学期期末考试化学试题
名校
解题方法
6 . 碳酸钠的用途很广,可用做冶金、纺织、漂染等工业的基本原料。请根据题意回答下列问题:
I.世界最早工业生产碳酸钠的方法是路布兰(N.Leblanc)法。其流程如下:

(1)流程II的反应分步进行: a. Na2SO4+4C Na2S +4CO↑ b. Na2S与石灰石发生复分解反应,总反应方程式可表示为
Na2S +4CO↑ b. Na2S与石灰石发生复分解反应,总反应方程式可表示为_______________________________
II.1862 年,比利时人索尔维( ErnestSolvay)用氨碱法生产碳酸钠。反应原理如下:

20℃时一些物质在水中的溶解度/g·( 100gH2O)
III. 我国化工专家_________ 对索尔维制碱法进行了改进,将合成氨工业与纯碱工业联合,发明了联合制碱法。与索尔维制碱法相比,联合制碱法最突出的优点是___________ 。
A.华罗庚 B.钱学森 C.侯德榜 D.钱三强
E.原料利用率高 F.设备少 G.循环利用的物质多 H.原料易得.
(1)“联合制碱法”,其生产过程中发生的反应主要是:
①NH3+CO2+H2O =NH4HCO3.
②NH4HCO3+ NaCl =NaHCO3↓+ NH4Cl
③2NaHCO3 Na2CO3+ H2O+CO2↑
Na2CO3+ H2O+CO2↑
在上述反应中没有涉及到的基本反应类型是( )
A.置换反应 B.化合反应 C.分解反应 D.复分解反应
(2)实验室模拟工业上联合制碱法原理制备纯碱,下列操作未涉及的是( )
A. B.
B. C.
C. D.
D.
联合制碱法改进国外的纯碱生产工艺,使原料氯化钠的利用率从70%提高到90%以上,该生产方法在制得纯碱的同时,还可得到一种副产品。生产流程可简要表示如图:

(3)上述沉淀池中分离出沉淀操作使用的玻璃仪器有_______________________________________________________________________ 。
(4)为检验产品碳酸钠中是否含有氯化钠,可取少量试样溶于水后,还需要的试剂有_______________________________________________________________________ 。
(5)碳酸氢钠分解产生的二氧化碳可循环使用,但必须要补充,补充的主要原因是__________________________________________________________________________ ,
(6)生产中需向分离出NaHCO3后所得的溶液中加入NaCl固体并通入NH3,在__________ (填温度范围)下析出 _____________________________ (填化学式)。

I.世界最早工业生产碳酸钠的方法是路布兰(N.Leblanc)法。其流程如下:

(1)流程II的反应分步进行: a. Na2SO4+4C
 Na2S +4CO↑ b. Na2S与石灰石发生复分解反应,总反应方程式可表示为
Na2S +4CO↑ b. Na2S与石灰石发生复分解反应,总反应方程式可表示为II.1862 年,比利时人索尔维( ErnestSolvay)用氨碱法生产碳酸钠。反应原理如下:

20℃时一些物质在水中的溶解度/g·( 100gH2O)
| NaCl | NH4Cl | NaHCO3 | NH4HCO3 | Na2CO3 |
| 35.9 | 37.2 | 9.6 | 21.7 | 21.5 |
III. 我国化工专家
A.华罗庚 B.钱学森 C.侯德榜 D.钱三强
E.原料利用率高 F.设备少 G.循环利用的物质多 H.原料易得.
(1)“联合制碱法”,其生产过程中发生的反应主要是:
①NH3+CO2+H2O =NH4HCO3.
②NH4HCO3+ NaCl =NaHCO3↓+ NH4Cl
③2NaHCO3
 Na2CO3+ H2O+CO2↑
Na2CO3+ H2O+CO2↑在上述反应中没有涉及到的基本反应类型是
A.置换反应 B.化合反应 C.分解反应 D.复分解反应
(2)实验室模拟工业上联合制碱法原理制备纯碱,下列操作未涉及的是
A.
 B.
B. C.
C. D.
D.
联合制碱法改进国外的纯碱生产工艺,使原料氯化钠的利用率从70%提高到90%以上,该生产方法在制得纯碱的同时,还可得到一种副产品。生产流程可简要表示如图:

(3)上述沉淀池中分离出沉淀操作使用的玻璃仪器有
(4)为检验产品碳酸钠中是否含有氯化钠,可取少量试样溶于水后,还需要的试剂有
(5)碳酸氢钠分解产生的二氧化碳可循环使用,但必须要补充,补充的主要原因是
(6)生产中需向分离出NaHCO3后所得的溶液中加入NaCl固体并通入NH3,在

您最近一年使用:0次
解题方法
7 . 我国化学专家侯德榜(如图)改革国外的纯碱生产工艺,生产流程可简要表示如图:


(1)上述生产纯碱的方法称___ 。
(2)沉淀池中发生的化学反应方程式是__ 。
(3)写出上述流程中X物质的分子式___ 。
(4)从沉淀池中取出沉淀的操作是__ 。
(5)为检验产品碳酸钠中是否含有氯化钠,可取少量试样溶于水后,再滴加__ ;有关离子方程式:___ 。


(1)上述生产纯碱的方法称
(2)沉淀池中发生的化学反应方程式是
(3)写出上述流程中X物质的分子式
(4)从沉淀池中取出沉淀的操作是
(5)为检验产品碳酸钠中是否含有氯化钠,可取少量试样溶于水后,再滴加
您最近一年使用:0次



