安徽省安庆二中2017-2018学年高一第二学期期末考试化学试题
安徽
高一
期末
2019-09-12
297次
整体难度:
适中
考查范围:
认识化学科学、常见无机物及其应用、有机化学基础、物质结构与性质、化学反应原理、化学实验基础
安徽省安庆二中2017-2018学年高一第二学期期末考试化学试题
安徽
高一
期末
2019-09-12
297次
整体难度:
适中
考查范围:
认识化学科学、常见无机物及其应用、有机化学基础、物质结构与性质、化学反应原理、化学实验基础
一、单选题 添加题型下试题
单选题
|
较易(0.85)
名校
1. 人们将化合物分为电解质和非电解质两类,下列属于电解质的是
| A.氯气 | B.金属铝 | C.氯化钠 | D.汽油 |
【知识点】 电解质、非电解质概念解读 非电解质、电解质物质类别判断解读
您最近一年使用:0次
2018-02-02更新
|
257次组卷
|
3卷引用:湖南省师范大学附属中学2017-2018学年高一上学期期末考试化学试题
单选题
|
适中(0.65)
名校
2. 我国的自来水一般是用氯气消毒的。某学生用这种自来水配制下列物质的稀溶液,不会产生明显的药品变质的是
| A.AgNO3 | B.KI | C.NaClO | D.FeCl2 |
您最近一年使用:0次
2018-02-02更新
|
193次组卷
|
3卷引用:湖南省师范大学附属中学2017-2018学年高一上学期期末考试化学试题
单选题
|
适中(0.65)
名校
解题方法
您最近一年使用:0次
2021-09-12更新
|
417次组卷
|
31卷引用:江苏省宿迁市沭阳县2017-2018学年高一(上)期中化学试卷
江苏省宿迁市沭阳县2017-2018学年高一(上)期中化学试卷浙江省金华市第一中学2017-2018学年高一上学期第一次学段考试化学试题湖南省师范大学附属中学2017-2018学年高一上学期期末考试化学试题河北省承德市隆化县存瑞中学2017-2018学年高一第一学期期中考试化学试题【校级联考】福建省八县(市)一中2018-2019学年高一上学期期末考试化学试题湖南省衡阳县2018-2019学年高一第一学期期末质量检测化学试题【市级联考】河北省张家口市2018-2019学年高一第一学期期末质量检测化学试题安徽省安庆二中2017-2018学年高一第二学期期末考试化学试题(已下线)【新东方】高中化学123福建省莆田市第二十五中学2019-2020学年高一上学期期中考试化学试题(已下线)【新东方】高中化学5026河北省承德第一中学2019-2020学年高一上学期期中考试化学试题江苏省连云港市锦屏高级中学2018-2019学年高一上学期期中考试化学试题(已下线)【新东方】2019新中心五地005高中化学(已下线)【新东方】2019新中心五地026高中化学福建省永泰县第一中学2019-2020学年高一上学期期末考试化学试题安徽省六安市第一中学2019-2020学年高一下学期疫情防控延期开学期间辅导测试(二)化学试题河南省鹤壁市高级中学2019-2020学年高一下学期第一次测试化学试题(已下线)新东方【2019】【高一上】【第一次月考】【RZ】【化学】黑龙江省肇东市第四中学校2020-2021学年高一上学期第一次月考化学试题(已下线)【浙江新东方】35甘肃省兰州市第一中学2020-2021学年高一上学期期中考试化学(文)试题(已下线)【浙江新东方】双师 (16)湖南省新宁县崀山培英学校2020-2021学年高一上学期第一次月考化学试题安徽省池州市江南中学2020-2021学年高一上学期期末考试化学试题河北省石家庄市第四中学2020-2021学年高一上学期期中考试化学试题天津市崇化中学2021-2022学年高一上学期过程性检测化学试卷江苏省连云港市锦屏高级中学2016-2017学年高一上学期期中考试化学试题浙江省台州市路桥区东方理想学校2021-2022学年高一10月份月考化学试题 江苏省沭阳县2017-2018学年高二上学期期中考试化学试题2山西省稷山中学2021-2022学年高一上学期第二次月考化学试题
单选题
|
适中(0.65)
名校
4. 下列说法不正确 的是
| A.实验室用二氧化锰和浓盐酸混合加热制备氯气 |
| B.钠是一种强还原剂,可以把钛、锆、铌、钽等从其熔融盐中置换出来 |
| C.常温常压下,二氧化氮与四氧化二氮共存于同一个体系中 |
| D.因为钝化,工业上可用铝槽盛放热的浓硫酸或浓硝酸 |
您最近一年使用:0次
2018-02-02更新
|
227次组卷
|
2卷引用:湖南省师范大学附属中学2017-2018学年高一上学期期末考试化学试题
单选题
|
适中(0.65)
名校
5. 设阿伏加 德罗常数的值为NA,下列说法正确的是
| A.标准状况下,2.24 L CHCl3含有的分子数为0.1NA |
| B.0.1 mol CnH2n+2中含有的碳碳单键数为0.1nNA |
| C.2.8 g乙烯和丙烯的混合气体中所含碳原子为0.2NA |
| D.1 mol苯乙烯中含有碳碳双键数为4NA |
您最近一年使用:0次
2019-09-04更新
|
112次组卷
|
3卷引用:安徽省六安市第一中学2016-2017学年高一下学期期末考试化学试题
单选题
|
容易(0.94)
名校
6. 下列反应中,水只作氧化剂的氧化还原反应是
A. 3Fe+4H2O(g)  Fe3O4+4H2 Fe3O4+4H2 | B.2Na2O2+2H2O=4NaOH+O2↑ |
| C.2F2+2H2O=4HF+O2 | D.Cl2 + H2O ⇌ HCl + HClO |
您最近一年使用:0次
2018-01-04更新
|
448次组卷
|
4卷引用:浙江省金华市第一中学2017-2018学年高一上学期第一次学段考试化学试题
单选题
|
适中(0.65)
名校
7. 如图所示,常温常压下,向盛有3.0 mL NO的试管中缓缓通入1.5 mL O2。最终试管中剩余的气体成分和体积为


| A.NO,1 mL | B.O2,0.5 mL |
| C.NO2,1 mL | D.无法确定 |
【知识点】 氮氧化物溶解于水的相关计算解读
您最近一年使用:0次
单选题
|
较易(0.85)
名校
8. 下列说法中正确的一组是
| A.H2和D2互为同素异形体 |
B. 和 和  互为同分异构体 互为同分异构体 |
| C.乙醇的同分异构体是HO-CH2CH2-OH |
D.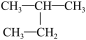 和 和 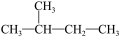 是同一种物质 是同一种物质 |
【知识点】 同分异构现象、同分异构体的概念解读 “四同”的相关比较解读
您最近一年使用:0次
2019-09-04更新
|
174次组卷
|
4卷引用:山东省枣庄市第八中学南校区2016-2017学年高一5月月考化学试题
单选题
|
较易(0.85)
名校
9. 下列各组有机物中,其一氯代物的数目不相等的是
| A.正戊烷和正己烷 | B.新戊烷和2-甲基丙烷 |
| C.环戊烷和乙烷 | D.丙烷和2,3-二甲基丁烷 |
您最近一年使用:0次
2017-06-05更新
|
586次组卷
|
9卷引用:内蒙古包头市第一中学2016-2017学年高一下学期期中考试化学试题2
内蒙古包头市第一中学2016-2017学年高一下学期期中考试化学试题2湖南省长沙市长郡中学2016-2017学年高一下学期期末考试化学试题(已下线)2018年5月6日 每周一测——《每日一题》2017-2018学年高一化学人教必修2湖北省汉川市第二中学2017-2018学年高一下学期期末考试化学试题人教版高二化学选修5 第二章 烃和卤代烃 第三节 卤代烃练习题(已下线)2019年4月28日 《每日一题》 必修2 每周一测山西省应县第一中学校2018-2019学年高一月考八(6月月考)化学试题安徽省安庆二中2017-2018学年高一第二学期期末考试化学试题内蒙古包头市第一中学2016-2017学年高一下学期期中考试化学试题1
单选题
|
适中(0.65)
名校
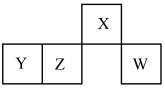
10. 短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示,其中W原子的最外层电子数是最内层电子数的3倍。下列判断正确的是
| A.原子半径:r(W)>r(Z)>r(Y)>r(X) |
| B.Y元素的单质只能跟酸反应,不能跟碱反应 |
| C.最简单气态氢化物的热稳定性:W>Z |
| D.W元素的各种氧化物对应的水化物均为强酸 |
您最近一年使用:0次
2019-06-11更新
|
136次组卷
|
2卷引用:广东省江门市第二中学2018-2019学年高一5月月考化学试题
单选题
|
较易(0.85)
名校
11. 在反应A(g)+2B(g)=3C(g)+4D(g)中,表示该反应速率最快的是
| A.v(A)=0.2 mol/(L·s) | B.v(B)=0.6 mol/(L·s) |
| C.v(C)=0.8 mol/(L·s) | D.v(D)=1 mol/(L·s) |
您最近一年使用:0次
2017-05-13更新
|
387次组卷
|
7卷引用:广西桂林市第一中学2016-2017学年高一下学期期中质量检测化学试题
单选题
|
适中(0.65)
名校
12. 下列叙述错误的是
| A.乙烯使溴水褪色是因为发生了加成反应 |
| B.二氧化硫使溴水褪色是因为发生了氧化还原反应 |
| C.用乙酸和乙醇反应制备乙酸乙酯发生了酯化反应 |
| D.除去乙酸乙酯中的少量乙酸常用氢氧化钠溶液洗涤 |
您最近一年使用:0次
2017-07-05更新
|
173次组卷
|
2卷引用:湖南省师范大学附属中学2016-2017学年高一下学期期末考试化学试题
单选题
|
较易(0.85)
名校
13. 下列关于化学键的说法中不正确的是
| A.化学键是一种作用力 |
| B.化学键可以使离子相结合,也可以使原子相结合 |
| C.化学反应过程中,反应物的化学键断裂,生成物的化学键形成 |
| D.非极性键不是化学键 |
【知识点】 化学键基本概念 共价键 化学键与化学反应本质联系解读
您最近一年使用:0次
2022-09-25更新
|
602次组卷
|
34卷引用:09~10年锦州一中高一下学期期中考试化学卷
(已下线)09~10年锦州一中高一下学期期中考试化学卷(已下线)2011-2012学年贵州省遵义四中高一下学期期中考试化学试卷(已下线)2011-2012学年云南省玉溪一中高一下学期期中考试化学试卷(已下线)2011-2012学年江西上饶中学高一潜能班下期末考试化学试卷2016届河北省衡水市冀州中学高三复习班上月考化学试卷2015-2016学年甘肃会宁一中高一下期中文科化学试卷2015-2016学年广东省佛山一中高一下期中化学试卷2015-2016学年贵州凯里一中高一下期中文科化学试卷2015-2016学年贵州凯里一中高一下期中理科化学试卷2015-2016学年新疆石河子二中高一下学期第二次月考化学试卷2015-2016学年黑龙江省哈尔滨三十二中高一下学期期末化学试卷2015-2016学年天津市五区县高一下学期期末化学试卷2016-2017学年湖北省孝感市七校教学联盟高一下学期期中考试化学试卷贵州省思南中学2016-2017学年高一下学期期中考试理科综合(文)化学试题西藏林芝二中2017-2018学年高一下学期期末考试化学试题湖北省公安县车胤中学2017-2018学年高一3月月考化学试题河南省永城市实验高级中学2018-2019学年高一下学期期中考试化学试题黑龙江省绥滨县第一中学2018-2019学年高一(文)下学期期中考试化学试题黑龙江省牡丹江市第三高级中学2018-2019学年高一下学期期中考试化学试题安徽省安庆二中2017-2018学年高一第二学期期末考试化学试题(已下线)专题5.3 化学键(练)——2020年高考化学一轮复习讲练测山东省2020年夏季普通高中学业水平合格考试模拟(一)化学试题河南省开封市2019-2020学年高一下学期期末调研考试化学试题广西南宁市宾阳县宾阳中学2020-2021学年高一下学期期中考试化学(文)试题人教2019版必修第一册第四章第三节 化学键课后习题甘肃省民乐县第一中学2021-2022学年高一下学期3月第一次月考化学试题新疆喀什地区普通高中2021-2022学年高一上学期期末考试化学试题陕西省西安市鄠邑区第二中学2021-2022学年高一下学期第一次月考化学试题河南省平顶山市蓝天高级中学2021-2022学年高一上学期期末考试化学试题河南省洛阳市2022-2023学年高一上学期期末考试化学试题天津市新华中学2022-2023学年高一上学期期末考试化学试题甘肃省民勤县第一中学2022-2023学年度高一下学期期中考试(选考)化学试题(已下线)2.1.1 共价键(基础)(已下线)2.1.1 共价键课堂例题
单选题
|
容易(0.94)
名校
14. 向一恒容密闭容器中充入2 mol SO2和1mol O2,在一定条件下发生反应:2SO2+O2 2SO3,下列有关说法正确的是
2SO3,下列有关说法正确的是
 2SO3,下列有关说法正确的是
2SO3,下列有关说法正确的是| A.达到化学平衡时,正反应和逆反应的速率都为零 |
| B.当O2的浓度不变时,反应达到平衡状态 |
| C.当单位时间消耗a mol O2,同时消耗2a mol SO2时,反应达到平衡状态 |
| D.当SO2、O2、SO3的分子数比为2:1:2,反应达到平衡状态 |
您最近一年使用:0次
2016-07-25更新
|
429次组卷
|
10卷引用:2012-2013学年北京市西城区(南区)高一下学期期末考试化学试卷
(已下线)2012-2013学年北京市西城区(南区)高一下学期期末考试化学试卷(已下线)2013-2014广西桂林中学高一下学期期中考试化学试卷2014-2015学年河南省三门峡市陕州中学高一下期末模拟化学试卷2015-2016学年陕西省西安七十中高一下学期期末化学试卷2016-2017学年宁夏吴忠中学高二上学期开学考试化学试卷湖南省师范大学附属中学2016-2017学年高一下学期期末考试化学试题安徽省蚌埠市第二中学2017-2018学年高二8月月考化学试题广东省江门市第二中学2018-2019学年高一5月月考化学试题安徽省安庆二中2017-2018学年高一第二学期期末考试化学试题湖南省邵东县第一中学2019-2020学年高一下学期第三次月考化学试题
单选题
|
较易(0.85)
名校
15. 根据原子结构及元素周期律的知识,下列推断正确的是
A. 与 与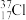 得电子能力相同 得电子能力相同 |
| B.核外电子排布相同的微粒化学性质也相同 |
| C.Cl−、S2−、Ca2+、K+半径逐渐减小 |
| D.同主族元素含氧酸的酸性随核电荷数的增加而减弱 |
【知识点】 同主族元素性质递变规律 微粒半径大小的比较方法解读
您最近一年使用:0次
2017-08-14更新
|
220次组卷
|
4卷引用:安徽省六安市第一中学2016-2017学年高一下学期期末考试化学试题
安徽省六安市第一中学2016-2017学年高一下学期期末考试化学试题甘肃省武威市第六中学2018-2019学年高一下学期第二次学段考试化学试题(已下线)2019年6月9日 《每日一题》 必修2 每周一测安徽省安庆二中2017-2018学年高一第二学期期末考试化学试题
单选题
|
适中(0.65)
名校
16. 如图是批量生产的笔记本电脑所用的甲醇燃料电池的结构示意图。甲醇在催化剂作用下提供质子(H+)和电子,电子经外电路、质子经内电路到达另一极与氧气反应。电池总反应式为2CH3OH+3O2===2CO2+4H2O。下列说法中不正确的是
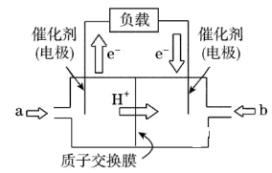

| A.左边的电极为电池的负极,a处通入的是甲醇 |
| B.每消耗3.2 g氧气转移的电子为0.4 mol |
| C.电池负极的反应式为CH3OH+H2O−6e−===CO2+6H+ |
| D.电池的正极反应式为O2+2H2O+4e−===4OH− |
您最近一年使用:0次
2017-06-06更新
|
629次组卷
|
9卷引用:山东省济宁市2016-2017学年高一下学期期末考试化学试题
山东省济宁市2016-2017学年高一下学期期末考试化学试题湖南省长沙市长郡中学2016-2017学年高一下学期期末考试化学试题【全国百强校】黑龙江省大庆实验中学2017-2018学年高一下学期期末考试化学试题湖北省汉川市第二中学2017-2018学年高一下学期期末考试化学试题(已下线)浙江省普通高校招生2019届选考科目化学模拟试卷(已下线)2018年11月浙江省普通高校招生选考科目考试化学仿真模拟试卷02广东省揭阳市惠来县第一中学2018-2019学年高二上学期期中考试化学试题安徽省安庆二中2017-2018学年高一第二学期期末考试化学试题山东省滨州渤海中学2020-2021学年高二上学期10月月考化学试题
二、解答题 添加题型下试题
解答题-无机推断题
|
适中(0.65)
名校
17. 有A、B、C、D四种常见的金属单质,A元素在地壳中含量位列第6,A的密度为0.97 g/cm3;B为紫红色固体,锈蚀时变为绿色;C在空气中加热融化但不滴落;D在氧气燃烧,火星四射。根据以上信息回答下列问题:写出对应化学式:
(1)A在室温下与氧气反应生成______ ,D在空气中锈蚀生成的氧化物为_____ 。
(2)写出下列化学方程式:
①A在空气中燃烧_______________ ;
②B长期置于空气中变成绿色物质_________ 。
(3)将5 g钠铝合金投入200 mL的水中,固体完全溶解,产生4.48 L标准状态下的气体,溶液中只有一种溶质。经过分析得出钠铝合金中两种金属的物质的量之比为______ ,所得溶液中溶质的物质的量浓度为_____ (假设溶液体积变化忽略不计)。
(1)A在室温下与氧气反应生成
(2)写出下列化学方程式:
①A在空气中燃烧
②B长期置于空气中变成绿色物质
(3)将5 g钠铝合金投入200 mL的水中,固体完全溶解,产生4.48 L标准状态下的气体,溶液中只有一种溶质。经过分析得出钠铝合金中两种金属的物质的量之比为
您最近一年使用:0次
解答题-无机推断题
|
适中(0.65)
名校
18. 已知A、B、C、D、E、F六种元素为原子序数依次增大的短周期元素。A为原子半径最小的元素,A和B可形成4原子10电子的分子X;C的最外层电子数是内层的3倍;D原子的最外层电子数是最内层电子数的一半;E是地壳中含量最多的金属元素;F元素的最高正价与最低负价代数和为6。请回答下列问题:(用化学用语填空)
(1)D、E、F三种元素原子半径由大到小的顺序是__ 。
(2)A和C按原子个数比1:1形成4原子分子Y,Y的结构式是__ 。
(3)B、C两种元素的简单气体氢化物结合质子的能力较强的为__ (填化学式),用一个离子方程式证明:__ 。
(4)D可以在液态X中发生类似于与A2C的反应,写出反应的化学方程式:__ 。
(1)D、E、F三种元素原子半径由大到小的顺序是
(2)A和C按原子个数比1:1形成4原子分子Y,Y的结构式是
(3)B、C两种元素的简单气体氢化物结合质子的能力较强的为
(4)D可以在液态X中发生类似于与A2C的反应,写出反应的化学方程式:
您最近一年使用:0次
解答题-实验探究题
|
适中(0.65)
名校
19. 德国化学家凯库勒认为:苯分子是由6个碳原子以单双键相互交替结合而成的环状结构,为了验证凯库勒有关苯环的观点,甲同学设计了如图实验方案。

①按如图所示的装置图连接好各仪器;
②检验装置的气密性;
③在A中加入适量的苯和液溴的混合液体,再加入少量铁粉,塞上橡皮塞,打开止水夹K1、K2、K3;
④待C中烧瓶收集满气体后,将导管b的下端插入烧杯里的水中,挤压预先装有水的胶头滴管的胶头,观察实验现象。
请回答下列问题。
(1)A中所发生反应的反应方程式为_____ ,能证明凯库勒观点错误的实验现象是_____ 。
(2)装置B的作用是_________ 。
(3)C中烧瓶的容器为500 mL,收集气体时,由于空气未排尽,最终水未充满烧瓶,假设烧瓶中混合气体对H2的相对密度为37.9,那么实验结束时,可计算进入烧瓶中的水的体积为_______ mL。(空气的平均相对分子质量为29)
(4)已知乳酸的结构简式为: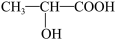 。试回答: 乳酸跟氢氧化钠溶液反应的化学方程式:
。试回答: 乳酸跟氢氧化钠溶液反应的化学方程式:______ 。

①按如图所示的装置图连接好各仪器;
②检验装置的气密性;
③在A中加入适量的苯和液溴的混合液体,再加入少量铁粉,塞上橡皮塞,打开止水夹K1、K2、K3;
④待C中烧瓶收集满气体后,将导管b的下端插入烧杯里的水中,挤压预先装有水的胶头滴管的胶头,观察实验现象。
请回答下列问题。
(1)A中所发生反应的反应方程式为
(2)装置B的作用是
(3)C中烧瓶的容器为500 mL,收集气体时,由于空气未排尽,最终水未充满烧瓶,假设烧瓶中混合气体对H2的相对密度为37.9,那么实验结束时,可计算进入烧瓶中的水的体积为
(4)已知乳酸的结构简式为:
 。试回答: 乳酸跟氢氧化钠溶液反应的化学方程式:
。试回答: 乳酸跟氢氧化钠溶液反应的化学方程式:
您最近一年使用:0次
解答题-实验探究题
|
适中(0.65)
名校
20. 有甲、乙两同学想利用原电池反应验证金属的活泼性强弱,两人均用镁片和铝片作电极,但甲同学将两电极放入6 mol/L 的H2SO4溶液中,乙同学将两电极放入6 mol/L的NaOH溶液中,装置如图所示。
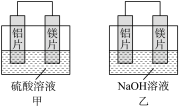
(1)写出甲中正极的电极方程式:____ ;
(2)乙中负极材料为___________ ;总反应的离子方程式为__________ 。
(3)甲、乙两同学都认为“如果构成原电池的电极材料都是金属,则作负极的金属应比作正极的金属活泼”,则甲同学得出的结论是_____ 的活动性更强,乙同学得出的结论是_____ 的活动性更强。(填元素符号)
(4)由该实验得出的下列结论中,正确的是___ (填字母)
A利用原电池反应判断金属活泼性强弱时应注意选择合适的电解质
B镁的金属性不一定比铝的金属性强
C该实验说明金属活泼性顺序表已经过时,没有实用价值
D该实验说明化学研究对象复杂,反应受条件影响较大,因此应具体问题具体分析

(1)写出甲中正极的电极方程式:
(2)乙中负极材料为
(3)甲、乙两同学都认为“如果构成原电池的电极材料都是金属,则作负极的金属应比作正极的金属活泼”,则甲同学得出的结论是
(4)由该实验得出的下列结论中,正确的是
A利用原电池反应判断金属活泼性强弱时应注意选择合适的电解质
B镁的金属性不一定比铝的金属性强
C该实验说明金属活泼性顺序表已经过时,没有实用价值
D该实验说明化学研究对象复杂,反应受条件影响较大,因此应具体问题具体分析
您最近一年使用:0次
2019-09-04更新
|
234次组卷
|
3卷引用:湖南省长沙市长郡中学2016-2017学年高一下学期期末考试化学试题
试卷分析
整体难度:适中
考查范围:认识化学科学、常见无机物及其应用、有机化学基础、物质结构与性质、化学反应原理、化学实验基础
试卷题型(共 20题)
题型
数量
单选题
16
解答题
4
试卷难度
知识点分析
细目表分析 导出
| 题号 | 难度系数 | 详细知识点 | 备注 |
| 一、单选题 | |||
| 1 | 0.85 | 电解质、非电解质概念 非电解质、电解质物质类别判断 | |
| 2 | 0.65 | 氯水的性质 氯水性质实验探究 | |
| 3 | 0.65 | 胶体的定义及分类 胶体的性质和应用 | |
| 4 | 0.65 | 氯气的实验室制法 二氧化氮与四氧化二氮的相互转化 钠的化学性质 铝的钝化 | |
| 5 | 0.65 | 阿伏加德罗常数的应用 结合气体物质与NA相关推算 结合氧化还原反应知识与NA相关推算 结合物质结构基础知识与NA相关推算 | |
| 6 | 0.94 | 氧化还原反应的几组概念 氧化还原反应定义、本质及特征 | |
| 7 | 0.65 | 氮氧化物溶解于水的相关计算 | |
| 8 | 0.85 | 同分异构现象、同分异构体的概念 “四同”的相关比较 | |
| 9 | 0.85 | 简单有机物同分异构体书写及辨识 同分异构体的数目的确定 | |
| 10 | 0.65 | 元素周期律、元素周期表的推断 同周期元素性质递变规律理解及应用 根据原子结构进行元素种类推断 | |
| 11 | 0.85 | 化学反应速率计算 化学反应速率与化学计量数之间的关系 | |
| 12 | 0.65 | 二氧化硫与其他强氧化剂的反应 乙烯的加成反应 乙酸乙酯制备实验 | |
| 13 | 0.85 | 化学键基本概念 共价键 化学键与化学反应本质联系 | |
| 14 | 0.94 | 可逆反应及反应限度 化学平衡状态本质及特征 化学平衡状态的判断方法 | |
| 15 | 0.85 | 同主族元素性质递变规律 微粒半径大小的比较方法 | |
| 16 | 0.65 | 原电池原理理解 原电池电子流向判断及应用 原电池正负极判断 原电池电极反应式书写 | |
| 二、解答题 | |||
| 17 | 0.65 | 氧化钠的化学性质 铝与强碱溶液反应 铁与非金属单质反应 铜绿 | 无机推断题 |
| 18 | 0.65 | 元素周期律、元素周期表的推断 元素周期表的应用 金属与非金属在周期表中位置及其性质递变的规律 元素周期律的应用 | 无机推断题 |
| 19 | 0.65 | 苯分子结构的特点 苯的取代反应 苯的溴代实验探究 实验方案设计的基本要求 | 实验探究题 |
| 20 | 0.65 | 原电池 原电池原理的应用 通过实验探究原电池原理 利用原电池原理比较金属活动性强弱 | 实验探究题 |



