江西省赣县第三中学2020-2021学年高二上学期11月强化训练(三)化学试题
江西
高二
阶段练习
2021-01-17
220次
整体难度:
适中
考查范围:
化学反应原理、化学实验基础
江西省赣县第三中学2020-2021学年高二上学期11月强化训练(三)化学试题
江西
高二
阶段练习
2021-01-17
220次
整体难度:
适中
考查范围:
化学反应原理、化学实验基础
一、单选题 添加题型下试题
单选题
|
较易(0.85)
名校
1. 下列说法正确的是
| A.一定温度下,加水稀释醋酸溶液,溶液中所有离子浓度均减小 |
| B.室温下,Ksp(AgCl)=1.8×10﹣10,Ksp(Ag2CrO4)=2.0×10﹣12,则AgCl溶解度较大 |
| C.碳酸钡不能作“钡餐”而硫酸钡能 |
| D.配制FeSO4溶液时,将FeSO4固体溶于稀盐酸中,然后稀释至所需浓度 |
您最近一年使用:0次
2020-10-19更新
|
172次组卷
|
2卷引用:河北省石家庄市辛集市第一中学2019-2020学年高二第二次考试(二)化学试题
单选题
|
较难(0.4)
名校
2. 下面说法中,与盐类水解无关的是
①明矾和AlCl3可作净水剂
②为保存FeCl3溶液,要在溶液中加入少量盐酸
③实验室配制AlCl3溶液,先把它溶解在盐酸中,而后加水稀释
④NH4Cl和ZnCl2溶液可作金属焊接中的除锈剂
⑤实验室盛放Na2CO3、Na2SiO3 等溶液的试剂瓶应用橡皮塞
⑥在NH4Cl或AlCl3 溶液中加入镁条会产生气泡
⑦Na2S溶液和AlCl3溶液反应得不到Al2S3
⑧长期使用硫铵,土壤酸性增强,草木灰与铵态氮肥不能混合施用
①明矾和AlCl3可作净水剂
②为保存FeCl3溶液,要在溶液中加入少量盐酸
③实验室配制AlCl3溶液,先把它溶解在盐酸中,而后加水稀释
④NH4Cl和ZnCl2溶液可作金属焊接中的除锈剂
⑤实验室盛放Na2CO3、Na2SiO3 等溶液的试剂瓶应用橡皮塞
⑥在NH4Cl或AlCl3 溶液中加入镁条会产生气泡
⑦Na2S溶液和AlCl3溶液反应得不到Al2S3
⑧长期使用硫铵,土壤酸性增强,草木灰与铵态氮肥不能混合施用
| A.①④⑦ | B.②⑤⑧ | C.③④⑥ | D.全有关 |
您最近一年使用:0次
2018-12-28更新
|
1204次组卷
|
10卷引用:【全国百强校】福建省上杭县第一中学2018-2019学年高二上学期12月月考化学试题
【全国百强校】福建省上杭县第一中学2018-2019学年高二上学期12月月考化学试题陕西省渭南市临渭区尚德中学2019-2020学年高二上学期期中考试化学试题安徽省六安市霍邱县第二中学2019-2020学年高一上学期第三次月考化学试题夯基提能2020届高三化学选择题对题专练——选修4化学反应原理—— 双水解及其应用(已下线)【南昌新东方】2019 南昌五中 高二上 期中. 黑龙江省黑河市嫩江县高级中学2019-2020学年高二下学期第一次月考化学试题江西省赣县第三中学2020-2021学年高二上学期11月强化训练(三)化学试题河南省南阳市第一中学校2023-2024学年高二上学期第三次月考化学试题 新疆维吾尔自治区乌鲁木齐八一中学2023-2024学年高二上学期1月期末化学试题江西省赣州市大余县部分学校联考2023-2024学年高二上学期12月月考化学试题
单选题
|
适中(0.65)
名校
解题方法
3. 下列叙述中不正确的是
| A.对于阴阳离子个数比相同的难溶电解质,溶度积大的溶解度也大 |
| B.向含有Ca(OH)2固体的溶液中加入适量的水使Ca(OH)2溶解,又达到平衡时,Ca(OH)2的溶度积不变 |
| C.将难溶电解质放入纯水中,达到沉淀溶解平衡时,难溶电解质电离出的离子的浓度之积就是该难溶电解质的溶度积 |
| D.AgCl水溶液的导电性很弱,但AgCl是强电解质 |
【知识点】 沉淀溶解平衡的应用 难溶电解质溶解平衡定义及特征解读
您最近一年使用:0次
2020-04-29更新
|
72次组卷
|
2卷引用:江西省萍乡市莲花中学2019-2020高一下学期3月特色班月考化学试题
单选题
|
适中(0.65)
名校
解题方法
4. 关于0.1mol/LNa2CO3 溶液,下列判断不正确的是
| A.粒子种类与NaHCO3 溶液不同 | B.升高温度,c 减小 减小 |
C.加入Ca(OH)2溶液,c 减小 减小 | D.cH+ +cNa+ =2c +c +c +cOH- +cOH- |
您最近一年使用:0次
2020-07-03更新
|
88次组卷
|
2卷引用:北京市海淀区十九中2019-2020学年高二下学期期末考试化学试题
单选题
|
较易(0.85)
5. 欲使沉淀溶解平衡 向右移动,可采用的方法是
向右移动,可采用的方法是
 向右移动,可采用的方法是
向右移动,可采用的方法是| A.增大溶液的pH | B.加入 固体 固体 |
C.加入 固体 固体 | D.加入适量无水乙醇 |
您最近一年使用:0次
2020-09-19更新
|
126次组卷
|
2卷引用:鲁科版(2019)选择性必修1 第3章 物质在水溶液中的行为 第3节 沉淀溶解平衡
单选题
|
适中(0.65)
名校
解题方法
6. 常温时,向20mL0.1mol/L的CH3COOH溶液中逐滴滴加0.1mol/L的NaOH溶液,溶液pH随NaOH溶液的体积变化如图所示。下列说法正确的是
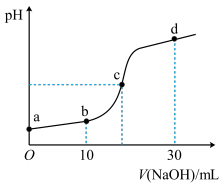

| A.a点:pH=1 |
| B.c点:V(NaOH)=20mL |
| C.b点:离子浓度的大小关系为c(CH3COO-)>c(Na+)>c(H+)>c(OH-) |
| D.a→d过程中,水电离出c(H+)不断增大 |
您最近一年使用:0次
2020-07-18更新
|
257次组卷
|
3卷引用:北京市朝阳区2019-2020学年高二下学期期末考试化学试题
单选题
|
适中(0.65)
名校
解题方法
7. 下列溶液中浓度关系正确的是
A.小苏打溶液中:c(Na+)+c(H+)=c( )+c( )+c( )+c(OH-) )+c(OH-) |
| B.常温时,向CaCO3的饱和溶液中加入Na2CO3固体,则CaCO3的溶度积常数增大 |
| C.0.1 mol/L的NaHA溶液,其pH=4,则c(HA-)>c(H+)>c(H2A)>c(A2-) |
| D.物质的量浓度相等的CH3COOH溶液和CH3COONa溶液等体积混合:c(CH3COO-)+2c(OH-)=2c(H+)+c(CH3COOH) |
您最近一年使用:0次
单选题
|
适中(0.65)
名校
8. 将足量BaCO3粉末分别加入下列溶液中,充分溶解至溶液饱和。各溶液中Ba2+的浓度最小的为
| A.40mL 水 | B.10mL 0.2 mol·L-1Na2CO3溶液 |
| C.50mL 0.01 mol·L-1氯化钡溶液 | D.100mL 0.01 mol·L-1盐酸 |
【知识点】 浓度对难溶电解质溶解平衡的影响解读
您最近一年使用:0次
2017-12-25更新
|
304次组卷
|
16卷引用:2010年海南省嘉积中学高二下学期期末考试化学(理)试题
(已下线)2010年海南省嘉积中学高二下学期期末考试化学(理)试题(已下线)2010年长春外国语学校高二第一学期期末考试化学试卷(已下线)2011-2012学年甘肃省白银市平川中恒学校高二上学期期末考试化学(理)试卷(已下线)2011-2012学年吉林省长春外国语学校高二上学期期末考试化学试卷(已下线)2012-2013学年甘肃武威第五中学高二10月月考理科化学试卷2016-2017学年重庆市第七中学等六校高二上学期期末考试化学试卷陕西省西安市长安区第一中学2017-2018学年高二上学期第二次月考化学试题内蒙古鄂尔多斯市第一中学2017-2018学年高二上学期第三次月考化学试题辽宁省普兰店市第一中学2018-2019学年高二(理)上学期期中考试化学试题四川省江油中学2019-2020学年高二6月月考化学试题河北省安平中学2020-2021学年高二上学期第三次月考化学试题江西省赣县第三中学2020-2021学年高二上学期11月强化训练(三)化学试题四川省乐山市2020-2021学年高二下学期期末考试化学试题黑龙江省哈尔滨师范大学附属中学2021-2022学年高二上学期期中考试化学(理)试题贵州省毕节市第一中学2021-2022学年高二上学期第二次阶段性考试化学试题四川省泸州市泸县第一中学2021-2022学年高二下学期期中考试化学试题
单选题
|
较易(0.85)
名校
9. 取1 mL 0.1 mol·L-1AgNO3溶液进行如下实验(实验中所用试剂浓度均为0.1 mol·L-1):

下列说法不正确的是

下列说法不正确的是
| A.实验①白色沉淀是难溶的AgCl | B.若按②①顺序实验,能看到白色沉淀 |
| C.若按①③顺序实验,能看到黑色沉淀 | D.由实验②说明 AgI 比 AgCl 更难溶 |
您最近一年使用:0次
2020-07-03更新
|
279次组卷
|
8卷引用:北京市海淀区十九中2019-2020学年高二下学期期末考试化学试题
北京市海淀区十九中2019-2020学年高二下学期期末考试化学试题(已下线)3.4.1 难溶电解质的沉淀溶解平衡(练习)-2020-2021学年上学期高二化学同步精品课堂(新教材人教版选择性必修1)山西省怀仁市第一中学云东校区2020-2021学年高二上学期第三次月考化学试题江西省赣县第三中学2020-2021学年高二上学期11月强化训练(三)化学试题(已下线)考向27 难溶电解质的溶解平衡-备战2022年高考化学一轮复习考点微专题(已下线)第八章 水溶液中的离子反应与平衡 第52讲 难溶电解质的溶解平衡(已下线)第15讲 沉淀溶解平衡-【暑假自学课】2023年新高二化学暑假精品课(人教版2019选择性必修1)(已下线)第5讲 难溶电解质的溶解平衡
单选题
|
较难(0.4)
名校
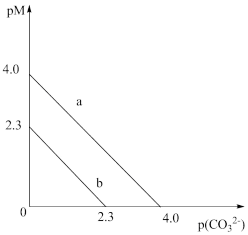
10. T℃时,两种碳酸盐 (M表示
(M表示 或
或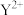 )的沉淀溶解平衡曲线如图所示。已知:
)的沉淀溶解平衡曲线如图所示。已知: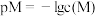 ,
,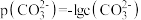 ,
,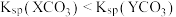 。下列说法正确的是
。下列说法正确的是
 (M表示
(M表示 或
或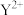 )的沉淀溶解平衡曲线如图所示。已知:
)的沉淀溶解平衡曲线如图所示。已知: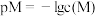 ,
,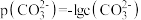 ,
,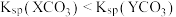 。下列说法正确的是
。下列说法正确的是
A.a表示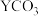 的沉淀溶解平衡曲线 的沉淀溶解平衡曲线 |
B. |
C.T℃时,向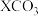 悬浊液中加入饱和 悬浊液中加入饱和 溶液,可能有 溶液,可能有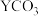 生成 生成 |
D.T℃时,向饱和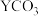 溶液中加入 溶液中加入 溶液,一定能产生 溶液,一定能产生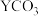 沉淀 沉淀 |
您最近一年使用:0次
2021-12-13更新
|
129次组卷
|
7卷引用:山东省日照市2020届高三校际联合考试(二模)化学试题
单选题
|
较易(0.85)
名校
11. 在2mL NaCl溶液中加入1滴AgNO3溶液,有白色沉淀生成;再加入1滴KI溶液,沉淀转化为黄色,然后再加入1滴Na2S溶液,沉淀又转化为黑色(以上所用的溶液物质的量浓度均相同),下列表示各沉淀物溶解度由大到小的顺序正确的是
| A.Ag2S 、 AgI 、 AgCl | B.AgCl 、 AgI 、 Ag2S |
| C.AgI 、 AgCl、 Ag2S | D.AgCl 、 Ag2S 、 AgI |
您最近一年使用:0次
2016-12-09更新
|
468次组卷
|
7卷引用:2011-2012学年湖南省蓝山二中高二上学期期末考试化学试卷
单选题
|
较易(0.85)
名校
12. 下列说法正确的是( )
| A.饱和石灰水中加入一定量生石灰,温度明显升高,所得溶液的pH增大 |
B.Fe(OH)3悬浊液中存在平衡:Fe(OH)3(s) Fe3+(aq)+3OH-(aq),向其中加入少量 Fe3+(aq)+3OH-(aq),向其中加入少量 粉末,平衡向左移动,体系中离子的总浓度会减小 粉末,平衡向左移动,体系中离子的总浓度会减小 |
C.硬水中含有较多的Ca2+、Mg2+、HCO 、SO 、SO 等离子,加热煮沸可以完全除去其中的Ca2+、Mg2+ 等离子,加热煮沸可以完全除去其中的Ca2+、Mg2+ |
| D.为减小洗涤过程中固体的损失,最好选用稀硫酸代替H2O来洗涤BaSO4沉淀 |
您最近一年使用:0次
2020-10-14更新
|
473次组卷
|
4卷引用:人教版(2019)高二化学选择性必修1第三章 水溶液中的离子反应与平衡 第四节 沉淀溶解平衡
二、填空题 添加题型下试题
填空题
|
适中(0.65)
名校
解题方法
13. (1)K2C2O4水解的离子方程式___________ ;Fe(OH)3沉淀溶解平衡方程式___________ ,其溶度积的表达式为___________
(2)用离子方程式表示不能硫酸铝和硫化钠溶液制备硫化铝的的原因___________ 。
(3)物质的量浓度相同的下列溶液:①Na2CO3②NaHCO3③H2CO3④(NH4)2CO3⑤NH4HCO3,其中c(CO )最小的是
)最小的是___________ (填序号)。
(4)请写出0.1mol/L的NH4HCO3物料守恒关系式:___________ 。
(5)已知常温下, ,
, 。向含有
。向含有 和
和 的混合溶液中逐滴加入
的混合溶液中逐滴加入 溶液(忽略溶液体积变化),判断先析出的沉淀是
溶液(忽略溶液体积变化),判断先析出的沉淀是___________ (写化学式)。
(6)CO2在自然界循环时可与CaCO3反应,Ksp(CaCO3)=2.8×10−9. CaCl2溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为5.6×10−5mol/L,则生成沉淀所需CaCl2溶液的最小浓度为___________ 。
(7)已知常温下物质的量浓度相同的三种盐溶液:NaX,NaY,NaZ,它们的pH依次为10、9、8,则可知相对应的三种酸HX、HY、HZ的酸性强弱顺序为___________ 。
(2)用离子方程式表示不能硫酸铝和硫化钠溶液制备硫化铝的的原因
(3)物质的量浓度相同的下列溶液:①Na2CO3②NaHCO3③H2CO3④(NH4)2CO3⑤NH4HCO3,其中c(CO
 )最小的是
)最小的是(4)请写出0.1mol/L的NH4HCO3物料守恒关系式:
(5)已知常温下,
 ,
, 。向含有
。向含有 和
和 的混合溶液中逐滴加入
的混合溶液中逐滴加入 溶液(忽略溶液体积变化),判断先析出的沉淀是
溶液(忽略溶液体积变化),判断先析出的沉淀是(6)CO2在自然界循环时可与CaCO3反应,Ksp(CaCO3)=2.8×10−9. CaCl2溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为5.6×10−5mol/L,则生成沉淀所需CaCl2溶液的最小浓度为
(7)已知常温下物质的量浓度相同的三种盐溶液:NaX,NaY,NaZ,它们的pH依次为10、9、8,则可知相对应的三种酸HX、HY、HZ的酸性强弱顺序为
您最近一年使用:0次
三、计算题 添加题型下试题
14. 研究电解质在水溶液中的平衡能了解它的存在形式。
(1)常温下,向100mL0.01mol•L-1HA的溶液中逐滴加入0.02mol•L-1MOH溶液,所得溶液的pH随MOH溶液的体积变化如图所示(溶液体积变化忽略不计) 。
。

①常温下,0.01mol•L-1HA溶液中由水电离出的c(H+)=___________ mol•L-1。
②X点时,溶液中各离子浓度由大到小的顺序是___________ 。
③K点时,溶液中c(H+)+c(M+)–c(OH-)=___________ mol•L-1。
(2) 25℃时,几种离子开始沉淀时的pH如下表:
当向含相同浓度Cu2+、Mg2+、Fe2+的溶液中滴加NaOH溶液时,___________ 先沉淀(填离子符号),要使0.3mol·L-1硫酸铜溶液中Cu2+沉淀较为完全(当Cu2+浓度降至10-5 mol·L-1时),则应向溶液里加入氢氧化钠溶液使溶液pH为___________ (Ksp[Cu(OH)2]=1×10-21)
(3)在25℃时,碳酸钙在水中的沉淀溶解平衡曲线如图所示,已知25℃时硫酸钙的Ksp=9.1×10-6。

(1)通过蒸发,可使稀溶液由___________ 点变化到___________ 点。
(2)在25℃时,反应CaSO4(s)+CO (aq)⇌CaCO3(s)+SO
(aq)⇌CaCO3(s)+SO (aq)的平衡常数K
(aq)的平衡常数K___________
(1)常温下,向100mL0.01mol•L-1HA的溶液中逐滴加入0.02mol•L-1MOH溶液,所得溶液的pH随MOH溶液的体积变化如图所示(溶液体积变化忽略不计)
 。
。
①常温下,0.01mol•L-1HA溶液中由水电离出的c(H+)=
②X点时,溶液中各离子浓度由大到小的顺序是
③K点时,溶液中c(H+)+c(M+)–c(OH-)=
(2) 25℃时,几种离子开始沉淀时的pH如下表:
| 离子 | Fe2+ | Cu2+ | Mg2+ |
| pH | 7.6 | 5.2 | 10.4 |
当向含相同浓度Cu2+、Mg2+、Fe2+的溶液中滴加NaOH溶液时,
(3)在25℃时,碳酸钙在水中的沉淀溶解平衡曲线如图所示,已知25℃时硫酸钙的Ksp=9.1×10-6。

(1)通过蒸发,可使稀溶液由
(2)在25℃时,反应CaSO4(s)+CO
 (aq)⇌CaCO3(s)+SO
(aq)⇌CaCO3(s)+SO (aq)的平衡常数K
(aq)的平衡常数K
您最近一年使用:0次
四、解答题 添加题型下试题
15. 实验室以工业废渣(主要含CaSO4∙2H2O,还含少量SiO2、Al2O3、FeO、Fe2O3)为原料制取(NH4)2SO4晶体和轻质CaCO3,其实验流程如下:
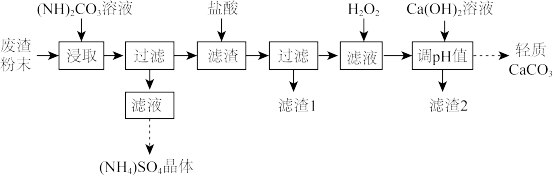
已知:①金属离子形成氢氧化物沉淀的pH范围(pH=8.5时Al(OH)3开始溶解)
②已知常温下,Ksp(CaSO4)=4.8×10-5,Ksp(CaCO3)=3×10-9
回答下列问题:
(1)废渣粉末“浸取”时,主要反应的离子方程式为_____________________________ 。实验时需向(NH4)2CO3溶液中加入适量浓氨水的目的是______________________ 。
(2)废渣粉末“浸取”时,反应温度需控制在60~70℃,合适的加热方式为_________ 。若温度过高将会导致CaSO4的转化率下降,其原因是_______________________ 。
(3)滤渣1成分是_______________ (填化学式)。
(4)加适量H2O2的作用是________________________________ (用离子方程式表示)。“调pH值”除铁和铝时,应调节溶液的pH范围为_________________ 。

已知:①金属离子形成氢氧化物沉淀的pH范围(pH=8.5时Al(OH)3开始溶解)
| 金属离子 | Al3+ | Fe3+ | Fe2+ | Ca2+ |
| 开始沉淀时pH | 3.4 | 2.7 | 7.6 | 11.3 |
| 完全沉淀时pH | 4.7 | 3.7 | 9.6 | / |
②已知常温下,Ksp(CaSO4)=4.8×10-5,Ksp(CaCO3)=3×10-9
回答下列问题:
(1)废渣粉末“浸取”时,主要反应的离子方程式为
(2)废渣粉末“浸取”时,反应温度需控制在60~70℃,合适的加热方式为
(3)滤渣1成分是
(4)加适量H2O2的作用是
您最近一年使用:0次
2020-09-12更新
|
359次组卷
|
3卷引用:安徽省马鞍山市2020届高三毕业班第一次教学质量监测(一模)理科综合化学试题
试卷分析
整体难度:适中
考查范围:化学反应原理、化学实验基础
试卷题型(共 15题)
题型
数量
单选题
12
填空题
1
计算题
1
解答题
1
试卷难度
细目表分析 导出
| 题号 | 难度系数 | 详细知识点 | 备注 |
| 一、单选题 | |||
| 1 | 0.85 | 溶度积定义及表达式 溶度积规则及其应用 溶度积常数相关计算 | |
| 2 | 0.4 | 盐类水解的应用 盐类双水解反应 易水解的盐溶液的配制 盐类水解在生活、生产中的应用 | |
| 3 | 0.65 | 沉淀溶解平衡的应用 难溶电解质溶解平衡定义及特征 | |
| 4 | 0.65 | 影响盐类水解程度的主要因素 盐溶液中微粒间的电荷守恒、物料守恒、质子守恒原理 | |
| 5 | 0.85 | 难溶电解质的溶解平衡 浓度对难溶电解质溶解平衡的影响 同离子效应对难溶电解质溶解平衡的影响 | |
| 6 | 0.65 | 水溶液中水的电离程度及的计算 盐溶液中离子浓度大小的比较 | |
| 7 | 0.65 | 盐溶液中微粒间的电荷守恒、物料守恒、质子守恒原理 盐溶液中离子浓度大小的比较 溶度积 | |
| 8 | 0.65 | 浓度对难溶电解质溶解平衡的影响 | |
| 9 | 0.85 | 沉淀转化 | |
| 10 | 0.4 | 沉淀的溶解与生成 沉淀转化 溶度积常数相关计算 | |
| 11 | 0.85 | 沉淀转化 | |
| 12 | 0.85 | 同离子效应对难溶电解质溶解平衡的影响 沉淀的溶解与生成 | |
| 二、填空题 | |||
| 13 | 0.65 | 盐类双水解反应 盐溶液中微粒间的电荷守恒、物料守恒、质子守恒原理 溶度积 | |
| 三、计算题 | |||
| 14 | 0.65 | 盐溶液中微粒间的电荷守恒、物料守恒、质子守恒原理 溶度积常数相关计算 | |
| 四、解答题 | |||
| 15 | 0.85 | 溶度积规则及其应用 物质分离、提纯的常见化学方法 物质分离、提纯综合应用 常见无机物的制备 | 工业流程题 |



