山东省菏泽市东明县万福中学2021-2022学年高一上学期期中考试化学试题
山东
高一
期中
2022-12-05
110次
整体难度:
适中
考查范围:
化学与STSE、常见无机物及其应用、认识化学科学、化学实验基础
山东省菏泽市东明县万福中学2021-2022学年高一上学期期中考试化学试题
山东
高一
期中
2022-12-05
110次
整体难度:
适中
考查范围:
化学与STSE、常见无机物及其应用、认识化学科学、化学实验基础
一、单选题 添加题型下试题
单选题
|
较易(0.85)
名校
解题方法
1. 化学是一门充满神奇色彩的科学,下列说法错误的是
| A.化学家可以在微观层面操纵分子和原子,组装分子材料 |
| B.化学家制造出自然界中不存在的新物质、新材料满足人们生产生活需求 |
| C.我国科学家发现并合成了青蒿素,说明化学是一门具有创造性的科学 |
| D.法国科学家拉瓦锡提出原子论,为近代化学的发展奠定了坚实的基础 |
【知识点】 化学科学对人类文明发展的意义解读
您最近一年使用:0次
2021-11-13更新
|
220次组卷
|
6卷引用:山东省烟台市、德州市2021—2022学年高一上学期期中考试化学试题
单选题
|
容易(0.94)
名校
解题方法
2. 下列物质的应用错误的是
| A.金属钠可用于冶炼金属钛 | B.活性炭用于杀菌除异味 |
C. 用作漂白剂和消毒剂 用作漂白剂和消毒剂 | D. 用作供氧剂 用作供氧剂 |
您最近一年使用:0次
2021-11-13更新
|
271次组卷
|
4卷引用:山东省烟台市、德州市2021—2022学年高一上学期期中考试化学试题
单选题
|
较易(0.85)
名校
解题方法
4. 下列说法正确的是
| A.混合物均由两种或两种以上的元素组成 |
B.液态 不导电,所以 不导电,所以 不是电解质 不是电解质 |
C.胶体区别于溶液和浊液的本质特征是分散质微粒直径介于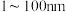 |
| D.盐类物质一定含有金属阳离子 |
您最近一年使用:0次
2021-11-13更新
|
226次组卷
|
4卷引用:山东省烟台市、德州市2021—2022学年高一上学期期中考试化学试题
单选题
|
适中(0.65)
名校
5. 下列有关氧化还原反应的说法正确的是
| A.金属单质在反应中只能做还原剂,非金属单质只能做氧化剂 |
| B.金属阳离子被还原不一定得到金属单质 |
| C.物质中某元素的化合价升高,则该物质只做还原剂 |
| D.有单质参加的反应都是氧化还原反应 |
您最近一年使用:0次
2021-11-13更新
|
236次组卷
|
4卷引用:山东省烟台市、德州市2021—2022学年高一上学期期中考试化学试题
单选题
|
适中(0.65)
名校
6. 食盐是日常生活的必需品,也是重要的化工原料。为除去粗盐中的 、
、 、
、 以及泥沙等杂质,实验方案如下,下列说法错误的是
以及泥沙等杂质,实验方案如下,下列说法错误的是

 、
、 、
、 以及泥沙等杂质,实验方案如下,下列说法错误的是
以及泥沙等杂质,实验方案如下,下列说法错误的是
A.试剂 为 为 溶液,其目的是除溶液中的 溶液,其目的是除溶液中的 |
| B.若先加盐酸再过滤,将对实验结果产生影响 |
| C.粗盐提纯的整个操作过程中共有两处需要使用玻璃棒 |
D.加入试剂 的主要目的是除去 的主要目的是除去 和 和 |
您最近一年使用:0次
2021-11-20更新
|
371次组卷
|
5卷引用:山东省德州市2021-2022学年高一上学期期中考试化学试题
单选题
|
适中(0.65)
名校
7. 用NA代表阿伏加德罗常数的数值,下列说法正确的是
| A.100 mL0.1 mol/L的NaOH溶液中含有氧原子数为0.01NA |
| B.0.1 mol FeCl3·6H2O加入沸水中完全反应生成胶体的粒子数为0.1NA |
| C.标准状况下,2.24 LCO2与足量的Na2O2充分反应,转移电子数为0.2NA |
| D.5.6 g Fe和6.4 g Cu分别与0.1 mol Cl2充分反应,转移电子数均为0.2NA |
您最近一年使用:0次
2021-11-13更新
|
435次组卷
|
7卷引用:山东省烟台市、德州市2021—2022学年高一上学期期中考试化学试题
单选题
|
适中(0.65)
名校
解题方法
8. 下列事实及其解释错误的是
A.氯水可以使有色布条褪色,是因为 具有漂白性 具有漂白性 |
| B.钠保存在煤油中是因为煤油不与钠反应且密度比钠小,可以隔绝空气和水蒸气 |
| C.为增强漂白能力向漂白粉溶液中加入少量白醋,原因是醋酸的酸性比次氯酸强 |
D.向包有 的脱脂棉吹气,脱脂棉燃烧,说明 的脱脂棉吹气,脱脂棉燃烧,说明 、 、 与 与 反应放热且有 反应放热且有 生成 生成 |
您最近一年使用:0次
2021-11-13更新
|
429次组卷
|
6卷引用:山东省烟台市、德州市2021—2022学年高一上学期期中考试化学试题
单选题
|
适中(0.65)
名校
解题方法
9. 下列各组离子在指定溶液中能大量共存的是
A.食盐水中: 、 、 、 、 、 、 |
B.氯化铁溶液中: 、 、 、 、 、 、 |
C.小苏打溶液中: 、 、 、 、 、 、 |
D.“洁厕灵”溶液中: 、 、 、 、 、 、 |
【知识点】 限定条件下的离子共存解读 次氯酸及其性质解读
您最近一年使用:0次
2021-11-13更新
|
305次组卷
|
4卷引用:山东省烟台市、德州市2021—2022学年高一上学期期中考试化学试题
单选题
|
适中(0.65)
名校
解题方法
10. KIO3常用作食盐中的补碘剂,可用“氯酸钾四化法”制备,该方法的第一步反应为6I2+11KC1O3+3H2O=6KH(IO3)2+5KC1+3C12↑。下列说法正确的是
| A.KH(IO3)为还原产物 |
| B.反应中氧化剂和还原剂的物质的量之比为6:11 |
| C.可用澄清石灰水吸收反应产生的Cl2制备漂白粉 |
| D.产生22.4 L(标准状况)Cl2时,转移20 mol e- |
您最近一年使用:0次
2021-12-03更新
|
148次组卷
|
5卷引用:山东省烟台市、德州市2021—2022学年高一上学期期中考试化学试题
二、多选题 添加题型下试题
多选题
|
适中(0.65)
名校
解题方法
11. 为完成下列各组实验,所选玻璃仪器和试剂均准确、完整的是(不考虑存放试剂的容器)
| 实验目的 | 玻璃仪器 | 试剂 | |
| A | 配制 一定物质的量浓度的 一定物质的量浓度的 溶液 溶液 |  容量瓶、烧杯、量筒、玻璃棒 容量瓶、烧杯、量筒、玻璃棒 | 蒸馏水、 固体 固体 |
| B | 制备 胶体 胶体 | 烧杯、酒精灯、胶头滴管 | 蒸馏水、饱和 溶液 溶液 |
| C |  溶液的蒸发结晶 溶液的蒸发结晶 | 酒精灯、玻璃棒、坩埚 |  溶液 溶液 |
| D | 验证 具有还原性 具有还原性 | 试管、胶头滴管 | 酸性 溶液、 溶液、 溶液 溶液 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2021-11-13更新
|
333次组卷
|
4卷引用:山东省烟台市、德州市2021—2022学年高一上学期期中考试化学试题
多选题
|
适中(0.65)
名校
解题方法
12. 下列物质的鉴别方法错误的是
| A.用NaOH溶液鉴别MgCl2溶液、CuCl2溶液、FeCl3溶液 |
| B.用澄清石灰水鉴别Na2CO3溶液和NaHCO3溶液 |
| C.用CO2鉴别NaCl溶液和CaCl2溶液 |
| D.用丁达尔现象鉴别淀粉溶液和NaCl溶液 |
【知识点】 胶体的性质和应用解读 碳酸钠与碳酸氢钠性质的比较解读 物质的检验
您最近一年使用:0次
2021-12-03更新
|
140次组卷
|
4卷引用:山东省烟台市、德州市2021—2022学年高一上学期期中考试化学试题
三、单选题 添加题型下试题
单选题
|
适中(0.65)
名校
13.  、
、 为两种强酸。同温同压下,
为两种强酸。同温同压下,

 的
的 溶液与足量锌粒反应,生成
溶液与足量锌粒反应,生成 体积为V1L;
体积为V1L;

 的
的 溶液与足量锌粒反应,生成
溶液与足量锌粒反应,生成 体积为V2L。下列说法正确的是
体积为V2L。下列说法正确的是
 、
、 为两种强酸。同温同压下,
为两种强酸。同温同压下,

 的
的 溶液与足量锌粒反应,生成
溶液与足量锌粒反应,生成 体积为V1L;
体积为V1L;

 的
的 溶液与足量锌粒反应,生成
溶液与足量锌粒反应,生成 体积为V2L。下列说法正确的是
体积为V2L。下列说法正确的是A. 、 、 生成 生成 的物质的量之比一定为 的物质的量之比一定为 |
B.锌粒消耗 、 、 的物质的量之比一定为 的物质的量之比一定为 |
C. 、 、 的浓度之比 的浓度之比 一定等于 一定等于 |
D.由 一定能确定 一定能确定 、 、 对应酸根离子的化合价 对应酸根离子的化合价 |
【知识点】 阿伏加德罗定律 物质的量有关计算 化学方程式计算中物质的量的运用解读
您最近一年使用:0次
2021-11-13更新
|
274次组卷
|
6卷引用:山东省烟台市、德州市2021—2022学年高一上学期期中考试化学试题
四、多选题 添加题型下试题
多选题
|
适中(0.65)
名校
解题方法
14. 某兴趣小组用下列装置探究Na与CO2的反应产物,已知 。下列说法正确的是
。下列说法正确的是
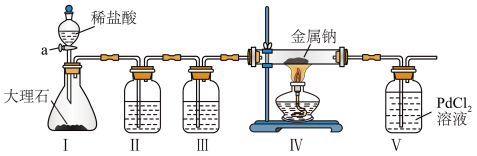
 。下列说法正确的是
。下列说法正确的是
| A.为了避免生成的CO2中混有HCl,最好用稀硫酸代替稀盐酸 |
| B.装置Ⅲ的目的是除去HCl |
| C.实验时先打开活塞a,再点燃酒精灯 |
D.装置Ⅴ出现黑色沉淀,则装置Ⅳ发生反应 |
【知识点】 钠的化学性质 物质分离、提纯的常见化学方法解读 碳元素及其化合物
您最近一年使用:0次
2021-11-13更新
|
447次组卷
|
8卷引用:山东省烟台市、德州市2021—2022学年高一上学期期中考试化学试题
多选题
|
较难(0.4)
名校
15. 在两份相同的 溶液中,分别滴入物质的量浓度相等的
溶液中,分别滴入物质的量浓度相等的 、
、 溶液,其导电能力随滴入溶液体积变化的曲线如图所示。下列说法正确的是
溶液,其导电能力随滴入溶液体积变化的曲线如图所示。下列说法正确的是

 溶液中,分别滴入物质的量浓度相等的
溶液中,分别滴入物质的量浓度相等的 、
、 溶液,其导电能力随滴入溶液体积变化的曲线如图所示。下列说法正确的是
溶液,其导电能力随滴入溶液体积变化的曲线如图所示。下列说法正确的是
A.①代表滴加 溶液的变化曲线 溶液的变化曲线 |
B.a处溶液的导电能力几乎为0,所以 是非电解质 是非电解质 |
C.c点两溶液中 的物质的量关系:① 的物质的量关系:① ② ② |
D.b~d的离子方程式为 |
您最近一年使用:0次
2021-11-13更新
|
669次组卷
|
4卷引用:山东省烟台市、德州市2021—2022学年高一上学期期中考试化学试题
五、解答题 添加题型下试题
解答题-实验探究题
|
适中(0.65)
名校
解题方法
16. 实验室需
 的稀硫酸,现用98%的浓硫酸(
的稀硫酸,现用98%的浓硫酸(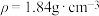 )进行配制。请回答下列问题:
)进行配制。请回答下列问题:
(1)盛浓硫酸的试剂瓶标签上印有下列危险化学品标志中的___________(填字母)。
(2)所需浓硫酸的体积为___________  ;如果实验室有
;如果实验室有 、
、 、
、 、
、 的量筒,应选用
的量筒,应选用___________  的量筒。
的量筒。
(3)取用任意体积的该稀硫酸,下列物理量中不随所取体积的多少而变化的是___________(填字母)。
(4)将 步骤补充完整,配制时正确的操作顺序是
步骤补充完整,配制时正确的操作顺序是___________ (用字母表示)。
A.用适量蒸馏水洗涤烧杯及玻璃棒2~3次,洗涤液均注入容量瓶
B.用量筒量取所需浓硫酸,沿烧杯内壁缓慢注入盛有少量蒸馏水的烧杯中,用玻璃棒不断搅拌,使其混合均匀
C.将已冷却的稀硫酸沿玻璃棒注入 的容量瓶中
的容量瓶中
D.将容量瓶盖紧,反复上下颠倒,摇匀
E.继续往容量瓶内小心地加蒸馏水,使液面接近瓶颈上的刻度线1~2cm,___________ 。
(5)下列操作造成配制的溶液浓度偏小的是___________ (填字母)。
A.溶解浓硫酸后未冷却直接转移溶液 B.容量瓶洗涤后残留少量的蒸馏水
C.所用过的烧杯、玻璃棒未洗涤 D.用量筒量取浓硫酸时俯视刻度
E.用蒸馏水洗净量筒后直接量取浓硫酸配制溶液
(6)若实验过程中加蒸馏水时不慎超过了刻度线,该如何处理?___________ 。

 的稀硫酸,现用98%的浓硫酸(
的稀硫酸,现用98%的浓硫酸(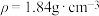 )进行配制。请回答下列问题:
)进行配制。请回答下列问题:(1)盛浓硫酸的试剂瓶标签上印有下列危险化学品标志中的___________(填字母)。
A. | B. | C. | D. |
 ;如果实验室有
;如果实验室有 、
、 、
、 、
、 的量筒,应选用
的量筒,应选用 的量筒。
的量筒。(3)取用任意体积的该稀硫酸,下列物理量中不随所取体积的多少而变化的是___________(填字母)。
A.溶液中 的物质的量 的物质的量 | B.溶液的浓度 |
C.溶液中 的数目 的数目 | D.溶液的密度 |
 步骤补充完整,配制时正确的操作顺序是
步骤补充完整,配制时正确的操作顺序是A.用适量蒸馏水洗涤烧杯及玻璃棒2~3次,洗涤液均注入容量瓶
B.用量筒量取所需浓硫酸,沿烧杯内壁缓慢注入盛有少量蒸馏水的烧杯中,用玻璃棒不断搅拌,使其混合均匀
C.将已冷却的稀硫酸沿玻璃棒注入
 的容量瓶中
的容量瓶中D.将容量瓶盖紧,反复上下颠倒,摇匀
E.继续往容量瓶内小心地加蒸馏水,使液面接近瓶颈上的刻度线1~2cm,
(5)下列操作造成配制的溶液浓度偏小的是
A.溶解浓硫酸后未冷却直接转移溶液 B.容量瓶洗涤后残留少量的蒸馏水
C.所用过的烧杯、玻璃棒未洗涤 D.用量筒量取浓硫酸时俯视刻度
E.用蒸馏水洗净量筒后直接量取浓硫酸配制溶液
(6)若实验过程中加蒸馏水时不慎超过了刻度线,该如何处理?
您最近一年使用:0次
2021-11-13更新
|
253次组卷
|
5卷引用:山东省烟台市、德州市2021—2022学年高一上学期期中考试化学试题
六、填空题 添加题型下试题
填空题
|
适中(0.65)
名校
解题方法
17. 1774年,舍勒在研究软锰矿(主要成分是 )的过程中,将它与浓盐酸混合加热,产生了一种黄绿色气体。1810年,戴维确认这是一种新元素组成的单质,并命名为Chlorine(中文命名“氯气”)。
)的过程中,将它与浓盐酸混合加热,产生了一种黄绿色气体。1810年,戴维确认这是一种新元素组成的单质,并命名为Chlorine(中文命名“氯气”)。
(1)实验室沿用舍勒的方法制取 的化学方程式为
的化学方程式为___________ 。
(2)实验室中用 溶液吸收尾气中的
溶液吸收尾气中的 的离子方程式为
的离子方程式为___________ ,配制 的
的 溶液
溶液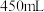 ,所需
,所需 固体的质量为
固体的质量为___________ 。
(3)用 可制备
可制备 溶液,将
溶液,将 溶液加入到滴有酚酞的
溶液加入到滴有酚酞的 溶液中,观察到溶液红色褪去。溶液褪色的原因可能是①
溶液中,观察到溶液红色褪去。溶液褪色的原因可能是① 被
被 中和,②
中和,②___________ 。设计实验探究溶液红色褪去的原因___________ 。
(4) 溶液不能长久存放的原因是
溶液不能长久存放的原因是___________ (用化学方程式表示),检验长久存放的 溶液中阴离子的实验操作及现象是
溶液中阴离子的实验操作及现象是___________ 。
 )的过程中,将它与浓盐酸混合加热,产生了一种黄绿色气体。1810年,戴维确认这是一种新元素组成的单质,并命名为Chlorine(中文命名“氯气”)。
)的过程中,将它与浓盐酸混合加热,产生了一种黄绿色气体。1810年,戴维确认这是一种新元素组成的单质,并命名为Chlorine(中文命名“氯气”)。(1)实验室沿用舍勒的方法制取
 的化学方程式为
的化学方程式为(2)实验室中用
 溶液吸收尾气中的
溶液吸收尾气中的 的离子方程式为
的离子方程式为 的
的 溶液
溶液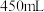 ,所需
,所需 固体的质量为
固体的质量为(3)用
 可制备
可制备 溶液,将
溶液,将 溶液加入到滴有酚酞的
溶液加入到滴有酚酞的 溶液中,观察到溶液红色褪去。溶液褪色的原因可能是①
溶液中,观察到溶液红色褪去。溶液褪色的原因可能是① 被
被 中和,②
中和,②(4)
 溶液不能长久存放的原因是
溶液不能长久存放的原因是 溶液中阴离子的实验操作及现象是
溶液中阴离子的实验操作及现象是
您最近一年使用:0次
2021-11-13更新
|
248次组卷
|
5卷引用:山东省烟台市、德州市2021—2022学年高一上学期期中考试化学试题
七、解答题 添加题型下试题
解答题-实验探究题
|
适中(0.65)
名校
18.  常用于医药、印染、漂白及分析试剂等。某兴趣小组利用下列装置(夹持仪器省略),用金属钠和空气来制备
常用于医药、印染、漂白及分析试剂等。某兴趣小组利用下列装置(夹持仪器省略),用金属钠和空气来制备 (不考虑空气中
(不考虑空气中 与
与 反应)。
反应)。
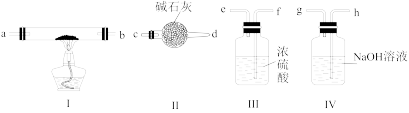
(1)若规定气流的方向为从左到右,各仪器连接的接口顺序(每个装置只用一次)是:空气→_______→_______→______→_____→______→_____→_____(填字母),_____ 。
(2)装置II的作用是___ ;若没有装置Ⅳ可能导致生成的 中含有
中含有___ (填化学式)。
(3)该小组同学称取ag所制备的 样品,利用下列装置测定
样品,利用下列装置测定 样品的纯度(夹持仪器省略)。
样品的纯度(夹持仪器省略)。
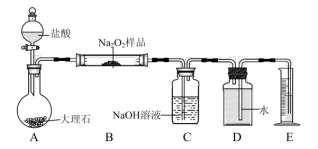
①仪器连接好后的第一步操作是___________ 。
②有同学提出该实验装置存在缺陷,应该在A、B装置之间增加一个盛有饱和 溶液的洗气瓶,该同学想法是否必要?
溶液的洗气瓶,该同学想法是否必要?_______ (填“是”或“否”),理由是_______ 。
③读出量筒内水的体积后,折算成标准状况下 的体积为V
的体积为V ,计算样品中
,计算样品中 的质量分数约为
的质量分数约为___________ %。
④实验完成后D到E之间导管内残留水的体积会使测量结果_______ (填“偏大”“偏小”或“不影响”)。
 常用于医药、印染、漂白及分析试剂等。某兴趣小组利用下列装置(夹持仪器省略),用金属钠和空气来制备
常用于医药、印染、漂白及分析试剂等。某兴趣小组利用下列装置(夹持仪器省略),用金属钠和空气来制备 (不考虑空气中
(不考虑空气中 与
与 反应)。
反应)。
(1)若规定气流的方向为从左到右,各仪器连接的接口顺序(每个装置只用一次)是:空气→_______→_______→______→_____→______→_____→_____(填字母),
(2)装置II的作用是
 中含有
中含有(3)该小组同学称取ag所制备的
 样品,利用下列装置测定
样品,利用下列装置测定 样品的纯度(夹持仪器省略)。
样品的纯度(夹持仪器省略)。
①仪器连接好后的第一步操作是
②有同学提出该实验装置存在缺陷,应该在A、B装置之间增加一个盛有饱和
 溶液的洗气瓶,该同学想法是否必要?
溶液的洗气瓶,该同学想法是否必要?③读出量筒内水的体积后,折算成标准状况下
 的体积为V
的体积为V ,计算样品中
,计算样品中 的质量分数约为
的质量分数约为④实验完成后D到E之间导管内残留水的体积会使测量结果
您最近一年使用:0次
2021-11-13更新
|
419次组卷
|
5卷引用:山东省烟台市、德州市2021—2022学年高一上学期期中考试化学试题
解答题-工业流程题
|
适中(0.65)
名校
解题方法
19.  微溶于水,不潮解,相对稳定,是一种无机抗菌剂,以菱镁矿(
微溶于水,不潮解,相对稳定,是一种无机抗菌剂,以菱镁矿( ,含少量
,含少量 )为主要原料制备
)为主要原料制备 的工业流程如图,请回答下列问题:
的工业流程如图,请回答下列问题:
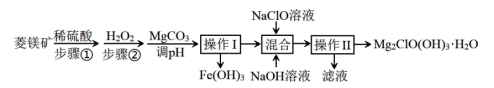
(1) 中氯元素的化合价为
中氯元素的化合价为___________ ,该物质所属物质类别为___________ 。
(2) 在酸性溶液中具有杀菌、漂白作用,其原因是
在酸性溶液中具有杀菌、漂白作用,其原因是___________ (用离子方程式解释)。
(3)步骤②不能在较高温度下进行,可能的原因是___________ , 的作用是
的作用是___________ (用离子方程式表示)。
(4)操作I所用的玻璃仪器有___________ 。
(5)混合时发生反应的离子方程式为___________ 。
 微溶于水,不潮解,相对稳定,是一种无机抗菌剂,以菱镁矿(
微溶于水,不潮解,相对稳定,是一种无机抗菌剂,以菱镁矿( ,含少量
,含少量 )为主要原料制备
)为主要原料制备 的工业流程如图,请回答下列问题:
的工业流程如图,请回答下列问题:
(1)
 中氯元素的化合价为
中氯元素的化合价为(2)
 在酸性溶液中具有杀菌、漂白作用,其原因是
在酸性溶液中具有杀菌、漂白作用,其原因是(3)步骤②不能在较高温度下进行,可能的原因是
 的作用是
的作用是(4)操作I所用的玻璃仪器有
(5)混合时发生反应的离子方程式为
您最近一年使用:0次
2021-11-15更新
|
381次组卷
|
6卷引用:山东省烟台市、德州市2021—2022学年高一上学期期中考试化学试题
解答题-实验探究题
|
适中(0.65)
名校
解题方法
20.  又称次氯酸酐,是强氧化剂,极易溶于水,沸点为
又称次氯酸酐,是强氧化剂,极易溶于水,沸点为 ℃,42℃以上分解为
℃,42℃以上分解为 和
和 ,高浓度时易爆炸。某学习小组利用
,高浓度时易爆炸。某学习小组利用 和潮湿的碳酸钠反应生成
和潮湿的碳酸钠反应生成 ,再用水吸收
,再用水吸收 制备
制备 溶液,装置如下,请回答下列问题:
溶液,装置如下,请回答下列问题:
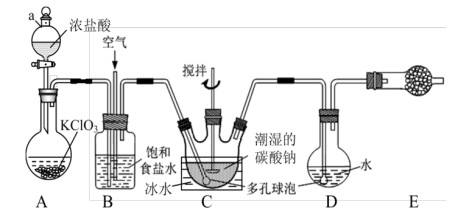
(1)仪器a的名称是___________ ,A中发生反应的离子方程式为___________ 。
(2)实验中须控制 与空气(不参与反应)的体积比为
与空气(不参与反应)的体积比为 ,装置B的作用是
,装置B的作用是___________ (答出两条即可)。
(3)装置C中生成 、
、 ,反应的化学方程式为
,反应的化学方程式为___________ ,为使反应充分进行,实验中采取的措施有___________ 。
(4)若装置C不冷却,则进入装置D中的 会大量减少,可能的原因是
会大量减少,可能的原因是___________ 。
(5)装置E所盛试剂是___________ ,作用是___________ 。
 又称次氯酸酐,是强氧化剂,极易溶于水,沸点为
又称次氯酸酐,是强氧化剂,极易溶于水,沸点为 ℃,42℃以上分解为
℃,42℃以上分解为 和
和 ,高浓度时易爆炸。某学习小组利用
,高浓度时易爆炸。某学习小组利用 和潮湿的碳酸钠反应生成
和潮湿的碳酸钠反应生成 ,再用水吸收
,再用水吸收 制备
制备 溶液,装置如下,请回答下列问题:
溶液,装置如下,请回答下列问题:
(1)仪器a的名称是
(2)实验中须控制
 与空气(不参与反应)的体积比为
与空气(不参与反应)的体积比为 ,装置B的作用是
,装置B的作用是(3)装置C中生成
 、
、 ,反应的化学方程式为
,反应的化学方程式为(4)若装置C不冷却,则进入装置D中的
 会大量减少,可能的原因是
会大量减少,可能的原因是(5)装置E所盛试剂是
您最近一年使用:0次
2021-11-13更新
|
433次组卷
|
6卷引用:山东省烟台市、德州市2021—2022学年高一上学期期中考试化学试题
试卷分析
整体难度:适中
考查范围:化学与STSE、常见无机物及其应用、认识化学科学、化学实验基础
试卷题型(共 20题)
题型
数量
单选题
11
多选题
4
解答题
4
填空题
1
试卷难度
知识点分析
细目表分析 导出
| 题号 | 难度系数 | 详细知识点 | 备注 |
| 一、单选题 | |||
| 1 | 0.85 | 化学科学对人类文明发展的意义 | |
| 2 | 0.94 | 钠单质的保存与用途 过氧化钠的物理性质、组成、结构及用途 | |
| 3 | 0.85 | 电离方程式 离子方程式的书写 氧化还原反应定义、本质及特征 氧化还原反应的应用 | |
| 4 | 0.85 | 酸、碱、盐、氧化物的概念及其相互联系 胶体的定义及分类 非电解质、电解质物质类别判断 | |
| 5 | 0.65 | 氧化还原反应的几组概念 氧化还原反应定义、本质及特征 氧化还原反应的规律 | |
| 6 | 0.65 | 离子反应在混合物分离、除杂中的应用 物质分离、提纯的常见化学方法 | |
| 7 | 0.65 | 胶体的制备 结合氧化还原反应知识与NA相关推算 氯气与金属单质的反应 过氧化钠和二氧化碳反应 | |
| 8 | 0.65 | 次氯酸及其性质 漂白粉和漂粉精 钠单质的保存与用途 过氧化钠 | |
| 9 | 0.65 | 限定条件下的离子共存 次氯酸及其性质 | |
| 10 | 0.65 | 氧化还原反应的应用 氧化还原反应有关计算 漂白粉和漂粉精的制备原理 电子转移计算 | |
| 13 | 0.65 | 阿伏加德罗定律 物质的量有关计算 化学方程式计算中物质的量的运用 | |
| 二、多选题 | |||
| 11 | 0.65 | 氧化还原反应的应用 仪器使用与实验安全 一定物质的量浓度的溶液的配制 常用仪器及使用 | |
| 12 | 0.65 | 胶体的性质和应用 碳酸钠与碳酸氢钠性质的比较 物质的检验 | |
| 14 | 0.65 | 钠的化学性质 物质分离、提纯的常见化学方法 碳元素及其化合物 | |
| 15 | 0.4 | 非电解质、电解质物质类别判断 物质水溶液的导电性 离子反应的实际应用 | |
| 三、解答题 | |||
| 16 | 0.65 | 一定物质的量浓度的溶液的配制 配制一定物质的量浓度溶液的综合考查 | 实验探究题 |
| 18 | 0.65 | 钠与氧气等非金属的反应 过氧化钠 探究物质组成或测量物质的含量 物质制备的探究 | 实验探究题 |
| 19 | 0.65 | 氧化还原反应方程式的配平 次氯酸及其性质 物质分离、提纯综合应用 常见无机物的制备 | 工业流程题 |
| 20 | 0.65 | 氯气的化学性质 氯气的实验室制法 物质制备的探究 | 实验探究题 |
| 四、填空题 | |||
| 17 | 0.65 | 次氯酸及其性质 氯气的化学性质 氯气的实验室制法 物质性质的探究 | |

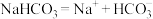
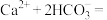 CaCO3↓+CO2↑+H2O
CaCO3↓+CO2↑+H2O

