北京市中国人民大学附属中学2017-2018学年高三上学期12月月考化学试题
北京
高三
阶段练习
2023-05-04
262次
整体难度:
适中
考查范围:
认识化学科学、化学反应原理、有机化学基础、常见无机物及其应用、化学实验基础、物质结构与性质
北京市中国人民大学附属中学2017-2018学年高三上学期12月月考化学试题
北京
高三
阶段练习
2023-05-04
262次
整体难度:
适中
考查范围:
认识化学科学、化学反应原理、有机化学基础、常见无机物及其应用、化学实验基础、物质结构与性质
一、单选题 添加题型下试题
单选题
|
较易(0.85)
名校
1. 下列生活中常用的食物储存方法中,所加物质不与氧气反应的是
A.用浸泡过高锰酸钾溶液的纸张保鲜水果 |
B.食用油中添加TBHQ(一种酚类物质) |
C.红酒中添加一定的SO2 |
D.食品包装袋中放还原铁粉 |
【知识点】 氧化还原反应基本概念
您最近一年使用:0次
2017-04-03更新
|
86次组卷
|
2卷引用:2017届北京市朝阳区高三第一次(3月)综合练习理综化学试卷
单选题
|
适中(0.65)
名校
2. 对下列化学用语的理解和描述均正确的是
A.电子式 可以表示羟基,也可以表示氢氧根离子 可以表示羟基,也可以表示氢氧根离子 |
B.比例模型 可以表示二氧化碳分子,也可以表示水分子 可以表示二氧化碳分子,也可以表示水分子 |
C.结构示意图为 的阴离子都不能破坏水的电离平衡 的阴离子都不能破坏水的电离平衡 |
D.原子结构示意图 可以表示12C,也可以表示14C 可以表示12C,也可以表示14C |
您最近一年使用:0次
2016-12-09更新
|
243次组卷
|
2卷引用:2015届宁夏银川市第九中学高三上学期第三次月考理综试卷
单选题
|
适中(0.65)
名校
解题方法
3. NH3催化还原NO是重要的烟气脱硝技术,其反应过程与能量关系如图;研究发现在以Fe2O3为主的催化剂上可能发生的反应过程如图.下列说法正确的是 ( )

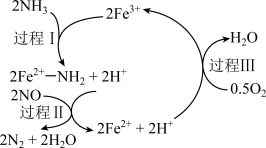
| A.NH3催化还原NO为吸热反应 |
| B.过程Ⅰ中NH3断裂非极性键 |
| C.过程Ⅱ中NO为氧化剂,Fe2+为还原剂 |
D.脱硝的总反应为: 4NH3(g)+4NO(g)+ O2(g)  4N2(g)+6H2O(g) 4N2(g)+6H2O(g) |
您最近一年使用:0次
2019-11-28更新
|
1337次组卷
|
18卷引用:辽宁省葫芦岛市2016-2017学年高二下学期期末质量监测化学试题
辽宁省葫芦岛市2016-2017学年高二下学期期末质量监测化学试题吉林省德惠市实验中学、前郭五中等九校2020届高三上学期期中考试化学试题甘肃省天水市甘谷第一中学2020届高三上学期第四次检测考试化学试题河北省衡水市深州市长江中学2020届高三上学期12月月考化学试题2020届高考化学知识点必练——氧化还原反应的本质及相关概念河南省洛阳市第一高级中学2021届高三上学期10月月考化学试题浙江省舟山市2021届高考第二次模拟考试化学试题云南省玉溪市一中2020-2021学年高二下学期期中考试化学试题(已下线)考点20 化学能与热能-备战2022年高考化学一轮复习考点帮(浙江专用)(已下线)第15讲 化学反应的热效应(练) — 2022年高考化学一轮复习讲练测(新教材新高考)(已下线)专题10 化学反应机理分析-【微专题·大素养】备战2022年高考化学讲透提分要点(已下线)第14周 晚练题-备战2022年高考化学周测与晚练(新高考专用)重庆市名校联盟2021-2022学年高三下学期第一次联合考试化学试题福建省连城县第一中学2022-2023学年高二上学期月考(一)化学试题江苏省海安市实验中学2022-2023学年高一第一次月考化学试题北京市中国人民大学附属中学2017-2018学年高三上学期12月月考化学试题江苏省南京市六校联合体2022-2023学年高一下学期5月期中考试化学试题江苏省连云港市灌南县两校联考2023-2024学年高一下学期3月月考化学试题
单选题
|
适中(0.65)
名校
解题方法
4. 迷迭香酸是从蜂花属植物中提取得到的酸性物质,其结构如图

下列叙述正确的是

下列叙述正确的是
| A.迷迭香酸属于芳香烃 |
| B.1 mol迷迭香酸最多能和9 mol氢气发生加成反应 |
| C.迷迭香酸可以发生水解反应,取代反应和酯化反应 |
| D.1 mol迷迭香酸最多能和含5 mol NaOH的水溶液完全反应 |
您最近一年使用:0次
2020-02-10更新
|
74次组卷
|
2卷引用:2019-2020学年人教版高中化学高考基础复习专题11《化学实验热点》测试卷
单选题
|
适中(0.65)
名校
解题方法
5. 实验室用如图装置制备HCl气体。推压注射器活塞将浓盐酸慢慢注入到浓硫酸中,可制备少量干燥HCl气体,其原理分析不正确的是


| A.混合时放热使HCl溶解度减小 |
| B.浓硫酸具有吸水性,吸收了盐酸中水分 |
| C.浓盐酸具有挥发性,利于HCl气体逸出 |
| D.浓盐酸中HCl以分子形式存在,利于HCl气体逸出 |
您最近一年使用:0次
单选题
|
适中(0.65)
名校
解题方法
6. 将标准状况下的22.4L SO2通入4mol NaOH溶液中,下列用来解释事实的方程式中不合理的是(已知室温下饱和Na2SO3溶液的pH约为8.3)
A.标准状况下的22.4L SO2通入含4mol NaOH的溶液:2OH-+SO2=SO +H2O +H2O |
B.上述反应后所得溶液的pH约为12:SO +H2O +H2O HSO HSO +OH- +OH- |
C.向上述反应后所得溶液中,通入氯气,pH下降:SO +Cl2+2OH-=SO +Cl2+2OH-=SO +2Cl-+H2O +2Cl-+H2O |
D.向上述反应后所得溶液中,滴加少量H2O2和BaCl2溶液的混合液,产生白色沉淀:SO +Ba2++H2O2=BaSO4↓+H2O +Ba2++H2O2=BaSO4↓+H2O |
您最近一年使用:0次
2023-04-21更新
|
244次组卷
|
2卷引用:北京市中国人民大学附属中学2017-2018学年高三上学期12月月考化学试题
单选题
|
适中(0.65)
名校
7. 早在1807年化学家戴维用电解熔融氢氧化钠制得钠,反应原理为4NaOH(熔融) 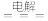 4Na+O2↑+2H2O;后来盖·吕萨克用铁与熔融氢氧化钠作用也制得钠,反应原理为3Fe+4NaOH
4Na+O2↑+2H2O;后来盖·吕萨克用铁与熔融氢氧化钠作用也制得钠,反应原理为3Fe+4NaOH Fe3O4+2H2↑+4Na↑。下列有关说法正确的是
Fe3O4+2H2↑+4Na↑。下列有关说法正确的是
 4Na+O2↑+2H2O;后来盖·吕萨克用铁与熔融氢氧化钠作用也制得钠,反应原理为3Fe+4NaOH
4Na+O2↑+2H2O;后来盖·吕萨克用铁与熔融氢氧化钠作用也制得钠,反应原理为3Fe+4NaOH Fe3O4+2H2↑+4Na↑。下列有关说法正确的是
Fe3O4+2H2↑+4Na↑。下列有关说法正确的是
| A.电解熔融氢氧化钠制钠,阳极发生电极反应为Na++e-===Na |
| B.盖·吕萨克法制钠原理是利用铁的还原性比钠强 |
| C.若戴维法与盖·吕萨克法制得等量的钠,则两反应中转移的电子总数比为2∶1 |
| D.目前工业上常用电解熔融氯化钠法制钠(如图),电解槽中石墨极为阳极,铁为阴极 |
您最近一年使用:0次
2016-04-29更新
|
224次组卷
|
8卷引用:2016届湖南省四县高三下学期3月联考理综化学试卷
二、解答题 添加题型下试题
解答题-有机推断题
|
适中(0.65)
名校
解题方法
8. 环扁桃酯是用于治疗心脑血管疾病的重要化合物,它的一种合成路线如下。

已知:RX R-MgX
R-MgX (R、R’、R”代表烃基或氢)
(R、R’、R”代表烃基或氢)
(1)A 的结构简式是___________________
(2)B → D 的化学方程式是________________
(3)红外吸收光谱表明 E 有 C=O 键。 F 的分子式为 C8H6Cl2O 。
①E 的结构简式是________
②E → F 的反应类型是________
(4)X 的结构简式是________
(5)试剂 a 是________
(6)生成环扁桃酯的化学方程式是________
(7)以 CH3CH=CH 2、 CH3CHO 为有机原料, 结合题目所给信息 ,选用必要的无机试剂合成 CH2=CHCH=CHCH3,写出合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)_______

已知:RX
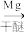 R-MgX
R-MgX (R、R’、R”代表烃基或氢)
(R、R’、R”代表烃基或氢)(1)A 的结构简式是
(2)B → D 的化学方程式是
(3)红外吸收光谱表明 E 有 C=O 键。 F 的分子式为 C8H6Cl2O 。
①E 的结构简式是
②E → F 的反应类型是
(4)X 的结构简式是
(5)试剂 a 是
(6)生成环扁桃酯的化学方程式是
(7)以 CH3CH=CH 2、 CH3CHO 为有机原料, 结合题目所给信息 ,选用必要的无机试剂合成 CH2=CHCH=CHCH3,写出合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)
您最近一年使用:0次
2019-11-07更新
|
268次组卷
|
5卷引用:【新东方】高中化学5006
(已下线)【新东方】高中化学5006江西省安远县第一中学2020届高三上学期第三次月考化学试题(已下线)《2020年新高考政策解读与配套资源》模拟试题08-2020年北京新高考化学模拟试题陕西省延安市吴起高级中学2019-2020学年高二下学期第四次质量检测(期末)化学试题北京市中国人民大学附属中学2017-2018学年高三上学期12月月考化学试题
三、填空题 添加题型下试题
填空题
|
较难(0.4)
名校
9. 综合利用CO2对环境保护及能开发意义重大。
(1)Li2O、Na2O、MgO均能吸收CO2。如果寻找吸收CO2的其他物质,下列建议合理的是______ 。
a.可在碱性氧化物中寻找
b.可在ⅠA、ⅡA族元素形成的氧化物中寻找
c.可在具有强氧化性的物质中寻找
(2)Li2O吸收CO2后,产物用于合成Li4SiO4,Li4SiO4用于吸收、释放CO2。原理是:在500℃,CO2与Li4SiO4接触后生成Li2CO3;平衡后加热至700℃,反应逆向进行,放出CO2,Li4SiO4再生,说明该原理的化学方程式是______ 。
(3)利用反应A可将释放的CO2转化为具有工业利用价值的产品。
反应A: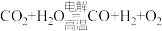
已知:

反应A的热化学方程式是_______ 。
(4)高温电解技术能高效实现(3)中反应A,工作原理示意图如下:
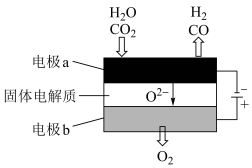
① 电极b发生_______ (填“氧化”或“还原”)反应。
② CO2在电极a放电的反应式是______ 。
(5)CO与H2在高温下合成C5H12(汽油的一种成分)减少碳排放。已知燃烧1 mol C5H12(g)生成H2O(g)放出约3540 kJ的热量。根据化学平衡原理,说明提高合成C5H12的产率可采取的措施是______ 。
(1)Li2O、Na2O、MgO均能吸收CO2。如果寻找吸收CO2的其他物质,下列建议合理的是
a.可在碱性氧化物中寻找
b.可在ⅠA、ⅡA族元素形成的氧化物中寻找
c.可在具有强氧化性的物质中寻找
(2)Li2O吸收CO2后,产物用于合成Li4SiO4,Li4SiO4用于吸收、释放CO2。原理是:在500℃,CO2与Li4SiO4接触后生成Li2CO3;平衡后加热至700℃,反应逆向进行,放出CO2,Li4SiO4再生,说明该原理的化学方程式是
(3)利用反应A可将释放的CO2转化为具有工业利用价值的产品。
反应A:
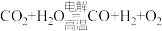
已知:

反应A的热化学方程式是
(4)高温电解技术能高效实现(3)中反应A,工作原理示意图如下:

① 电极b发生
② CO2在电极a放电的反应式是
(5)CO与H2在高温下合成C5H12(汽油的一种成分)减少碳排放。已知燃烧1 mol C5H12(g)生成H2O(g)放出约3540 kJ的热量。根据化学平衡原理,说明提高合成C5H12的产率可采取的措施是
您最近一年使用:0次
2016-12-09更新
|
481次组卷
|
2卷引用:2015届北京市清华大学附属中学高三3月综合测(二)化学试卷
四、解答题 添加题型下试题
解答题-工业流程题
|
适中(0.65)
名校
解题方法
10. 草酸钴用途广泛,可用于指示剂和催化剂制备。一种利用水钴矿[主要成分为Co2O3,含少量Fe2O3、Al2O3、MnO、MgO、CaO等]制取CoC2O4•2H2O工艺流程如图1。

已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Ca2+、Mg2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
(1)浸出过程中加入Na2SO3的目的是将___________ 还原。(填离子符号)
(2)NaClO3的作用是将浸出液中的Fe2+氧化成Fe3+,产物中氯元素处于最低化合价。该反应的离子方程式为___________ 。
(3)加入Na2CO3调pH=5.2时,所得沉淀的成分为___________
(4)萃取剂对金属离子的萃取率与pH的关系如图2所示。滤液Ⅱ中加入萃取剂的作用是___________ ;使用萃取剂适宜的pH是___________ 。

A.2.0~2.5 B.3.0~3.5 C.4.0~4.5 D.5.0~5.5
(5)“除钙、镁”是将溶液中Ca2+与Mg2+转化为MgF2、CaF2沉淀。已知Ksp(MgF2)=7.35×10-11、Ksp(CaF2)=1.05×10-10.当加入过量NaF后,所得滤液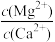 =
=___________ 。

已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Ca2+、Mg2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 完全沉淀的pH | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
(1)浸出过程中加入Na2SO3的目的是将
(2)NaClO3的作用是将浸出液中的Fe2+氧化成Fe3+,产物中氯元素处于最低化合价。该反应的离子方程式为
(3)加入Na2CO3调pH=5.2时,所得沉淀的成分为
(4)萃取剂对金属离子的萃取率与pH的关系如图2所示。滤液Ⅱ中加入萃取剂的作用是

A.2.0~2.5 B.3.0~3.5 C.4.0~4.5 D.5.0~5.5
(5)“除钙、镁”是将溶液中Ca2+与Mg2+转化为MgF2、CaF2沉淀。已知Ksp(MgF2)=7.35×10-11、Ksp(CaF2)=1.05×10-10.当加入过量NaF后,所得滤液
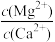 =
=
您最近一年使用:0次
解答题-实验探究题
|
适中(0.65)
名校
解题方法
11. 以Mg和不同盐溶液间的反应为实验对象,探究Mg与盐溶液反应的多样性。
(1)对实验Ⅰ进行研究:
①推测实验Ⅰ中黑色固体为Ag,则发生反应的离子方程式为___________ 。
②确认黑色固体为Ag的实验方案是___________ 。
(2)对实验Ⅱ进行研究:
①反应开始时产生H2的原因可能是:
ⅰ.___________ 。
ⅱ.Mg和NH 直接反应。
直接反应。
②“一段时间后”产生的气体一定含有___________ 。
③为进一步研究NH4Cl溶液的作用,设计如下实验:
结合实验Ⅱ、Ⅳ、Ⅴ可以得出的结论是___________ 。
(3)对实验Ⅲ进行研究:
①推测在pH=8.2的该溶液中,若无HCO ,则H+和Mg反应的程度很小。通过实验证实了该推测,其方案是
,则H+和Mg反应的程度很小。通过实验证实了该推测,其方案是___________ 。
②经检验,白色晶体为碱式碳酸镁[Mg2(OH)2CO3],结合化学用语并根据化学平衡移动原理,分析其产生的原因:___________ ;
(4)根据上述实验判断,影响Mg与盐溶液反应多样性的原因有:
ⅰ.盐溶液中阳离子氧化性的相对强弱;
ⅱ.盐溶液中阴离子的催化作用;
ⅲ:___________ 。
| 实验 | 向试管中加2mL溶液 | 实验现象 |
 | 实验Ⅰ:0.1 mol/L AgNO3溶液 | 镁条表面迅速覆盖一层疏松黑色固体,并有少量气泡产生 |
| 实验Ⅱ:2.0 mol/L NH4Cl溶液 | 反应开始时产生大量气体(经检验其中含有H2),一段时间后产生使湿润的红色石蕊试纸变蓝的气体 | |
| 实验Ⅲ:pH=8.2 NaHCO3溶液 | 产生大量气体(经检验其中含有H2和CO2)和白色晶体 |
①推测实验Ⅰ中黑色固体为Ag,则发生反应的离子方程式为
②确认黑色固体为Ag的实验方案是
(2)对实验Ⅱ进行研究:
①反应开始时产生H2的原因可能是:
ⅰ.
ⅱ.Mg和NH
 直接反应。
直接反应。②“一段时间后”产生的气体一定含有
③为进一步研究NH4Cl溶液的作用,设计如下实验:
| 实验 | 操作 | 现象 |
| 实验Ⅳ | 用1mol/L(NH4)2SO4溶液重复实验Ⅱ | 产生气体的速率慢于实验Ⅱ |
| 实验Ⅴ | 用2mol/L(NH4)2SO4溶液重复实验Ⅱ | 产生气体的速率与实验Ⅱ相当 |
(3)对实验Ⅲ进行研究:
①推测在pH=8.2的该溶液中,若无HCO
 ,则H+和Mg反应的程度很小。通过实验证实了该推测,其方案是
,则H+和Mg反应的程度很小。通过实验证实了该推测,其方案是②经检验,白色晶体为碱式碳酸镁[Mg2(OH)2CO3],结合化学用语并根据化学平衡移动原理,分析其产生的原因:
(4)根据上述实验判断,影响Mg与盐溶液反应多样性的原因有:
ⅰ.盐溶液中阳离子氧化性的相对强弱;
ⅱ.盐溶液中阴离子的催化作用;
ⅲ:
【知识点】 盐类水解规律理解及应用解读 化学实验探究 物质性质实验方案的设计解读
您最近一年使用:0次
试卷分析
整体难度:适中
考查范围:认识化学科学、化学反应原理、有机化学基础、常见无机物及其应用、化学实验基础、物质结构与性质
试卷题型(共 11题)
题型
数量
单选题
7
解答题
3
填空题
1
试卷难度
知识点分析
细目表分析 导出
| 题号 | 难度系数 | 详细知识点 | 备注 |
| 一、单选题 | |||
| 1 | 0.85 | 氧化还原反应基本概念 | |
| 2 | 0.65 | 有关粒子结构的化学用语 原子结构示意图、离子结构示意图 有机物的结构式、结构简式、比例模型、球棍模型、最简式 影响水电离的因素 | |
| 3 | 0.65 | 氧化还原反应的规律 化学键与化学反应中的能量关系 吸热反应和放热反应 | |
| 4 | 0.65 | 含酚羟基化合物反应的相关计算 多官能团有机物的结构与性质 | |
| 5 | 0.65 | 电解质的电离 浓硫酸的吸水性 常见无机物的制备 | |
| 6 | 0.65 | 离子方程式的正误判断 氧化还原反应方程式的配平 盐类水解的原理 | |
| 7 | 0.65 | 电解原理的应用 电解原理的理解及判断 电解池电极反应式及化学方程式的书写与判断 电解池有关计算 | |
| 二、解答题 | |||
| 8 | 0.65 | 逆合成分析法 根据题给物质选择合适合成路线 有机合成综合考查 | 有机推断题 |
| 10 | 0.65 | 物质分离、提纯综合应用 常见无机物的制备 物质制备的探究 | 工业流程题 |
| 11 | 0.65 | 盐类水解规律理解及应用 化学实验探究 物质性质实验方案的设计 | 实验探究题 |
| 三、填空题 | |||
| 9 | 0.4 | 化学反应热的计算 化学反应条件的控制及其应用 电解池电极反应式及化学方程式的书写与判断 “位构性”关系理解及应用 | |



