作业(十一) 化学反应的调控
全国
高二
课后作业
2023-08-15
297次
整体难度:
适中
考查范围:
化学反应原理
作业(十一) 化学反应的调控
全国
高二
课后作业
2023-08-15
297次
整体难度:
适中
考查范围:
化学反应原理
一、单选题 添加题型下试题
单选题
|
适中(0.65)
名校
1. 关于合成氨工业的说法中不正确的是
| A.混合气进行循环利用遵循绿色化学思想 |
| B.合成氨反应须在低温下进行 |
| C.对原料气进行压缩是为了增大原料气的转化率 |
| D.使用催化剂可以提高反应的速率,但是不能使平衡向正反应方向移动 |
【知识点】 影响化学平衡的因素 浓度对化学平衡移动的影响解读
您最近一年使用:0次
2020-11-24更新
|
294次组卷
|
4卷引用:“皖赣联考”2021届高三上学期第三次考试化学试题
“皖赣联考”2021届高三上学期第三次考试化学试题(已下线)【南昌新东方】10.2020年11月江西南昌师大附中高三上学期期中化学广东省广州市第六中学2022届高三第二次月考化学试题作业(十一) 化学反应的调控
单选题
|
较易(0.85)
名校
解题方法
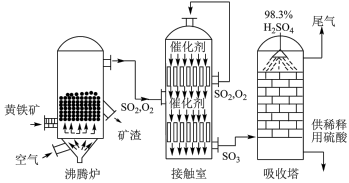
2. 如图所示为接触法制硫酸的设备和工艺流程,其中关键步骤是SO2的催化氧化:2SO2+O2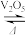 2SO3 △H<0。下列说法正确的是
2SO3 △H<0。下列说法正确的是
 2SO3 △H<0。下列说法正确的是
2SO3 △H<0。下列说法正确的是
| A.反应后气体分子数减少,增大反应容器内压强一定有利于提高生产效益 |
| B.反应放热,为提高SO2转化率,应尽可能在较低温度下反应 |
| C.工业生产要求高效,为加快反应速率,应使用催化剂并尽可能提高体系温度 |
| D.沸腾炉流出的气体必须经过净化,并补充适量空气,再进入接触室 |
您最近一年使用:0次
2020-09-08更新
|
601次组卷
|
9卷引用:浙江省2021届高考选考科目9月联考化学试题
浙江省2021届高考选考科目9月联考化学试题福建省厦门第一中学2021届高三上学期第一次质量检测化学试题(已下线)小题必刷28 化学平衡及平衡移动——2021年高考化学一轮复习小题必刷(通用版本)(已下线)专题2.4 化学反应的调控(备作业)-【上好课】2021-2022学年高二化学同步备课系列(人教版2019选择性必修1)(已下线)2.4 化学反应的调控-2021-2022学年高二化学课后培优练(人教版2019选择性必修1)第四节 化学反应的调控福建省厦门市国祺中学2021-2022学年高二上学期期中考试化学试题(已下线)化学反应速率与化学平衡——课时7化学反应的调控作业(十一) 化学反应的调控
单选题
|
适中(0.65)
名校
3. 纳米钴常用于CO加氢反应的催化剂:CO(g)+3H2(g) CH4(g)+H2O(g) ΔH<0。下列说法正确的是
CH4(g)+H2O(g) ΔH<0。下列说法正确的是
 CH4(g)+H2O(g) ΔH<0。下列说法正确的是
CH4(g)+H2O(g) ΔH<0。下列说法正确的是| A.纳米技术的应用,优化了催化剂的性能,提高了反应的转化率 |
| B.缩小容器体积,平衡向正反应方向移动,CO的浓度增大 |
| C.从平衡体系中分离出H2O(g)能加快正反应速率 |
| D.工业生产中采用高温条件下进行,其目的是提高CO的平衡转化率 |
【知识点】 影响化学反应速率的因素 影响化学平衡的因素
您最近一年使用:0次
2020-01-18更新
|
382次组卷
|
8卷引用:广东省深圳市宝安区2019-2020学年高二上学期期末调研考试化学试题
单选题
|
适中(0.65)
名校
4. 目前工业上利用甲烷催化裂解生产不含一氧化碳和二氧化碳的清洁氢气。该过程多用铁、钴和镍等过渡金属纳米催化剂:CH4(g) C(s)+2H2(g),已知温度升高,甲烷的平衡转化率增大。下列有关说法不正确的是( )
C(s)+2H2(g),已知温度升高,甲烷的平衡转化率增大。下列有关说法不正确的是( )
 C(s)+2H2(g),已知温度升高,甲烷的平衡转化率增大。下列有关说法不正确的是( )
C(s)+2H2(g),已知温度升高,甲烷的平衡转化率增大。下列有关说法不正确的是( )| A.甲烷裂解属于吸热反应 |
| B.在反应体系中加催化剂,反应速率增大 |
| C.增大体系压强,不能提高甲烷的转化率 |
| D.在1500℃以上时,甲烷的转化率很高,但几乎得不到炭黑,是因为在高温下该反应为放热反应 |
您最近一年使用:0次
2019-11-26更新
|
262次组卷
|
4卷引用:重庆市北碚区2019-2020学年高二11月联合性测试化学试题
单选题
|
适中(0.65)
名校
解题方法
5. 甲烷重整时涉及以下两个反应
① CH4(g) + H2O(g) CO(g) +3H2(g) 平衡常数K1
CO(g) +3H2(g) 平衡常数K1
② CO (g) + H2O(g) CO2(g) + H2(g) 平衡常数K2
CO2(g) + H2(g) 平衡常数K2
它们的平衡常数随温度的变化如图所示,下列说法正确的是
① CH4(g) + H2O(g)
 CO(g) +3H2(g) 平衡常数K1
CO(g) +3H2(g) 平衡常数K1② CO (g) + H2O(g)
 CO2(g) + H2(g) 平衡常数K2
CO2(g) + H2(g) 平衡常数K2它们的平衡常数随温度的变化如图所示,下列说法正确的是

| A.反应①、②都是放热反应 |
| B.两曲线交点表示此时①、②两反应速率相等 |
C.相同温度下,CH4(g)+2H2O(g)  CO2(g) +4H2(g)的平衡常数为K1+K2 CO2(g) +4H2(g)的平衡常数为K1+K2 |
| D.相同条件下,增大反应①、②中水蒸气的浓度,CH4、CO的转化率均增大 |
您最近一年使用:0次
2020-06-16更新
|
170次组卷
|
3卷引用:江苏省响水中学2019-2020学年高二下学期期中考试化学(选修)试题
单选题
|
适中(0.65)
名校
6. 常压下羰基化法精炼镍的原理为: Ni(s)+4CO(g)  Ni(CO)4(g)。230℃时,该反应的平衡常数K=2×10−5。已知:Ni(CO)4的沸点为42.2℃,固体杂质不参与反应。第一阶段:将粗镍与CO反应转化成气态Ni(CO)4;第二阶段:将第一阶段反应后的气体分离出来,加热至230℃制得高纯镍。下列判断不正确的是
Ni(CO)4(g)。230℃时,该反应的平衡常数K=2×10−5。已知:Ni(CO)4的沸点为42.2℃,固体杂质不参与反应。第一阶段:将粗镍与CO反应转化成气态Ni(CO)4;第二阶段:将第一阶段反应后的气体分离出来,加热至230℃制得高纯镍。下列判断不正确的是
 Ni(CO)4(g)。230℃时,该反应的平衡常数K=2×10−5。已知:Ni(CO)4的沸点为42.2℃,固体杂质不参与反应。第一阶段:将粗镍与CO反应转化成气态Ni(CO)4;第二阶段:将第一阶段反应后的气体分离出来,加热至230℃制得高纯镍。下列判断不正确的是
Ni(CO)4(g)。230℃时,该反应的平衡常数K=2×10−5。已知:Ni(CO)4的沸点为42.2℃,固体杂质不参与反应。第一阶段:将粗镍与CO反应转化成气态Ni(CO)4;第二阶段:将第一阶段反应后的气体分离出来,加热至230℃制得高纯镍。下列判断不正确的是| A.该反应达到平衡时,v分解[Ni(CO)4]=4v消耗(CO) |
| B.第一阶段应选择稍高于42.2℃的反应温度 |
| C.第二阶段,230℃时Ni(CO)4分解率较高 |
| D.其他条件不变,增加c(CO),平衡向正向移动,反应的平衡常数不变 |
【知识点】 影响化学反应速率的因素 影响化学平衡的因素
您最近一年使用:0次
2018-01-20更新
|
538次组卷
|
10卷引用:天津市河西区2017-2018学年上学期期末高三化学试题
天津市河西区2017-2018学年上学期期末高三化学试题福建省泉州市泉港第一中学2019届高三上学期期末质量检测理科综合化学试题【全国百强校】山东省济南外国语学校2019届高三上学期1月份阶段模拟测试化学试题福建省龙海市第二中学2019届高三下学期期初考试化学试题2020届二轮复习 化学反应速率与化学平衡 专题卷(全国通用)(已下线)卷03 小题素养卷-【小题小卷】冲刺2022年高考化学小题限时集训(新高考专用)第四节 化学反应的调控广东省深圳实验学校高中部2022-2023学年高二上学期第一阶段考试化学试题 河南省洛阳市第三高级中学2022-2023学年高二上学期12月月考化学试题作业(十一) 化学反应的调控
单选题
|
适中(0.65)
真题
名校
7. 已知:2SO2(g)+ O2(g)= 2SO3(g) △H =-197.8kJ•mol—1。起始反应物为SO2和 O2(物质的量之比为2:1,且总物质的量不变)。SO2的平衡转化率(%)随温度和压强的变化如下表,下列说法不正确 的是
| 温度/K | 压强/(105Pa) | ||||
| 1.01 | 5.07 | 10.1 | 25.3 | 50.7 | |
| 673 | 99.2 | 99.6 | 99.7 | 99.8 | 99.9 |
| 723 | 97.5 | 98.9 | 99.2 | 99.5 | 99.6 |
| 773 | 93.5 | 96.9 | 97.8 | 98.6 | 99.0 |
| A.一定压强下降低温度,SO2的转化率增大 |
| B.在不同温度、压强下,转化相同物质的量的SO2所需要的时间相等 |
| C.使用催化剂可以缩短反应达到平衡所需的时间 |
| D.工业生产通常不采取加压措施是因为常压下SO2的转化率已相当高 |
【知识点】 影响化学平衡的因素
您最近一年使用:0次
2018-11-07更新
|
3586次组卷
|
18卷引用:2018年11月浙江省普通高校招生选考科目考试化学试题
2018年11月浙江省普通高校招生选考科目考试化学试题河南省南阳市南阳一中2019-2020学年高二上期第三次月考化学试题浙江省2019届高三11月选考科目考试化学试卷鲁科版(2019)选择性必修1 第2章 化学反应的方向、限度与速率 第2节 化学反应的限度(已下线)第02章 化学反应速率与化学平衡(A卷基础强化篇)-2020-2021学年高二化学选择性必修1同步单元AB卷(新教材人教版)人教版(2019)高二选择性必修第一册 第二章 化学反应速率与化学平衡 第二节 化学平衡 高考帮北京二中2020-2021学年高二上学期10月月考化学试题辽宁省铁岭市开原市第二高级中学2020-2021学年高二上学期期初考试化学试题(已下线)小题必刷28 化学平衡及平衡移动——2021年高考化学一轮复习小题必刷(通用版本)浙江省宁波市北仑中学2021届高三12月适应性考试化学试题(已下线)专题12.化学反应速率与化学平衡-十年(2012-2021)高考化学真题分项汇编(浙江专用)(已下线)第29练 化学反应的调控-2023年高考化学一轮复习小题多维练(全国通用)(已下线)专题七 化学反应速率与化学平衡 能力提升检测卷(测)-2023年高考化学一轮复习讲练测(新教材新高考)作业(十一) 化学反应的调控第二章 化学反应速率与化学平衡 第四节 化学反应的调控(已下线)第5讲 化学反应的调控辽宁省大连市第四十四中学2022-2023学年高三上学期10月考试化学试题(已下线)考点巩固卷10 化学反应速率与化学平衡(二)(6大考法)-2025年高考化学一轮复习考点通关卷(新高考通用)
二、填空题 添加题型下试题
填空题
|
适中(0.65)
8. 在硫酸工业中,通过下列反应使SO2转化为SO3:2SO2(g)+O2(g)  2SO3(g) ΔH=-196.6kJ·mol-1,下表列出了不同温度和压强下,反应达到平衡时SO2的转化率
2SO3(g) ΔH=-196.6kJ·mol-1,下表列出了不同温度和压强下,反应达到平衡时SO2的转化率
(1)在生产中常用过量的空气是为了___________
(2)在实际生产中,操作温度选定400—500℃,是因为___________
(3)硫酸工业选定压强通常采用常压,做出这种选择的依据是___________
 2SO3(g) ΔH=-196.6kJ·mol-1,下表列出了不同温度和压强下,反应达到平衡时SO2的转化率
2SO3(g) ΔH=-196.6kJ·mol-1,下表列出了不同温度和压强下,反应达到平衡时SO2的转化率| 温度\压强 | 1×105Pa | 5×105Pa | 1×106Pa | 1×107Pa |
| 400℃ | 99.2% | 99.6% | 99.7% | 99.9% |
| 500℃ | 93.5% | 96.9% | 97.8% | 99.3% |
| 600℃ | 73.7% | 85.8% | 89.5% | 96.4% |
(2)在实际生产中,操作温度选定400—500℃,是因为
(3)硫酸工业选定压强通常采用常压,做出这种选择的依据是
【知识点】 化学反应条件的控制及优化 化学平衡的移动解读
您最近一年使用:0次
2021-11-21更新
|
397次组卷
|
3卷引用:浙江省温州新力量联盟2021-2022学年高二上学期期中联考化学试题
三、单选题 添加题型下试题
单选题
|
适中(0.65)
名校
解题方法
9. 以丙烯、氨气和空气(空气中O2体积分数约为20%)为原料,在催化剂条件下生产丙烯腈(CH2CHCN)的过程中会同时生成副产物丙烯醛,发生的主要反应如下:
C3H6(g)+NH3(g)+3/2O2(g)=CH2CHCN(g)+3H2O(g)
C3H6(g)+O2(g)=CH2CHCHO(g)+H2O(g)
在恒压、460℃时,保持丙烯和氨气的总进料量和空气的进料量均不变,丙烯腈和丙烯醛的平衡产率随进料气中n(氨气)/n(丙烯)的比值变化的曲线如图所示。下列有关说法正确的是
C3H6(g)+NH3(g)+3/2O2(g)=CH2CHCN(g)+3H2O(g)
C3H6(g)+O2(g)=CH2CHCHO(g)+H2O(g)
在恒压、460℃时,保持丙烯和氨气的总进料量和空气的进料量均不变,丙烯腈和丙烯醛的平衡产率随进料气中n(氨气)/n(丙烯)的比值变化的曲线如图所示。下列有关说法正确的是
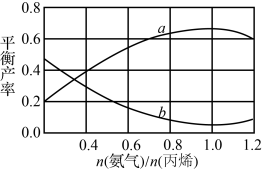
| A.图中曲线a表示丙烯腈的平衡产率随n(氨气)/n(丙烯)比值的变化 |
| B.增大压强有利于提高反应速率和丙烯腈的平衡产率 |
| C.使用合适的催化剂可以使丙烯腈的平衡产率达到100% |
| D.由图可知,原料氨气、丙烯和空气的理论最佳进料体积比为2∶2∶3 |
您最近一年使用:0次
2021-03-03更新
|
590次组卷
|
7卷引用:江苏省常州市2021届高三下学期期初调研考试化学试题
江苏省常州市2021届高三下学期期初调研考试化学试题辽宁省葫芦岛市2021届高考第一次模拟考试化学试题河北省张家口市宣化第一中学2021届高三下学期阶段模拟(五)化学试题吉林省松原市实验高级中学2020-2021学年高三下学期第三次摸底测试化学试题(已下线)专题12 化学反应速率与化学平衡-2022年高考化学二轮复习重点专题常考点突破练作业(十一) 化学反应的调控江苏省盐城市响水中学2023-2024学年高二下学期期中考试化学试题
单选题
|
适中(0.65)
10. CO常用于工业冶炼金属,如图是在不同温度下CO还原四种金属氧化物达平衡后气体中lg[c(CO)/c(CO2)]与温度(T)的关系曲线图。下列说法正确的是
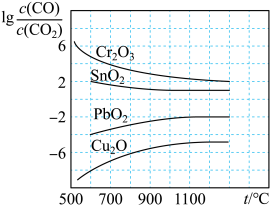

| A.工业上可以通过增高反应装置来延长矿石和CO接触的时间,减少尾气中CO的含量 |
| B.CO适用于高温冶炼金属铬(Cr) |
| C.工业冶炼金属铜(Cu)时较低的温度有利于提高CO的利用率 |
| D.CO还原PbO2的反应ΔH>0 |
【知识点】 影响化学平衡的因素 化学平衡图像分析 温度对化学平衡移动的影响解读
您最近一年使用:0次
单选题
|
适中(0.65)
11. 肼( )和氧气的反应情况受温度影响。某同学设计方案探究温度对产率影响的结果如图所示。下列说法不正确的是
)和氧气的反应情况受温度影响。某同学设计方案探究温度对产率影响的结果如图所示。下列说法不正确的是
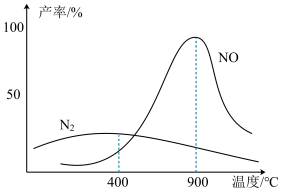
 )和氧气的反应情况受温度影响。某同学设计方案探究温度对产率影响的结果如图所示。下列说法不正确的是
)和氧气的反应情况受温度影响。某同学设计方案探究温度对产率影响的结果如图所示。下列说法不正确的是
A.温度较低时,肼和氧气主要发生反应: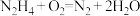 |
B.900℃时,能发生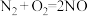 |
C.900℃时, 的产率与NO的产率之和可能小于1 的产率与NO的产率之和可能小于1 |
| D.该探究方案是将一定量的肼和氧气在密闭容器中进行不断升温实验 |
您最近一年使用:0次
2021-01-12更新
|
376次组卷
|
2卷引用:湖南省长沙市长郡中学2021届高三上学期第5次月考化学试题
四、解答题 添加题型下试题
解答题-原理综合题
|
适中(0.65)
解题方法
12. 乙酸制氢具有重要意义,发生的反应如下:
热裂解反应:CH3COOH(g)=2CO(g)+2H2(g) ΔH=+213.7 kJ·mol-1
脱羧基反应:CH3COOH(g)=CH4(g)+CO2(g) ΔH=-33.5 kJ·mol-1
(1)请写出CO与H2反应生成甲烷的热化学方程式:___________ 。
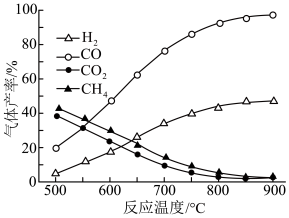
(2)在密闭容器中,利用乙酸制氢,选择的压强为___________ (填“高压”或“常压”)。其中温度与气体产率的关系如图:___________ 。
②保持其他条件不变,在乙酸气中掺杂一定量水,氢气产率显著提高而CO的产率下降,请分析原因:___________ 。
(3)若利用合适的催化剂控制其他副反应,温度为T ℃时达到平衡,总压强为p kPa,热裂解反应消耗乙酸30%,脱羧基反应消耗乙酸50%,H2体积分数为___________ ;脱羧基反应的平衡常数Kp为___________ kPa(Kp为以分压表示的平衡常数,分压=总压×体积分数,计算结果用最简式表示)。
热裂解反应:CH3COOH(g)=2CO(g)+2H2(g) ΔH=+213.7 kJ·mol-1
脱羧基反应:CH3COOH(g)=CH4(g)+CO2(g) ΔH=-33.5 kJ·mol-1
(1)请写出CO与H2反应生成甲烷的热化学方程式:
(2)在密闭容器中,利用乙酸制氢,选择的压强为
②保持其他条件不变,在乙酸气中掺杂一定量水,氢气产率显著提高而CO的产率下降,请分析原因:
(3)若利用合适的催化剂控制其他副反应,温度为T ℃时达到平衡,总压强为p kPa,热裂解反应消耗乙酸30%,脱羧基反应消耗乙酸50%,H2体积分数为
【知识点】 盖斯定律与热化学方程式解读 影响化学平衡的因素
您最近一年使用:0次
五、填空题 添加题型下试题
填空题
|
较难(0.4)
13. 醇烃化新技术是近几年合成氨工业净化精炼原料气、除去少量CO的一种新方法。其原理可分为甲醇化和甲烷化两个部分。
甲醇化:CO(g)+2H2(g) CH3OH(g) ΔH1=-111 kJ·mol-1
CH3OH(g) ΔH1=-111 kJ·mol-1
甲烷化:CO(g)+3H2(g) CH4(g)+H2O(g) ΔH2=-203 kJ·mol-1
CH4(g)+H2O(g) ΔH2=-203 kJ·mol-1
(1)下列措施有利于提高醇烃化过程中CO转化率的是___________。
(2)甲醇化平衡常数可用Kα= 表示;α为平衡组分中各物质的物质的量分数。若CO与H2混合原料气中CO的体积分数为1%,经甲醇化后CO的平衡转化率为w,则Kα=
表示;α为平衡组分中各物质的物质的量分数。若CO与H2混合原料气中CO的体积分数为1%,经甲醇化后CO的平衡转化率为w,则Kα=___________ (用含w的表达式表示)。
(3)测试a、b两种催化剂在不同压强和温度条件下,甲醇化过程中催化效率如图:
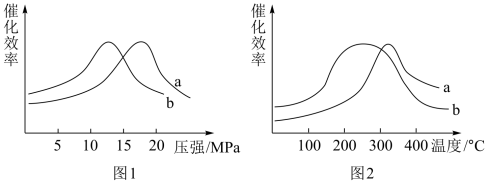
从上图可知选择哪种催化剂较好___________ (填a或b),理由是___________ 。
甲醇化:CO(g)+2H2(g)
 CH3OH(g) ΔH1=-111 kJ·mol-1
CH3OH(g) ΔH1=-111 kJ·mol-1甲烷化:CO(g)+3H2(g)
 CH4(g)+H2O(g) ΔH2=-203 kJ·mol-1
CH4(g)+H2O(g) ΔH2=-203 kJ·mol-1(1)下列措施有利于提高醇烃化过程中CO转化率的是___________。
| A.及时分离出CH3OH | B.适当升高反应温度 |
| C.使用高效的催化剂 | D.适当增大压强 |
 表示;α为平衡组分中各物质的物质的量分数。若CO与H2混合原料气中CO的体积分数为1%,经甲醇化后CO的平衡转化率为w,则Kα=
表示;α为平衡组分中各物质的物质的量分数。若CO与H2混合原料气中CO的体积分数为1%,经甲醇化后CO的平衡转化率为w,则Kα=(3)测试a、b两种催化剂在不同压强和温度条件下,甲醇化过程中催化效率如图:

从上图可知选择哪种催化剂较好
您最近一年使用:0次
试卷分析
导出
整体难度:适中
考查范围:化学反应原理
试卷题型(共 13题)
题型
数量
单选题
10
填空题
2
解答题
1
试卷难度
细目表分析
| 题号 | 难度系数 | 详细知识点 | 备注 |
| 一、单选题 | |||
| 1 | 0.65 | 影响化学平衡的因素 浓度对化学平衡移动的影响 | |
| 2 | 0.85 | 影响化学平衡的因素 浓度对化学平衡移动的影响 温度对化学平衡移动的影响 化学反应条件的控制 | |
| 3 | 0.65 | 影响化学反应速率的因素 影响化学平衡的因素 | |
| 4 | 0.65 | 温度对化学平衡移动的影响 压强对化学平衡移动的影响 化学反应条件的控制 | |
| 5 | 0.65 | 盖斯定律与热化学方程式 影响化学平衡的因素 化学平衡常数的概念及表达方式 化学平衡常数的影响因素及应用 | |
| 6 | 0.65 | 影响化学反应速率的因素 影响化学平衡的因素 | |
| 7 | 0.65 | 影响化学平衡的因素 | |
| 9 | 0.65 | 影响化学平衡的因素 化学平衡图像分析 可逆反应及反应限度 化学反应条件的控制 | |
| 10 | 0.65 | 影响化学平衡的因素 化学平衡图像分析 温度对化学平衡移动的影响 | |
| 11 | 0.65 | 影响化学平衡的因素 产物的物质的量与温度、压强的图像关系分析 化学反应条件的控制 | |
| 二、填空题 | |||
| 8 | 0.65 | 化学反应条件的控制及优化 化学平衡的移动 | |
| 13 | 0.4 | 影响化学平衡的因素 化学平衡图像分析 化学平衡常数的计算 | |
| 三、解答题 | |||
| 12 | 0.65 | 盖斯定律与热化学方程式 影响化学平衡的因素 | 原理综合题 |



