高中必刷题高二选择性必修1第三章 水溶液中的离子反应与平衡 第四节综合训练
全国
高二
课后作业
2020-09-21
544次
整体难度:
适中
考查范围:
化学反应原理、化学实验基础、常见无机物及其应用
高中必刷题高二选择性必修1第三章 水溶液中的离子反应与平衡 第四节综合训练
全国
高二
课后作业
2020-09-21
544次
整体难度:
适中
考查范围:
化学反应原理、化学实验基础、常见无机物及其应用
一、单选题 添加题型下试题
单选题
|
较难(0.4)
名校
解题方法
1. 硫酸锌是制造锌钡白和锌盐的主要原料,也可用作印染媒染剂,医药上用于催吐剂。已知25℃时,Ksp[Zn(OH)2]= 1.0 ×10-1 7 ,Ksp[Ag2SO4]=1.2×10-5,则下列说法正确的是
| A.在水中加入少量ZnSO4固体时,水的电离平衡向正反应方向移动,Kw减小 |
| B.在 ZnSO4 溶液中各离子的浓度关系为: c(Zn2 + )+c(H+ )=c(OH-)+c(SO42-) |
| C.在 0.5L 0.10mol•L-1的 ZnSO4 溶液中加入等体积的0.02 mol⋅L−1的AgNO3溶液,即可生成Ag2SO4沉淀 |
| D.常温下,要除去0.20mol•L-1,ZnSO4 溶液中的Zn2+,至少要调节pH ≥8 |
您最近一年使用:0次
2020-04-02更新
|
384次组卷
|
12卷引用:2016届广东省松山湖学校、东莞一中高三上12月联考理综化学试卷
2016届广东省松山湖学校、东莞一中高三上12月联考理综化学试卷【全国百强校】河北省武邑中学2019届高三上学期第三次调研考试化学试题【全国百强校】福建省厦门双十中学2018-2019学年高二下学期第二次月考化学试题内蒙古巴彦淖尔市乌拉特前旗第一中学2019-2020学年高三上学期第一次月考理综化学试题(已下线)2019年11月13日 《每日一题》人教版(选修4)——溶度积的有关计算甘肃省张掖市临泽县第一中学2019-2020学年高二11月月考化学试题(已下线)【南昌新东方】莲塘一中2020届高二11月质量检测鲁科版(2019)选择性必修1第3章 物质在水溶液中的行为 第3节综合训练高中必刷题高二选择性必修1第三章 水溶液中的离子反应与平衡 第四节综合训练鲁科版(2019)高二选择性必修第一册第3章 物质在水溶液中的行为 过素养 学科素养拓展训练山东省泰安市新泰中学2020-2021学年高二上学期第二次阶段性考试化学试题山东省新泰市第一中学老校区(新泰中学)2023-2024学年高二上学期第二次月考化学试题
单选题
|
适中(0.65)
名校
2. 室温下,已知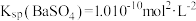 ,
,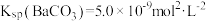 。下列说法中正确的是
。下列说法中正确的是
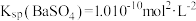 ,
,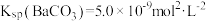 。下列说法中正确的是
。下列说法中正确的是A.在含有 固体的溶液中,一定有 固体的溶液中,一定有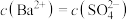 |
B.向只含有 的悬浊液中加入少量水,溶液中 的悬浊液中加入少量水,溶液中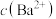 增大 增大 |
C.向只含有 的悬浊液中逐渐加入 的悬浊液中逐渐加入 固体至 固体至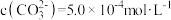 时, 时, 开始向 开始向 沉淀转化 沉淀转化 |
D.向 和 和 的混合溶液中加入 的混合溶液中加入 溶液,当生成 溶液,当生成 沉淀时, 沉淀时,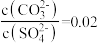 |
您最近一年使用:0次
2020-09-13更新
|
183次组卷
|
8卷引用:湖北省黄冈市2017-2018学年高二上学期期末考试化学试题
湖北省黄冈市2017-2018学年高二上学期期末考试化学试题江西省南昌市第十中学2019-2020学年高二上学期期末考试化学试题(已下线)【南昌新东方】2019 南昌市三校(一中、十中、铁一中)高二上 期末鲁科版(2019)选择性必修1第3章 物质在水溶液中的行为 第3节综合训练高中必刷题高二选择性必修1第三章 水溶液中的离子反应与平衡 第四节综合训练(已下线)四川省棠湖中学2018-2019学年高二上学期期末模拟理综-化学试题江西省南昌市八一中学、洪都中学等七校2020-2021学年高二上学期期末联考化学试题江西省宜春市万载中学2021-2022学年高二上学期第三次月考化学试题
单选题
|
适中(0.65)
解题方法
3. 还原沉淀法是处理含铬(含Cr2O72-和CrO42-)工业废水的常用方法,过程如下:
CrO42- Cr2O72-
Cr2O72- Cr3+
Cr3+ Cr(OH)3↓
Cr(OH)3↓
已知转换过程中的反应为:2CrO42-(aq)+2H+(aq) Cr2O72-(aq)+H2O(l)。转化后所得溶液中铬元素的含量为28.6g/L,CrO42-有10/11转化为Cr2O72-,下列说法不正确的是
Cr2O72-(aq)+H2O(l)。转化后所得溶液中铬元素的含量为28.6g/L,CrO42-有10/11转化为Cr2O72-,下列说法不正确的是
CrO42-
 Cr2O72-
Cr2O72- Cr3+
Cr3+ Cr(OH)3↓
Cr(OH)3↓已知转换过程中的反应为:2CrO42-(aq)+2H+(aq)
 Cr2O72-(aq)+H2O(l)。转化后所得溶液中铬元素的含量为28.6g/L,CrO42-有10/11转化为Cr2O72-,下列说法不正确的是
Cr2O72-(aq)+H2O(l)。转化后所得溶液中铬元素的含量为28.6g/L,CrO42-有10/11转化为Cr2O72-,下列说法不正确的是| A.溶液颜色保持不变,说明上述可逆反应达到平衡状态 |
| B.若用绿矾(FeSO4·7H2O)作还原剂,处理1L废水,至少需要458.7g |
| C.常温下转化反应的平衡常数K=1×1014,则转化后所得溶液的pH=5 |
| D.常温下Ksp[Cr(OH)3]=1×10-32,要使处理后废水中的c(Cr3+)降至1×10-5mol·L-1,应调溶液的pH=5 |
【知识点】 化学平衡状态 化学反应条件的控制及优化 溶度积 溶度积常数相关计算解读
您最近一年使用:0次
2018-09-25更新
|
537次组卷
|
4卷引用:湖南省师范大学附属中学2016-2017学年高二(理科)上学期期末考试化学试题
湖南省师范大学附属中学2016-2017学年高二(理科)上学期期末考试化学试题【懂做原理题】2020届高三化学选修4二轮专题练——沉淀溶解平衡【精编25题】高中必刷题高二选择性必修1第三章 水溶液中的离子反应与平衡 第四节综合训练(已下线)第26讲 难溶电解质的溶解平衡(讲)-2023年高考化学一轮复习讲练测(全国通用)
4. 已知: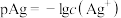 ,
,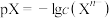 。
。 时,几种物质的
时,几种物质的 的值如下表:
的值如下表:
 、
、 、
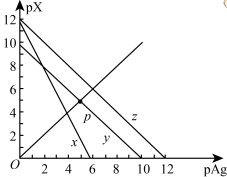
、 的饱和溶液中,阳离子和阴离子的浓度关系如图所示。下列说法正确的是
的饱和溶液中,阳离子和阴离子的浓度关系如图所示。下列说法正确的是
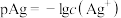 ,
,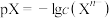 。
。 时,几种物质的
时,几种物质的 的值如下表:
的值如下表:| 化学式 |  |  |  |
| 颜色 | 白 | 浅黄 | 红 |
 |  |  |  |
 、
、 、
、 的饱和溶液中,阳离子和阴离子的浓度关系如图所示。下列说法正确的是
的饱和溶液中,阳离子和阴离子的浓度关系如图所示。下列说法正确的是
A.图中x代表 曲线,z代表 曲线,z代表 曲线 曲线 |
B.298K时,在 和 和 的物质的量浓度均为 的物质的量浓度均为 的溶液中,滴入少量 的溶液中,滴入少量 的 的 溶液,首先产生的是红色沉淀 溶液,首先产生的是红色沉淀 |
| C.298K时,若增大p点的阴离子浓度,则y上的点沿曲线向上移动 |
D.298K时, 的平衡常数 的平衡常数 |
您最近一年使用:0次
2020-09-13更新
|
1245次组卷
|
20卷引用:重庆市第一中学2020届高三10月月考理综化学试题
重庆市第一中学2020届高三10月月考理综化学试题贵州省铜仁市第一中学2020届高三上学期第三次月考化学试题黑龙江省哈尔滨市第六中学2020届高三上学期第三次调研考试化学试题2019年秋高三化学复习强化练习—— 难溶电解质的沉淀溶解平衡2020届高三《新题速递·化学》12月第01期(考点07-11)2020届高三化学化学二轮复习——常考题型:沉淀溶解平衡的曲线分析【精编25题】(已下线)考点13 沉淀溶解平衡-2020年高考化学命题预测与模拟试题分类精编内蒙古赤峰市赤峰二中2019-2020学年高二下学期第一次月考化学试题陕西省西安中学2020届高三第六次模拟考试化学试题鲁科版(2019)选择性必修1第3章 物质在水溶液中的行为 第3节综合训练高中必刷题高二选择性必修1第三章 水溶液中的离子反应与平衡 第四节综合训练(已下线)3.4+难溶电解质的溶解平衡-2020-2021学年高二化学同步课堂帮帮帮(人教版选修4)陕西省汉中市部分高中2020-2021学年高二上学期12月月考化学试题福建省莆田二中2020-2021学年高三上学期期中检测化学试题选择性必修1 专题3 第四单元综合训练(已下线)课时45 难溶电解质的溶解平衡-2022年高考化学一轮复习小题多维练(全国通用)陕西省西安市长安区第一中学2021-2022学年高二下学期期中考试化学试题陕西省西安中学2022届高三下学期五月全仿真模拟考试(一)理综化学试题吉林省通化市辉南县第六中学2022-2023学年高二上学期第一次月考化学试题广西 南宁市第三中学2021-2022学年高二下学期期中考试化学试题
二、多选题 添加题型下试题
多选题
|
适中(0.65)
名校
解题方法
5. 25℃时, 的
的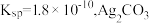 在水中的沉淀溶解平衡曲线如图所示。下列说法错误的是
在水中的沉淀溶解平衡曲线如图所示。下列说法错误的是

 的
的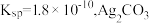 在水中的沉淀溶解平衡曲线如图所示。下列说法错误的是
在水中的沉淀溶解平衡曲线如图所示。下列说法错误的是
A.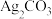 的 的 为 为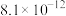 |
B.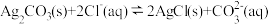 的平衡常数 的平衡常数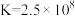 |
C.向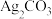 的饱和溶液中加入 的饱和溶液中加入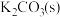 ,可实现由Y点到X点 ,可实现由Y点到X点 |
D.向浓度均为 的 的 和 和 的混合溶液中滴入 的混合溶液中滴入 溶液, 溶液, 先沉淀 先沉淀 |
您最近一年使用:0次
2020-09-21更新
|
216次组卷
|
6卷引用:湖北省荆州市四县市2019-2020学年高二上学期期末考试化学试题
湖北省荆州市四县市2019-2020学年高二上学期期末考试化学试题高中必刷题高二选择性必修1第三章 水溶液中的离子反应与平衡 第四节综合训练(已下线)3.4+难溶电解质的溶解平衡-2020-2021学年高二化学同步课堂帮帮帮(人教版选修4)(已下线)3.4 难溶电解质的溶解平衡(重点练)-2020-2021学年高二化学上学期十分钟同步课堂专练(人教版选修4)湖南省常德市芷兰实验中学2020-2021学年高二下学期第一次月考化学试题微专题(九)——沉淀溶解平衡曲线
多选题
|
适中(0.65)
名校
6. 工业上常先以 为原料制得
为原料制得 溶液,通过添加过量难溶电解质
溶液,通过添加过量难溶电解质 ,使含有的
,使含有的 、
、 、
、 等金属离子形成硫化物沉淀,经过滤除去包括
等金属离子形成硫化物沉淀,经过滤除去包括 在内的沉淀,再经蒸发,结晶,可得纯净的
在内的沉淀,再经蒸发,结晶,可得纯净的 ,根据上述实验事实,下列分析正确的是
,根据上述实验事实,下列分析正确的是
 为原料制得
为原料制得 溶液,通过添加过量难溶电解质
溶液,通过添加过量难溶电解质 ,使含有的
,使含有的 、
、 、
、 等金属离子形成硫化物沉淀,经过滤除去包括
等金属离子形成硫化物沉淀,经过滤除去包括 在内的沉淀,再经蒸发,结晶,可得纯净的
在内的沉淀,再经蒸发,结晶,可得纯净的 ,根据上述实验事实,下列分析正确的是
,根据上述实验事实,下列分析正确的是A. 的 的 小于 小于 、 、 、 、 等硫化物的 等硫化物的 |
B.除杂试剂 也可用 也可用 代替 代替 |
C. 与 与 反应的离子方程式是 反应的离子方程式是 |
| D.整个过程中涉及的反应类型有复分解反应和氧化还原反应 |
您最近一年使用:0次
2020-09-13更新
|
193次组卷
|
3卷引用:山东省德州市2019-2020学年高二上学期期末考试化学试题
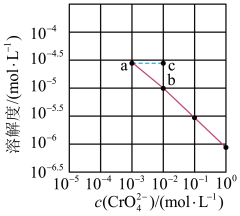
7. 溶解度也可用物质的量浓度表示。已知25℃时, 在
在 浓度不同的溶液中的溶解度如图所示,下列说法正确的是
浓度不同的溶液中的溶解度如图所示,下列说法正确的是
 在
在 浓度不同的溶液中的溶解度如图所示,下列说法正确的是
浓度不同的溶液中的溶解度如图所示,下列说法正确的是
A.图中a、b两点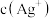 相同 相同 |
B.图中a点与b点对应的 的溶度积相等 的溶度积相等 |
C.在a点向溶液中加入少量 ,溶解度可变为c点 ,溶解度可变为c点 |
D.该温度下, 溶度积的数量级为 溶度积的数量级为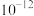 |
您最近一年使用:0次
2020-09-21更新
|
371次组卷
|
7卷引用:山东省泰安市2020届高三上学期期末考试化学试题
山东省泰安市2020届高三上学期期末考试化学试题山东省莱芜一中2020届高三3月份开学考试化学试题(已下线)考点13 沉淀溶解平衡-2020年高考化学命题预测与模拟试题分类精编鲁科版(2019)选择性必修1第3章 物质在水溶液中的行为 第3节综合训练高中必刷题高二选择性必修1第三章 水溶液中的离子反应与平衡 第四节综合训练福建省莆田市第二中学2021届高三10月月考化学试题(已下线)小题必刷34 沉淀溶解平衡、溶度积常数及其应用——2021年高考化学一轮复习小题必刷(通用版本)
三、解答题 添加题型下试题
解答题-原理综合题
|
适中(0.65)
名校
8. I.常温下, 的
的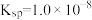 ,饱和溶液中存在平衡:
,饱和溶液中存在平衡: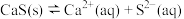 。
。
(1)①该温度下,将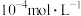 氯化钙溶液与
氯化钙溶液与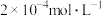 硫化钠溶液等体积混合,能否产生沉淀并说明理由:
硫化钠溶液等体积混合,能否产生沉淀并说明理由:_________ ;温度升高时,
_________ (填“增大”“减小”或“不变”,下同)。
②向 悬浊液中滴加少量浓盐酸,
悬浊液中滴加少量浓盐酸,
______ ,原因是_______ (用文字和离子方程式说明)。
(2)若向 悬浊液中加入
悬浊液中加入 溶液,生成一种黑色固体物质,写出该过程中发生反应的离子方程式:
溶液,生成一种黑色固体物质,写出该过程中发生反应的离子方程式:_________ 。
Ⅱ.已知常温下,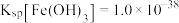 ,欲使
,欲使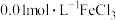 溶液开始产生
溶液开始产生 沉淀,应调整溶液
沉淀,应调整溶液 ,使
,使
____________ ,若要使其沉淀完全, 应
应____________ 。
 的
的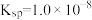 ,饱和溶液中存在平衡:
,饱和溶液中存在平衡: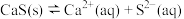 。
。(1)①该温度下,将
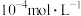 氯化钙溶液与
氯化钙溶液与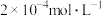 硫化钠溶液等体积混合,能否产生沉淀并说明理由:
硫化钠溶液等体积混合,能否产生沉淀并说明理由:
②向
 悬浊液中滴加少量浓盐酸,
悬浊液中滴加少量浓盐酸,
(2)若向
 悬浊液中加入
悬浊液中加入 溶液,生成一种黑色固体物质,写出该过程中发生反应的离子方程式:
溶液,生成一种黑色固体物质,写出该过程中发生反应的离子方程式:Ⅱ.已知常温下,
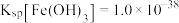 ,欲使
,欲使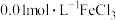 溶液开始产生
溶液开始产生 沉淀,应调整溶液
沉淀,应调整溶液 ,使
,使
 应
应
您最近一年使用:0次
2020-09-21更新
|
196次组卷
|
5卷引用:高中必刷题高二选择性必修1第三章 水溶液中的离子反应与平衡 第四节综合训练
高中必刷题高二选择性必修1第三章 水溶液中的离子反应与平衡 第四节综合训练(已下线)3.4 难溶电解质的溶解平衡(重点练)-2020-2021学年高二化学上学期十分钟同步课堂专练(人教版选修4)(已下线)3.4.2 沉淀溶解平衡的应用(素养提优B练)-2021-2022学年高二化学课时过关提优AB练(人教版2019选择性必修1)云南省澄江市第一中学2021-2022年高二下学期3月月考化学试题云南省景东彝族自治县第一中学2021-2022学年高二下学期3月份考试化学试题
四、填空题 添加题型下试题
9. 金属氢氧化物在酸中溶解度不同,因此可以利用这一性质,控制溶液的pH,以达到分离金属离子的目的。难溶金属的氢氧化物在不同pH下的溶解度(S/mol·L-1)如下图。
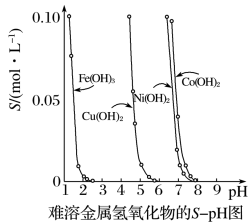
(1)pH=3时溶液中铜元素的主要存在形式是___________ 。
(2)若要除去CuCl2溶液中的少量Fe3+,应该控制溶液的pH为___________ 。
A.<1 B.4左右 C.>6
(3)在Ni(OH)2溶液中含有少量的Co2+杂质,___________ (填“能”或“不能”)通过调节溶液pH的方法来除去,理由是___________ 。
(4)要使氢氧化铜沉淀溶解,除了加入酸之外,还可以加入氨水,生成[Cu(NH3)4]2+,写出反应的离子方程式___________ 。
(5)已知一些难溶物的溶度积常数如下表:
某工业废水中含有Cu2+、Pb2+、Hg2+,最适宜向此工业废水中加入过量的___________ 除去它们。(选填序号)
A.NaOH B.FeS C.Na2S

(1)pH=3时溶液中铜元素的主要存在形式是
(2)若要除去CuCl2溶液中的少量Fe3+,应该控制溶液的pH为
A.<1 B.4左右 C.>6
(3)在Ni(OH)2溶液中含有少量的Co2+杂质,
(4)要使氢氧化铜沉淀溶解,除了加入酸之外,还可以加入氨水,生成[Cu(NH3)4]2+,写出反应的离子方程式
(5)已知一些难溶物的溶度积常数如下表:
| 物质 | FeS | MnS | CuS | PbS | HgS | ZnS |
| Ksp | 6.3×10-18 | 2.5×10-13 | 1.3×10-36 | 3.4×10-28 | 6.4×10-53 | 1.6×10-24 |
某工业废水中含有Cu2+、Pb2+、Hg2+,最适宜向此工业废水中加入过量的
A.NaOH B.FeS C.Na2S
【知识点】 难溶电解质的溶解平衡 溶度积规则及其应用解读
您最近一年使用:0次
2022-01-17更新
|
346次组卷
|
13卷引用:2010—2011学年辽宁省北镇高中高二上学期期末考试化学试卷
(已下线)2010—2011学年辽宁省北镇高中高二上学期期末考试化学试卷(已下线)同步君 选修4 第3章第4节 难溶电解质的溶解平衡高中化学人教版 选修四 第三章 水溶液中的离子反应 第四节 难溶电解质的溶解平衡 难溶电解质的溶解平衡甘肃省高台县第一中学2018-2019学年高二上学期期中考试化学试题人教版高二化学选修4 第三章 第四节 难溶电解质的溶解平衡练习题(已下线)2019年11月24日《每日一题》高二化学人教版(选修4)—— 每周一测鲁科版(2019)选择性必修1第3章 物质在水溶液中的行为 第3节综合训练高中必刷题高二选择性必修1第三章 水溶液中的离子反应与平衡 第四节综合训练人教版(2019)高二选择性必修第一册 第三章 水溶液中的离子反应与平衡 第四节 沉淀溶解平衡 作业帮选择性必修1 专题3 第四单元综合训练(已下线)3.4.2 沉淀溶解平衡原理的应用(备作业)-【上好课】2021-2022学年高二化学同步备课系列(苏教版2019选择性必修1)福建省三明第一中学2021-2022学年高二上学期第二次月考化学试题四川省绵阳市盐亭中学2021-2022学年高二下学期第三次月考化学试题
五、解答题 添加题型下试题
解答题-实验探究题
|
适中(0.65)
10. 盐泥是氯碱工业中的废渣,主要成分是镁的硅酸盐和碳酸盐(含少量铁、铝、钙的盐)。实验室以盐泥为原料制取MgSO4•7H2O的实验过程如下:
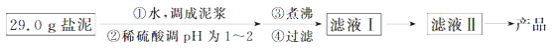
已知:①室温下Ksp[Mg(OH)2]=6.0×10﹣12.②在溶液中,Fe2+、Fe3+、Al3+从开始沉淀到沉淀完全的pH范围依次为7.1~9.6、2.0~3.7、3.1~4.7.③三种化合物的溶解度(S)随温度变化的曲线如图所示.
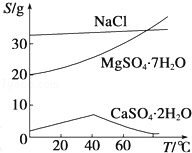
(1)在盐泥中加入稀硫酸调pH为1~2以及煮沸的目的是___________________ ;
(2)若室温下的溶液中Mg2+的浓度为6.0mol•L﹣1,则溶液pH≥___________ 才可能产生Mg(OH)2沉淀;
(3)由滤液Ⅰ到滤液Ⅱ需先加入NaClO调溶液pH约为5,再趁热过滤,则趁热过滤的目的是_______________ ,滤渣的主要成分是_________________ ;
(4)从滤液Ⅱ中获得MgSO4•7H2O晶体的实验步骤依次为①向滤液Ⅱ中加入_________ ;②过滤,得沉淀;③_____________ ;④蒸发浓缩,降温结晶;⑤过滤、洗涤得产品;
(5)若获得的MgSO4•7H2O的质量为24.6g,则该盐泥中镁[以Mg(OH)2计]的百分含量约为_______ (MgSO4•7H2O的相对分子质量为246);
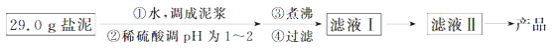
已知:①室温下Ksp[Mg(OH)2]=6.0×10﹣12.②在溶液中,Fe2+、Fe3+、Al3+从开始沉淀到沉淀完全的pH范围依次为7.1~9.6、2.0~3.7、3.1~4.7.③三种化合物的溶解度(S)随温度变化的曲线如图所示.

(1)在盐泥中加入稀硫酸调pH为1~2以及煮沸的目的是
(2)若室温下的溶液中Mg2+的浓度为6.0mol•L﹣1,则溶液pH≥
(3)由滤液Ⅰ到滤液Ⅱ需先加入NaClO调溶液pH约为5,再趁热过滤,则趁热过滤的目的是
(4)从滤液Ⅱ中获得MgSO4•7H2O晶体的实验步骤依次为①向滤液Ⅱ中加入
(5)若获得的MgSO4•7H2O的质量为24.6g,则该盐泥中镁[以Mg(OH)2计]的百分含量约为
您最近一年使用:0次
2016-12-09更新
|
523次组卷
|
9卷引用:2013届江苏省苏北三市高三第二次调研测试化学试卷
(已下线)2013届江苏省苏北三市高三第二次调研测试化学试卷(已下线)2014高考化学二轮专题突破 专题三溶液组成的计量及其应用练习卷2016届山西省榆社中学高三上学期10月月考化学试卷2016届江苏省南通市天星湖中学高三上学期第一次阶段测化学试卷四川省资阳市2016-2017学年高二下学期期末考试化学试题鲁科版(2019)选择性必修1第3章 物质在水溶液中的行为 第3节综合训练高中必刷题高二选择性必修1第三章 水溶液中的离子反应与平衡 第四节综合训练选择性必修1 专题3 第四单元综合训练2019年秋高三化学复习强化练习——化学计量
试卷分析
整体难度:适中
考查范围:化学反应原理、化学实验基础、常见无机物及其应用
试卷题型(共 10题)
题型
数量
单选题
4
多选题
3
解答题
2
填空题
1
试卷难度
细目表分析 导出
| 题号 | 难度系数 | 详细知识点 | 备注 |
| 一、单选题 | |||
| 1 | 0.4 | 影响水电离的因素 盐溶液中微粒间的电荷守恒、物料守恒、质子守恒原理 溶度积常数相关计算 | |
| 2 | 0.65 | 难溶电解质的溶解平衡 沉淀溶解平衡的应用 溶度积定义及表达式 溶度积规则及其应用 | |
| 3 | 0.65 | 化学平衡状态 化学反应条件的控制及优化 溶度积 溶度积常数相关计算 | |
| 4 | 0.4 | 难溶电解质的溶解平衡 沉淀溶解平衡的应用 溶度积定义及表达式 溶度积常数相关计算 | |
| 二、多选题 | |||
| 5 | 0.65 | 沉淀溶解平衡的应用 溶度积定义及表达式 溶度积规则及其应用 溶度积常数相关计算 | |
| 6 | 0.65 | 沉淀溶解平衡的应用 沉淀的溶解与生成 沉淀转化 物质分离、提纯综合应用 | |
| 7 | 0.65 | 难溶电解质的溶解平衡 沉淀溶解平衡的应用 温度对难溶电解质溶解平衡的影响 溶度积规则及其应用 | |
| 三、解答题 | |||
| 8 | 0.65 | 难溶电解质的溶解平衡 沉淀溶解平衡的应用 温度对难溶电解质溶解平衡的影响 | 原理综合题 |
| 10 | 0.65 | 含氧化铝的混合物的提纯 物质分离、提纯综合应用 常见无机物的制备 | 实验探究题 |
| 四、填空题 | |||
| 9 | 0.65 | 难溶电解质的溶解平衡 溶度积规则及其应用 | |



