(1) CH3OCH3和O2发生反应I:CH3OCH3(g)+
 O2(g)=2CO(g)+3H2(g)△H
O2(g)=2CO(g)+3H2(g)△H已知:CH3OCH3(g)
 CO(g)+H2(g)+CH4(g)△H1
CO(g)+H2(g)+CH4(g)△H1CH4(g)+
 O2(g)=CO(g)+2H2O (g)△H2
O2(g)=CO(g)+2H2O (g)△H2H2(g)+
 O2(g)=H2O (g)△H3
O2(g)=H2O (g)△H3①则反应I的△H=
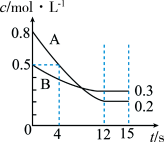
②保持温度和压强不变,分别按不同进料比通入CH3OCH3和O2,发生反应I。测得平衡时H2的体积百分含量与进料气中n(O2)/n(CH3OCH3)的关系如图所示。当
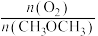 >0.6时,H2的体积百分含量快速降低,其主要原因是
>0.6时,H2的体积百分含量快速降低,其主要原因是
A.过量的O2起稀释作用
B.过量的O2与H2发生副反应生成H2O
C.
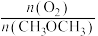 >0.6平衡向逆反应方向移动
>0.6平衡向逆反应方向移动(2)T℃时,在恒容密闭容器中通入CH3OCH3,发生反应II:CH3OCH3(g)
 CO(g)+H2(g)+CH4(g),测得容器内初始压强为41.6 kPa,反应过程中反应速率v(CH3OCH3)时间t与CH3OCH3分压P(CH3OCH3)的关系如图所示。
CO(g)+H2(g)+CH4(g),测得容器内初始压强为41.6 kPa,反应过程中反应速率v(CH3OCH3)时间t与CH3OCH3分压P(CH3OCH3)的关系如图所示。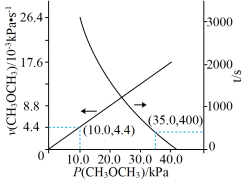
①t=400 s时,CH3OCH3的转化率为
②达到平衡时,测得体系的总压强P总= 121.6 kPa,则该反应的平衡常数Kp=
③该温度下,要缩短达到平衡所需的时间,除改进催化剂外,还可采取的措施是
相似题推荐
 可用于合成多种化工原料。用
可用于合成多种化工原料。用 生产绿色燃料甲醇时发生反应A:
生产绿色燃料甲醇时发生反应A:
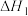
(1)反应A的平衡常数表达式是
(2)已知:
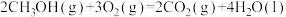

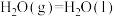
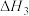
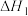 不易直接测得,为了通过
不易直接测得,为了通过 和
和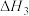 计算得
计算得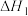 ,还需测定如下反应的反应热:
,还需测定如下反应的反应热:(3)在体积为1L的恒容密闭容器中发生反应A,如图是在三种投料,即[n(CO2),n(H2)]分别为:[1mol,3mol]、[1mol,4mol]、[1mol,6mol]下,反应温度对
 平衡转化率影响的曲线。
平衡转化率影响的曲线。
①反应A的
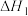
②曲线c对应的投料是
③
 ℃时,曲线c对应的化学平衡常数
℃时,曲线c对应的化学平衡常数(4)甲醇燃料电池(NaOH作电解质溶液)负极的电极方程式为
(5)在一定条件下,利用
 合成
合成 的反应过程中会有副反应:
的反应过程中会有副反应: 。压强一定时,将初始投料比一定的
。压强一定时,将初始投料比一定的 和
和 按一定流速通过催化剂甲,经过相同时间(反应均未达到平衡)时,温度对
按一定流速通过催化剂甲,经过相同时间(反应均未达到平衡)时,温度对 、CO的产率影响如图1所示,温度对
、CO的产率影响如图1所示,温度对 的转化率影响如图2所示。
的转化率影响如图2所示。
由图象可知,升高温度,
 的实际转化率提高而甲醇的产率降低,其原因是
的实际转化率提高而甲醇的产率降低,其原因是 含量的控制和
含量的控制和 资源利用具有重要意义。
资源利用具有重要意义。(1)燃煤烟气中
 的捕集可通过如下所示的物质转化实现。
的捕集可通过如下所示的物质转化实现。
 溶液与石灰乳反应的化学方程式为
溶液与石灰乳反应的化学方程式为②载人航天器内,常用
 固体而很少用
固体而很少用 固体吸收空气中的
固体吸收空气中的 ,其原因是
,其原因是(2)电化学法还原二氧化碳,不仅能缓解温室效应还能得到乙烯。
①已知:
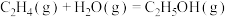
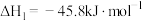

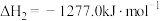
则
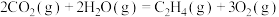


②电化学法还原二氧化碳为乙烯原理如图所示。

③铜作阴极能提高还原产物乙烯的选择性,水溶液中二氧化碳在铜表面还原为乙烯的机理如图所示(参与反应的水分子及其它生成微粒未画出)。下列有关说法不正确的是

B.二氧化碳还原产物有甲烷和乙烯
C.两个反应历程都是先加氢再除氧
D.两个反应历程都出现碳氧键的断裂与碳碳键的形成
(1)下列变化过程,属于放热反应的是
①浓
 稀释;②酸碱中和反应:③
稀释;②酸碱中和反应:③ 在
在 中燃烧;④
中燃烧;④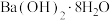 与
与 ;⑤铝热反应:⑧碳高温条件下还原
;⑤铝热反应:⑧碳高温条件下还原 ;⑦碳酸钙分解
;⑦碳酸钙分解(2)已知:①
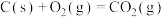
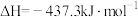
②

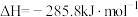
③
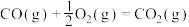
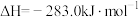
则固态碳和水蒸气反应生成CO和
 的热化学方程式为
的热化学方程式为(3)通常人们把拆开1mol某化学键吸收的能量看成该化学键的键能。表中是一些化学键的键能。
| 化学键 | C-H | C-F | H-F | F-F |
| 键能kJ/mol | 414 | 489 | 565 | 155 |
 的反应热
的反应热 为
为(4)已知稀溶液中,
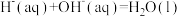
 。
。①则稀醋酸与稀氢氧化钠溶液反应生成1mol水时放出的热量比57.3kJ

 (填“>”“=”或“<”)。
(填“>”“=”或“<”)。②某化学兴趣小组用50mL
 盐酸、50mL
盐酸、50mL  NaOH溶液进行中和热测定,计算结果
NaOH溶液进行中和热测定,计算结果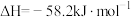 ,其原因可能是:
,其原因可能是:A.盐酸与NaOH溶液混合后立即记录温度
B.分三次将盐酸溶液缓慢倒入NaOH溶液中
C.用量筒量取NaOH溶液时仰视读数
D.使用环形玻璃棒搅拌
③标准状况下,3.36L 仅由C、H两种元素组成的某气体质量为4.5g,在25℃和101kPa下完全燃烧生成
 和
和 时,放出233.97kJ的热量。该气体的分子式为
时,放出233.97kJ的热量。该气体的分子式为④2022年北京冬奥会将用绿氢(
 )作为火炬燃料,以太阳能为热源,热化学硫碘循环分解水是一种高效、无污染的制氢方法。其反应过程如下图所示:
)作为火炬燃料,以太阳能为热源,热化学硫碘循环分解水是一种高效、无污染的制氢方法。其反应过程如下图所示: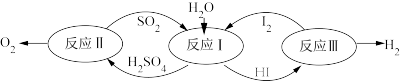
反应Ⅰ:
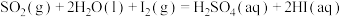

反应Ⅱ:
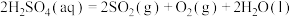
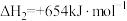
反应Ⅲ:
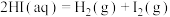
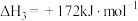
则反应
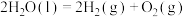

(2)锌与盐酸反应过程中,如果反应太激烈,为了减缓反应速率而又不减少产生氢气的量,他在盐酸中分别加入等体积的下列溶液,你认为可行的是
A.CH3COONa B.NaNO3溶液 C.KCl溶液 D.Na2CO3溶液
(3)为了验证Fe3+与Cu2+氧化性强弱,下列装置能达到实验目的是

(4)氢氧燃料电池,是一种高效无污染的清洁电池它分碱性(用KOH做电解质)和酸性(用硫酸做电解质)氢氧燃料电池;
①如果是碱性燃料电池则负极反应方程式是:
②如果是酸性燃料电池则正极反应方程式是:
(1)合成氨反应N2(g)+3H2(g)
 2NH3(g),若在恒温、恒压条件下向平衡体系中通入氩气,平衡
2NH3(g),若在恒温、恒压条件下向平衡体系中通入氩气,平衡(2)已知:O2(g) = O2+(g)+e-
 H1=+1175.7 kJ·mol-1
H1=+1175.7 kJ·mol-1PtF6(g)+e-=PtF6-(g)
 H2=-771.1 kJ·mol-1
H2=-771.1 kJ·mol-1O2PtF6(S)=O2+(g)+PtF6-(g)
 H3=+482.2 kJ·mol-1
H3=+482.2 kJ·mol-1则反应O2(g)+PtF6(g) = O2+PtF6-(s)的
 H=
H=(3)一定温度下在恒容密闭容器中N2O5可发生下列反应:2N2O5(g)
 4NO2(g)+O2(g) △H>0
4NO2(g)+O2(g) △H>0①反应达到平衡后若再通入一定量氦气,则N2O5的转化率将
②下表为反应在T1温度下的部分实验数据:
| 时间/s | 0 | 500 | 1000 |
| c(N2O5)/mol·L—1 | 5.00 | 3.52 | 2.48 |
则500s内N2O5的分解速率为
③在T2温度下,反应1000s时测得NO2的浓度为4.98mol·L—1,则T2
(1)氨热分解法制氢气
相关化学键的键能数据
| 化学键 | N≡N | H-H | N-H |
| 键能E/(kJ•mol-1) | 946 | 436.0 | 390.8 |
反应2NH3(g)⇌N2(g)+3H2(g) △H=
(2)用NH3可消除NO污染,反应原理为:4NH3+6NO
 5N2+6H2O,以n(NH3):n(NO)分别为4:1、3:1、1:3投料,得到NO脱除率随温度变化的曲线如图所示:
5N2+6H2O,以n(NH3):n(NO)分别为4:1、3:1、1:3投料,得到NO脱除率随温度变化的曲线如图所示:
①曲线a对应的n(NH3):n(NO)=
②曲线c中NO的起始浓度为4×10-4mg/m3,从A点到B点经过0.8s,该时间段内NO的脱除速率为
③由图可知,无论以何种比例反应,在温度超过900℃时NO脱除率都会骤然下降,可能的原因是
(3)利用电解原理,将氨转化为高纯氢气,其装置如图所示。

①电解过程中OH-的移动方向为
②阳极的电极反应式为
(1)氨气是一种重要的化工原料,氨态氮肥是常用的肥料。写出实验室制备氨气的化学方程式
(2)已知几种物质的相对能量如下:
物质 |
|
|
|
|
相对能量/ | 475.5 | 283.0 | 393.5 | 0 |
 和
和 反应生成
反应生成 和
和 的热化学方程式为
的热化学方程式为(3)一定温度下,向恒容密闭容器中充入2mol
 和3mol
和3mol ,发生反应:
,发生反应:
 。测得
。测得 体积分数与温度、时间的关系如图1所示。
体积分数与温度、时间的关系如图1所示。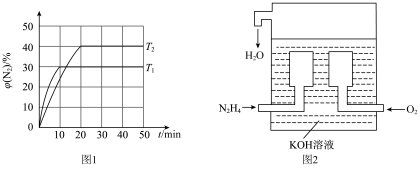
①

②下列情况表明该反应达到平衡状态的是
A.混合气体的密度不再改变 B.相对分子质量不再改变
C.NO和
 的消耗速率相等 D.
的消耗速率相等 D. 的体积分数不再改变
的体积分数不再改变③
 时,该反应的平衡常数K=
时,该反应的平衡常数K=(4)
 —空气燃料电池是一种高效低污染的新型电池,其内部结构示意如图2所示。通入
—空气燃料电池是一种高效低污染的新型电池,其内部结构示意如图2所示。通入 (肼)的一极为
(肼)的一极为(1)已知汽车气缸中氮及其化合物发生如下反应:
 △H=+180 kJ/mol
△H=+180 kJ/mol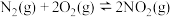 △H=+68 kJ/mol
△H=+68 kJ/mol 写出NO与O2反应生成NO2的热化学方程式
(2)利用反应
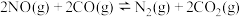 △H <0,可实现汽车尾气的无害化处理,一定条件下的密闭容器中,充入1 mol CO和1 mol NO,发生上述反应,图1为平衡时NO的体积分数与温度、压强的关系。
△H <0,可实现汽车尾气的无害化处理,一定条件下的密闭容器中,充入1 mol CO和1 mol NO,发生上述反应,图1为平衡时NO的体积分数与温度、压强的关系。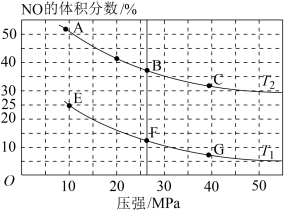
①下列说法正确的是
A.当容器内各组分浓度c(NO):c(CO):c(N2):c(CO2)=2:2:1:2时,体系达到平衡
B.图象中B点正反应速率大于F点正反应速率
C.当温度、压强一定时,在原料气中加入少量稀有气体,有利于提高反应物平衡转化率
D.低温有利于提高NO的平衡转化率
②压强为20 MPa、温度为T2下,若反应进行到20 min达到平衡状态,此时容器的体积为4 L,该温度下平衡常数K=
③该反应达到平衡后,为提高反应速率同时提高NO的转化率,可采取的措施有
a.增大NO浓度 b.压缩容器体积 c.移去部分N2 d.改用高效催化剂
④在相同条件下,提高CO浓度有利于增加脱氮率。现在一密闭容器中,恒温恒容条件下发生上述反应,请在图中画出平衡时N2体积分数随起始
 变化的总趋势
变化的总趋势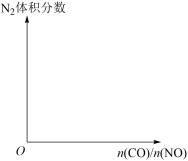
(3)在一定实验条件下模拟该反应,测得NO的平衡转化率随着起始
 投料增加而增大,但随着温度的升高,不同投料比下CO的平衡转化率趋于相近的原因为
投料增加而增大,但随着温度的升高,不同投料比下CO的平衡转化率趋于相近的原因为(1)探究反应条件对
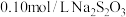 溶液与
溶液与 稀
稀 反应速率的影响。反应方程式为:
反应速率的影响。反应方程式为: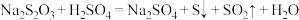 。设计测定结果如下:
。设计测定结果如下:| 编号 | 反应温度 |  溶液 溶液 | 水 |  溶液 溶液 | 乙 |
| ① | 25 | 10.0 | 0 | 10.0 | x |
| ② | 25 | 5.0 | a | 10.0 | y |
| ③ | 40 | 10.0 | 0 | 10.0 | z |
若上述实验①②是探究
 的浓度对化学反应速率的影响,则a为
的浓度对化学反应速率的影响,则a为(2)氨气具有广泛的用途,工业上合成氨的反应是
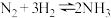 已知:
已知:| 化学键 |  |  |  |
键能 (断开 (断开 化学键所需要的能量) 化学键所需要的能量) | 436 | 945 | 391 |
①则合成氨的热化学方程式是
②一定温度下,在一个容积固定的密闭容器中若反应起始时
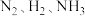 的浓度分别为
的浓度分别为 、
、 、
、 ,达到平衡时
,达到平衡时 浓度
浓度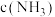 的取值范围是
的取值范围是 。
。(3)已知
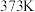 时,该可逆反应平衡常数为
时,该可逆反应平衡常数为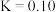 ,若某时刻时,测得
,若某时刻时,测得 ,
,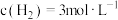 ,
,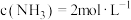 。此刻可逆反应
。此刻可逆反应A.向正方向进行 B.向逆方向进行 C.处于平衡状态
(4)在固定体积的密闭容器中,进行如下化学反应:
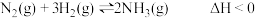 。已知平衡常数K与温度T的关系如表:
。已知平衡常数K与温度T的关系如表: | 400 | 300 |
| 平衡常数K |  |  |
①判断

 (填写“>”“=”或“<”)
(填写“>”“=”或“<”)②合成氨在农业和国防中有很重要的意义,在实际工业生产中,常采用下列措施,其中可以用勒夏特列原理解释的是
A.采用较高温度
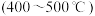 B.将生成的氨液化并及时从体系中分离出来
B.将生成的氨液化并及时从体系中分离出来C.用铁触媒加快化学反应速率 D.采用较高压强
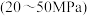
 (g)
(g)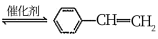 (g)+H2(g) △H=+QkJ·mol-1
(g)+H2(g) △H=+QkJ·mol-1请回答下列问题:
(1)已知乙苯(g)、苯乙烯(g)的燃烧热分别为a kJ·mol-1、bkJ·mol-1,则氢气的燃烧热为
(2)673 K时,在一恒容密闭容器中充入5 mol乙苯(g),反应达到平衡后容器内气体的压强为p1;若再充入amol的乙苯(g),重新达到平衡后容器内气体的压强为2p1,则a
(3)在实际生产中,在恒压条件下常以高温水蒸气作为反应体系的稀释剂(水蒸气不参加反应),此时乙苯的平衡转化率与水蒸气的用量、压强(p)的关系如图所示。
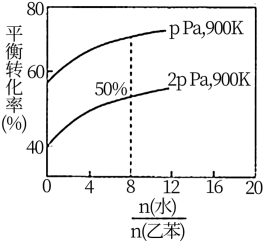
①加入水蒸气稀释剂能提高乙苯转化率的原因是
②在实际生产过程中,当控制反应温度为900 K时生产效率最佳,选用此温度进行生产的原因为
③用平衡分压代替平衡浓度计算,其中,分压=总压×物质的量分数,则900K时的平衡常数Kp=
④改变下列条件,能使乙苯的反应速率和转化率一定增大的是
A.恒容时加入稀释剂水蒸气 B.压强不变下,温度升至1500 K
C.在容积和温度不变下充入Ar D.选用催化效果更好的催化剂
(4)已知苯乙烯可催化氧化生成苯乙醛:
 (g) + 2O2→
(g) + 2O2→ + CO2 + H2O,若把该反应设计为酸性燃料电池,则电池负极的电极反应式为
+ CO2 + H2O,若把该反应设计为酸性燃料电池,则电池负极的电极反应式为【推荐2】先进的甲醇低压羰基合成乙酸工艺的普及推广,导致我国乙酸产能过剩。使用特定催化剂进行乙酸直接加氢制备乙醇的反应原理如下:
主反应:CH3COOH(g)+2H2(g) CH3CH2OH(g)+H2O(g) △H1
CH3CH2OH(g)+H2O(g) △H1
副反应:CH3COOH(g)+CH3CH2OH(g) CH3CH2OOCCH3(g)+H2O(g) △H2<0
CH3CH2OOCCH3(g)+H2O(g) △H2<0
副反应的反应热绝对值远远小于主反应的反应热绝对值。
(1)一定温度下,将1molCH3COOH(g)、5molH2(g)通入到恒压密闭容器电(不考虑副反应)。达到平衡时,H2的转化率为4%,该反应放热akJ。则该温度下主反应的△H1=
(2)250℃下,恒压密闭容器中充入一定量H2(g)和CH3COOH(g)(不考虑副反应),下列条件不能判断反应达到平衡状态的是
| A.混合气体的密度保持不变 |
| B.混合气体的总质量保持不变 |
| C.H2O的体积分数不变 |
| D.n(H2):n(CH3CH2OH)=2:1,且保持不变 |
(3)已知:I.S表示选择性,且主反应产物的选择性往往大于副反应产物的选择性
II.S(乙醇)=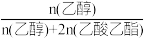 ×100%
×100%
在n(H2):n(CH3COOH)=10时:2MPa下,平衡时S(乙醇)和S(乙酸乙酯)随温度的变化;250℃下,平衡时S(乙醇)和S(乙酸乙酯)随压强的变化均如图所示。
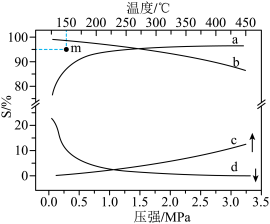
①250℃下,乙醇选择性随压强变化的曲线是
②曲线b是乙醇选择性随温度变化的曲线,曲线b变化的原因是
③150℃,在催化剂作用下和CH3COOH反应一段时间后,乙醇的选择性位于m点,不改变反应时间和温度,一定能提高乙醇选择性的措施
(4)一定温度和恒定压强下,向初始体积为1L容积可变的密闭容器中通入2molH2和1molCH3COOH,同时发生主反应和副反应,测得平衡时n[H2O(g)]=0.8mol,体系中气体物质的堡减小20%,则平衡时,c(H2)=
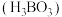 在食品、医药领域应用广泛。
在食品、医药领域应用广泛。(1)硼在元素周期表中的位置
(2)请完成
 气体与水反应的化学方程式:
气体与水反应的化学方程式:
(3)在其他条件相同时,反应
 中,
中, 的转化率
的转化率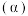 在同温度下随反应时间
在同温度下随反应时间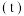 的变化见图,由此可得出:
的变化见图,由此可得出:
①温度对该反应的反应速率和平衡移动的影响是
②该反应的

(4)
 溶液中存在如下反应:
溶液中存在如下反应: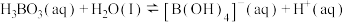 ,已知
,已知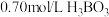 溶液中,上述反应于
溶液中,上述反应于 达到平衡时,
达到平衡时,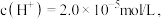
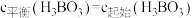 ,水的电离可忽略不计,此温度下该反应的平衡常数
,水的电离可忽略不计,此温度下该反应的平衡常数
 的平衡浓度不列入K的表达式中,计算结果保留两位有效数字)。
的平衡浓度不列入K的表达式中,计算结果保留两位有效数字)。(5)已知室温下,
 的电离常数为
的电离常数为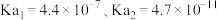 。向盛有饱和硼酸溶液的试管中,滴加
。向盛有饱和硼酸溶液的试管中,滴加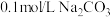 溶液,
溶液,(6)
 与足量
与足量 溶液反应的离子方程式为
溶液反应的离子方程式为


