铁及其化合物在生产、生活中应用广泛。
(1)已知: ①3Fe(s)+4H2O(g)=Fe3O4(s)+4H2(g) △H1=a kJ·mol-1;
②2H2(g)+O2(g)=2H2O(1) △H2=b kJ·mol-1
③H2O(g)=H2O(l) △H3=c kJ·mol-1
则3Fe(s)+2O2(g))=Fe3O4(s)△H=_________ kJ·mol-1(用含 a、b、c 的代数式表示)。
(2)活性铁粉是合成氨气的催化剂。工业合成氨的原理为N2+3H2 2NH3 △H<0
2NH3 △H<0
①工业采用“高压”一般为20~50MPa,温度为 500℃。采用“温度为 500℃”的目的是____________ ;
②氨气是合成氮肥的重要原料。常温下,0.1mol·L-1(NH4)2SO4溶液中离子浓度大小排序为___________ ;
③常温下,向a mL c mol·L-1氨水中滴加b mL c mol·L-1稀硝酸恰好至溶液pH=7(溶液体积变化忽略不计),则NH3·H2O的电离常数Kb=___ ;
(3)工业上用热还原法冶炼铁。在密闭容器中,投入足量的 FeO 粉末和炭粉,在一定温度下发生反应:FeO(s)+C(s)⇌Fe(s)+CO(g) △H>0;
①若容积恒定,则下列情况表明上述反应达到平衡状态的是___________ (填代号)
A.FeO 的浓度不再改变 B.气体相对分子质量不再改变 C.气体密度不再改变 D.铁粉的质量不再改变
②在该温度下,上述反应达到平衡时c(CO)=a mol·L-1,则该反应的平衡常数为________ ;在温度不变时,将容器体积扩大至原来的4倍,则达到新平衡时,c(CO)为_____________ 。
(1)已知: ①3Fe(s)+4H2O(g)=Fe3O4(s)+4H2(g) △H1=a kJ·mol-1;
②2H2(g)+O2(g)=2H2O(1) △H2=b kJ·mol-1
③H2O(g)=H2O(l) △H3=c kJ·mol-1
则3Fe(s)+2O2(g))=Fe3O4(s)△H=
(2)活性铁粉是合成氨气的催化剂。工业合成氨的原理为N2+3H2
 2NH3 △H<0
2NH3 △H<0①工业采用“高压”一般为20~50MPa,温度为 500℃。采用“温度为 500℃”的目的是
②氨气是合成氮肥的重要原料。常温下,0.1mol·L-1(NH4)2SO4溶液中离子浓度大小排序为
③常温下,向a mL c mol·L-1氨水中滴加b mL c mol·L-1稀硝酸恰好至溶液pH=7(溶液体积变化忽略不计),则NH3·H2O的电离常数Kb=
(3)工业上用热还原法冶炼铁。在密闭容器中,投入足量的 FeO 粉末和炭粉,在一定温度下发生反应:FeO(s)+C(s)⇌Fe(s)+CO(g) △H>0;
①若容积恒定,则下列情况表明上述反应达到平衡状态的是
A.FeO 的浓度不再改变 B.气体相对分子质量不再改变 C.气体密度不再改变 D.铁粉的质量不再改变
②在该温度下,上述反应达到平衡时c(CO)=a mol·L-1,则该反应的平衡常数为
更新时间:2020-07-04 10:02:03
|
相似题推荐
解答题-原理综合题
|
适中
(0.65)
名校
【推荐1】天然气的主要成分为CH4,一般还含有C2H6(乙烷)等,是重要的燃料和化工原料。
(1)乙烷在一定条件可发生如下反应:C2H6(g)⇌C2H4(g)+H2(g) ΔH,若容器中通入等物质的量的乙烷和氢气,在等压下(p)发生上述反应,乙烷的平衡转化率为α。反应的平衡常数Kp=_______ (用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(2)高温下,甲烷生成乙烷的反应如下:2CH4 C2H6+H2.反应在初期阶段的速率方程为:r=k×c(CH4),其中k为反应速率常数。
C2H6+H2.反应在初期阶段的速率方程为:r=k×c(CH4),其中k为反应速率常数。
①设反应开始时的反应速率为r1,甲烷的转化率为α时的反应速率为r2,则r2=_______ r1。
②对于处于初期阶段的该反应,下列说法正确的是_______ 。
A.增加甲烷浓度,r增大 B.增加H2浓度,r增大
C.乙烷的生成速率逐渐增大 D.降低反应温度,k减小
(3)CH4和CO2都是比较稳定的分子,科学家利用电化学装置实现两种分子的耦合转化,其原理如图所示:
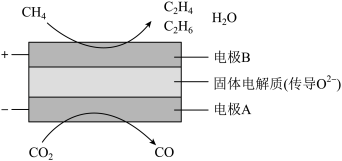
①阴极上的反应式为_______ 。
②若生成的乙烯(C2H4)和乙烷(C2H6)的体积比为2:1,则消耗的CH4和CO2体积比为_______ 。
(1)乙烷在一定条件可发生如下反应:C2H6(g)⇌C2H4(g)+H2(g) ΔH,若容器中通入等物质的量的乙烷和氢气,在等压下(p)发生上述反应,乙烷的平衡转化率为α。反应的平衡常数Kp=
(2)高温下,甲烷生成乙烷的反应如下:2CH4
 C2H6+H2.反应在初期阶段的速率方程为:r=k×c(CH4),其中k为反应速率常数。
C2H6+H2.反应在初期阶段的速率方程为:r=k×c(CH4),其中k为反应速率常数。①设反应开始时的反应速率为r1,甲烷的转化率为α时的反应速率为r2,则r2=
②对于处于初期阶段的该反应,下列说法正确的是
A.增加甲烷浓度,r增大 B.增加H2浓度,r增大
C.乙烷的生成速率逐渐增大 D.降低反应温度,k减小
(3)CH4和CO2都是比较稳定的分子,科学家利用电化学装置实现两种分子的耦合转化,其原理如图所示:

①阴极上的反应式为
②若生成的乙烯(C2H4)和乙烷(C2H6)的体积比为2:1,则消耗的CH4和CO2体积比为
您最近一年使用:0次
【推荐2】中国科学家首次实现了二氧化碳到淀粉的从头合成,相关成果由国际知名学术期刊《科学》在线发表,因此 的捕集、利用与封存成为科学家研究的重要课题。
的捕集、利用与封存成为科学家研究的重要课题。
以 、
、 为原料合成
为原料合成 涉及的主要反应如下:
涉及的主要反应如下:
Ⅰ.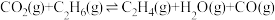
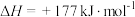 (主反应)
(主反应)
Ⅱ.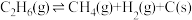
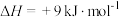 (副反应)
(副反应)
(1)反应Ⅰ的反应历程可分为如下两步:
i.
 (反应速率较快)
(反应速率较快)
ii.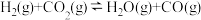
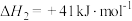 (反应速率较慢)
(反应速率较慢)
①
_______  。
。
②相比于提高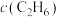 ,提高
,提高 对反应Ⅰ速率影响更大,原因是
对反应Ⅰ速率影响更大,原因是_______ 。
(2)向恒压密闭容器中充入 和
和 合成
合成 ,发生主反应,温度对催化剂
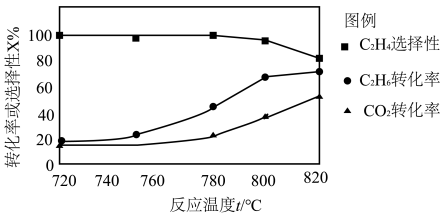
,发生主反应,温度对催化剂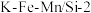 性能的影响如图所示,工业生产中综合各方面的因素后,反应选择800℃的原因是
性能的影响如图所示,工业生产中综合各方面的因素后,反应选择800℃的原因是_______ 。
(3)在800℃时,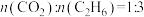 ,充入一定容积的密闭容器中,在有催化剂存在的条件下,只发生主反应,初始压强为
,充入一定容积的密闭容器中,在有催化剂存在的条件下,只发生主反应,初始压强为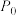 ,一段时间达到平衡,产物的物质的量之和与剩余反应物的物质的量之和相等,该温度下反应的平衡常数
,一段时间达到平衡,产物的物质的量之和与剩余反应物的物质的量之和相等,该温度下反应的平衡常数
_______ (用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(4)工业上也可用甲烷催化法制取乙烯,只发生如下反应: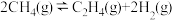
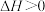 。
。
①在恒容绝热的容器中进行上述反应,下列不能用来判断达到平衡状态的是_______ (填字母)。
A.混合气体的平均相对分子质量不再改变
B.容器中压强不再改变
C.混合气体的密度不再改变
D.反应物的消耗量与任一产物的生成量的比值为一定值
②温度T时,向2L的恒容反应器中充入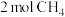 ,仅发生上述反应,反应过程中
,仅发生上述反应,反应过程中 的物质的量随时间变化如图所示:
的物质的量随时间变化如图所示:
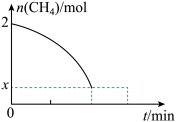
实验测得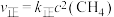 ,
,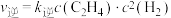 ,
, 、
、 为速率常数,只与温度有关,T温度时
为速率常数,只与温度有关,T温度时
_______ (用含有 的代数式表示);当温度升高时,
的代数式表示);当温度升高时, 增大m倍,
增大m倍, 增大n倍,则m
增大n倍,则m_______ (填“>”“<”或“=”)n。
 的捕集、利用与封存成为科学家研究的重要课题。
的捕集、利用与封存成为科学家研究的重要课题。以
 、
、 为原料合成
为原料合成 涉及的主要反应如下:
涉及的主要反应如下:Ⅰ.
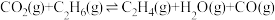
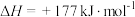 (主反应)
(主反应)Ⅱ.
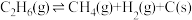
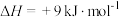 (副反应)
(副反应)(1)反应Ⅰ的反应历程可分为如下两步:
i.

 (反应速率较快)
(反应速率较快)ii.
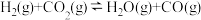
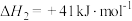 (反应速率较慢)
(反应速率较慢)①

 。
。②相比于提高
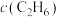 ,提高
,提高 对反应Ⅰ速率影响更大,原因是
对反应Ⅰ速率影响更大,原因是(2)向恒压密闭容器中充入
 和
和 合成
合成 ,发生主反应,温度对催化剂
,发生主反应,温度对催化剂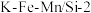 性能的影响如图所示,工业生产中综合各方面的因素后,反应选择800℃的原因是
性能的影响如图所示,工业生产中综合各方面的因素后,反应选择800℃的原因是
(3)在800℃时,
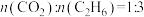 ,充入一定容积的密闭容器中,在有催化剂存在的条件下,只发生主反应,初始压强为
,充入一定容积的密闭容器中,在有催化剂存在的条件下,只发生主反应,初始压强为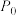 ,一段时间达到平衡,产物的物质的量之和与剩余反应物的物质的量之和相等,该温度下反应的平衡常数
,一段时间达到平衡,产物的物质的量之和与剩余反应物的物质的量之和相等,该温度下反应的平衡常数
(4)工业上也可用甲烷催化法制取乙烯,只发生如下反应:
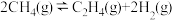
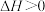 。
。①在恒容绝热的容器中进行上述反应,下列不能用来判断达到平衡状态的是
A.混合气体的平均相对分子质量不再改变
B.容器中压强不再改变
C.混合气体的密度不再改变
D.反应物的消耗量与任一产物的生成量的比值为一定值
②温度T时,向2L的恒容反应器中充入
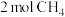 ,仅发生上述反应,反应过程中
,仅发生上述反应,反应过程中 的物质的量随时间变化如图所示:
的物质的量随时间变化如图所示:
实验测得
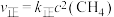 ,
,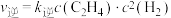 ,
, 、
、 为速率常数,只与温度有关,T温度时
为速率常数,只与温度有关,T温度时
 的代数式表示);当温度升高时,
的代数式表示);当温度升高时, 增大m倍,
增大m倍, 增大n倍,则m
增大n倍,则m
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐3】请按下列要求填空:
(1)已知:99 ℃时,水的离子积常数Kw=1.0×10-12,该温度下测得0.1 mol·L-1 Na2A溶液的pH=6。
①H2A在水溶液中的电离方程式为_________________________ 。
②体积相等、pH=1的盐酸与H2A溶液分别与足量Zn反应,产生的氢气___ (填编号)。
A.盐酸多 B.H2A多 C.一样多 D.无法确定
③将0.1 mol·L-1 H2A溶液与0.2 mol·L-1氨水等体积混合,完全反应后溶液中各离子浓度从大到小的顺序为__________________________________ 。
(2)已知:25 ℃时,电离平衡常数:
请回答下列问题:
①物质的量浓度为0.1 mol/L的下列四种物质:
a.Na2CO3 b.NaClO c.CH3COONa d.NaHCO3
pH由大到小的顺序是________________________________ (填编号)。
②常温下0.1 mol/L的CH3COOH溶液加水稀释过程中,下列表达式的数据一定变大的是______ (填编号)。
A.c(H+) B. C.c(H+)·c(OH-) D.
C.c(H+)·c(OH-) D.
③写出向次氯酸钠溶液中通入少量二氧化碳的离子方程式:________ 。
④25 ℃时,CH3COOH与CH3COONa的混合溶液,若测得混合液pH=6,则溶液中c(CH3COO-)-c(Na+)=_______ (填准确数值)。
⑤25 ℃时,将a mol/L的醋酸与b mol/L氢氧化钠等体积混合,反应后溶液恰好显中性,用a、b表示醋酸的电离平衡常数为_______________ 。
(1)已知:99 ℃时,水的离子积常数Kw=1.0×10-12,该温度下测得0.1 mol·L-1 Na2A溶液的pH=6。
①H2A在水溶液中的电离方程式为
②体积相等、pH=1的盐酸与H2A溶液分别与足量Zn反应,产生的氢气
A.盐酸多 B.H2A多 C.一样多 D.无法确定
③将0.1 mol·L-1 H2A溶液与0.2 mol·L-1氨水等体积混合,完全反应后溶液中各离子浓度从大到小的顺序为
(2)已知:25 ℃时,电离平衡常数:
| 化学式 | CH3COOH | H2CO3 | HClO |
| 电离平 衡常数 | K=1.8×10-5 | K1=4.3×10-7 K2=5.6×10-11 | K=3.2×10-8 |
请回答下列问题:
①物质的量浓度为0.1 mol/L的下列四种物质:
a.Na2CO3 b.NaClO c.CH3COONa d.NaHCO3
pH由大到小的顺序是
②常温下0.1 mol/L的CH3COOH溶液加水稀释过程中,下列表达式的数据一定变大的是
A.c(H+) B.
 C.c(H+)·c(OH-) D.
C.c(H+)·c(OH-) D.
③写出向次氯酸钠溶液中通入少量二氧化碳的离子方程式:
④25 ℃时,CH3COOH与CH3COONa的混合溶液,若测得混合液pH=6,则溶液中c(CH3COO-)-c(Na+)=
⑤25 ℃时,将a mol/L的醋酸与b mol/L氢氧化钠等体积混合,反应后溶液恰好显中性,用a、b表示醋酸的电离平衡常数为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐1】消除氮氧化物、二氧化硫等物质造成的污染是目前化学研究的重要课题。
(1)燃煤烟气脱硫常用如下方法:
用生物质热解气(主要成分CO、CH4、H2)将SO2在高温下还原成单质硫。涉及的部分反应如下:
2CO(g)+SO2(g)=S(g)+2CO2(g) △H1=8.0kJ·mol-1
2CO(g)+O2(g)=2CO2(g) △H2=-566.0kJ·mol-1
2H2(g)+O2(g)=2H2O(g) △H3=-483.6kJ·mol-1
则H2(g)还原SO2(g)生成S(g)和H2O(g)的热化学方程式为___________
(2)工业上常用活性炭还原一氧化氮,其反应为:2NO(g)+C(s) N2(g)+CO2(g)。向容积均为lL的甲、乙、丙三个恒容恒温容器中分别加入足量的活性炭和一定量的NO,测得各容器中n(NO)随反应时间t的变化情况如下表所示:
N2(g)+CO2(g)。向容积均为lL的甲、乙、丙三个恒容恒温容器中分别加入足量的活性炭和一定量的NO,测得各容器中n(NO)随反应时间t的变化情况如下表所示:
①甲容器反应温度T℃___________ 400℃(填“>”或“<”或“=”);
②乙容器中,0~40min内平均反应速率v(N2)=___________ ;
③丙容器中达平衡后NO的转化率为___________ 。
(3)活性炭还原NO2的反应为:2NO2(g)+2C(s) N2(g)+2CO2(g),在恒温条件下,lmolNO2和足量活性炭发生该反应,测得平衡时NO2和CO2的物质的量浓度与平衡总压的关系如图所示:
N2(g)+2CO2(g),在恒温条件下,lmolNO2和足量活性炭发生该反应,测得平衡时NO2和CO2的物质的量浓度与平衡总压的关系如图所示:
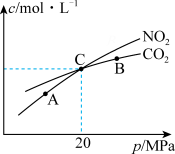
①A、B、C三点中NO2的转化率最高的是___________ 点(填“A”或“B”或“C”)。
②计算C点时该反应的压强平衡常数KP=___________ MPa(Kp是用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(1)燃煤烟气脱硫常用如下方法:
用生物质热解气(主要成分CO、CH4、H2)将SO2在高温下还原成单质硫。涉及的部分反应如下:
2CO(g)+SO2(g)=S(g)+2CO2(g) △H1=8.0kJ·mol-1
2CO(g)+O2(g)=2CO2(g) △H2=-566.0kJ·mol-1
2H2(g)+O2(g)=2H2O(g) △H3=-483.6kJ·mol-1
则H2(g)还原SO2(g)生成S(g)和H2O(g)的热化学方程式为
(2)工业上常用活性炭还原一氧化氮,其反应为:2NO(g)+C(s)
 N2(g)+CO2(g)。向容积均为lL的甲、乙、丙三个恒容恒温容器中分别加入足量的活性炭和一定量的NO,测得各容器中n(NO)随反应时间t的变化情况如下表所示:
N2(g)+CO2(g)。向容积均为lL的甲、乙、丙三个恒容恒温容器中分别加入足量的活性炭和一定量的NO,测得各容器中n(NO)随反应时间t的变化情况如下表所示: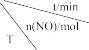 | 0 | 40 | 80 | 120 | 160 | |
| 甲 | T℃ | 2 | 1.45 | 1 | 1 | 1 |
| 乙 | 400℃ | 2 | 1.5 | 1.1 | 0.8 | 0.8 |
| 丙 | 400℃ | 1 | 0.8 | 0.65 | 0.53 | 0.45 |
①甲容器反应温度T℃
②乙容器中,0~40min内平均反应速率v(N2)=
③丙容器中达平衡后NO的转化率为
(3)活性炭还原NO2的反应为:2NO2(g)+2C(s)
 N2(g)+2CO2(g),在恒温条件下,lmolNO2和足量活性炭发生该反应,测得平衡时NO2和CO2的物质的量浓度与平衡总压的关系如图所示:
N2(g)+2CO2(g),在恒温条件下,lmolNO2和足量活性炭发生该反应,测得平衡时NO2和CO2的物质的量浓度与平衡总压的关系如图所示:
①A、B、C三点中NO2的转化率最高的是
②计算C点时该反应的压强平衡常数KP=
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
名校
【推荐2】I.如图列出了①~⑧八种元素在周期表中的位置:
请回答下列问题:
(1)②和③能形成一种淡黄色的固体,请写出该物质的电子式:______ 。
(2)写出实验室制取①的最简单氢化物的化学方程式______ 。
(3)比较⑥和⑦最高价氧化物对应水化物酸性的强弱:______ (用化学式表示)。
(4)⑤的最高价氧化物对应的水化物与⑧的最高价氧化物对应的水化物反应的化学方程式是______ 。
(5)下列可以比较③、④两元素金属性强弱的实验是______(填字母)。
Ⅱ. 催化重整反应为
催化重整反应为 。已知上述反应中相关的化学键键能数据如下:
。已知上述反应中相关的化学键键能数据如下:
(6)则该反应的
______ 。
(7)已知:
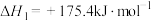

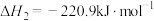
 加碳氯化生成
加碳氯化生成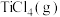 和
和 的热化学方程式:
的热化学方程式:______ 。
| 族 周期 | IA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ||||||
| 3 | ③ | ④ | ⑤ | ⑥ | ⑦ | |||
| 4 | ⑧ |
(1)②和③能形成一种淡黄色的固体,请写出该物质的电子式:
(2)写出实验室制取①的最简单氢化物的化学方程式
(3)比较⑥和⑦最高价氧化物对应水化物酸性的强弱:
(4)⑤的最高价氧化物对应的水化物与⑧的最高价氧化物对应的水化物反应的化学方程式是
(5)下列可以比较③、④两元素金属性强弱的实验是______(填字母)。
| A.比较这两种元素最高价氧化物对应的水化物的碱性 |
| B.将③的单质投入到④的盐溶液中 |
| C.将形状、大小相同的这两种元素的单质分别与等体积20℃的水反应 |
| D.比较这两种元素的单质与酸反应时失电子的数目 |
Ⅱ.
 催化重整反应为
催化重整反应为 。已知上述反应中相关的化学键键能数据如下:
。已知上述反应中相关的化学键键能数据如下:| 化学键 |  |  |  | 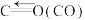 |
键能 | 413 | 745 | 436 | 1075 |
(6)则该反应的

(7)已知:

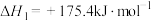

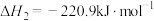
 加碳氯化生成
加碳氯化生成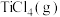 和
和 的热化学方程式:
的热化学方程式:
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐3】北京时间2021年6月17日9时22分,搭载神舟十二号载人飞船的长征二号F遥十二运载火箭,在酒泉卫星发射中心点火发射。
(1)火箭的第一、二级发动机中,所用的燃料为偏二甲肼和四氧化二氮,偏二甲肼可用肼来制备。
①用肼(N2H4)作燃料,四氧化二氮作氧化剂,两者反应生成氮气和气态水。
已知∶N2(g)+2O2(g)=N2O4(g) △H=+10.7kJ·mol-1
N2H4(g)+O2(g)=N2(g)+2H2O(g) △H=-543kJ·mol-1
写出气态肼的电子式____ 。气态肼和气态N2O4反应的热化学方程式∶___ 。
②肼——空气燃料电池是一种碱性燃料电池,电解质溶液是20%—30%的KOH溶液。该电池放电时,通入肼的电极反应式是:_____ ,电池工作一段时间后,电解质溶液的pH将_____ (填“增大”、“减小”、“不变”)。
(2)H2S与CO2在高温下发生反应:H2S(g)+CO2(g) COS(g)+H2O(g) ΔH>0。在610K时,将0.1molH2S与0.3molCO2充入2.5L的空钢瓶中,经过10min,反应达到平衡,反应平衡时水蒸气的物质的量分数为0.125。
COS(g)+H2O(g) ΔH>0。在610K时,将0.1molH2S与0.3molCO2充入2.5L的空钢瓶中,经过10min,反应达到平衡,反应平衡时水蒸气的物质的量分数为0.125。
①H2S的平衡转化率α1=_____ %,反应平衡常数K=_____ 。
②在610K时,经过10min反应达到平衡状态时生成H2O的平均化学反应速率=_____ 。
③在650K重复实验,此反应的平衡常数K=0.25,经过8min时,测得水蒸气的物质的量为0.04mol,该反应是否达到平衡_____ (填“平衡”、“未达到平衡”或“无法确定”)。
④一定温度下,在体积一定的密闭容器中进行H2S(g)+CO2(g) COS(g)+H2O(g)反应,能判断该反应是否达到化学平衡状态的依据是
COS(g)+H2O(g)反应,能判断该反应是否达到化学平衡状态的依据是_____ 。
A.容器中压强不变 B.容器中CO2的体积分数不变
C.v正(H2O)=v逆(H2O) D.容器中混合气体的密度不变
⑤要增大该反应的反应平衡常数K值,可采取的措施有_____ 。
A.增大H2S的起始浓度 B.增大反应体系压强
C.使用高效催化剂 D.升高温度
(1)火箭的第一、二级发动机中,所用的燃料为偏二甲肼和四氧化二氮,偏二甲肼可用肼来制备。
①用肼(N2H4)作燃料,四氧化二氮作氧化剂,两者反应生成氮气和气态水。
已知∶N2(g)+2O2(g)=N2O4(g) △H=+10.7kJ·mol-1
N2H4(g)+O2(g)=N2(g)+2H2O(g) △H=-543kJ·mol-1
写出气态肼的电子式
②肼——空气燃料电池是一种碱性燃料电池,电解质溶液是20%—30%的KOH溶液。该电池放电时,通入肼的电极反应式是:
(2)H2S与CO2在高温下发生反应:H2S(g)+CO2(g)
 COS(g)+H2O(g) ΔH>0。在610K时,将0.1molH2S与0.3molCO2充入2.5L的空钢瓶中,经过10min,反应达到平衡,反应平衡时水蒸气的物质的量分数为0.125。
COS(g)+H2O(g) ΔH>0。在610K时,将0.1molH2S与0.3molCO2充入2.5L的空钢瓶中,经过10min,反应达到平衡,反应平衡时水蒸气的物质的量分数为0.125。①H2S的平衡转化率α1=
②在610K时,经过10min反应达到平衡状态时生成H2O的平均化学反应速率=
③在650K重复实验,此反应的平衡常数K=0.25,经过8min时,测得水蒸气的物质的量为0.04mol,该反应是否达到平衡
④一定温度下,在体积一定的密闭容器中进行H2S(g)+CO2(g)
 COS(g)+H2O(g)反应,能判断该反应是否达到化学平衡状态的依据是
COS(g)+H2O(g)反应,能判断该反应是否达到化学平衡状态的依据是A.容器中压强不变 B.容器中CO2的体积分数不变
C.v正(H2O)=v逆(H2O) D.容器中混合气体的密度不变
⑤要增大该反应的反应平衡常数K值,可采取的措施有
A.增大H2S的起始浓度 B.增大反应体系压强
C.使用高效催化剂 D.升高温度
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐1】(一)氨是一种重要的化工产品,是氮肥工业、有机合成工业以及制造硝酸、铵盐和纯碱的原料,也是一种常用的制冷剂。
(1)某化学研究性学习小组模拟工业合成氨的反应。在容积固定为2L 的密闭容器内充入1mol N2和3mol H2,加入合适催化剂(体积可以忽略不计)后在一定温度压强下开始反应,并用压力计监测容器内压强的变化如下:
则从反应开始到25 min 时,以N2表示的平均反应速率=__________ 。
(2)工业合成氨的反应方程式为: N2(g)+3H2(g) 2NH3(g) ΔH 下图Ⅰ是合成氨反应的能量与反应过程相关图(未使用催化剂);图Ⅱ是合成氨反应在2L 容器中、相同投料情况下、其它条件都不变时,某一反应条件的改变对反应的影响图。
2NH3(g) ΔH 下图Ⅰ是合成氨反应的能量与反应过程相关图(未使用催化剂);图Ⅱ是合成氨反应在2L 容器中、相同投料情况下、其它条件都不变时,某一反应条件的改变对反应的影响图。

下列说法正确的是________________ 。
A.ΔH=-92.4kJ/mol
B.使用催化剂会使E1的数值增大
C.为了提高转化率,工业生产中反应的浓度越低越好
D.图Ⅱ是不同温度下反应体系中氨的物质的量与反应时间关系图,且TA>TB;
E.在曲线A条件下,反应从开始到平衡,消耗N2的平均速率为 mol·L-1·min-1
mol·L-1·min-1
(3)一定温度下,向一个容积为2 L的密闭容器中通入2 mol N2和7 mol H2,达到平衡时测得容器的压强为起始时的7/9倍,在同一温度,同一容器中,将起始物质改为amol N2,b molH2,c mol NH3 (a,b,c均不为零)欲使平衡混合物中各物质的质量与原平衡相同,则a,b,c满足的关系为_____________ (用含a,b,c的表达式表示),且欲使反应在起始时向逆反应方向进行,c的取值范围是_______
(二) 在容积为1.00L的容器中,通入一定量的N2O4,发生反应N2O4(g) 2NO2(g),随温度升高,混合气体的颜色变深。回答下列问题:
2NO2(g),随温度升高,混合气体的颜色变深。回答下列问题:

(1)反应的△H______ 0(填“大于”“小于”);100℃时,体系中各物质浓度随时间变化如图所示。在0~60s时段,反应速率v(N2O4)为________ mol·L-1·s-1
(2)100℃时达到平衡后,改变反应温度为T,c(N2O4)以0.0020mol·L-1·s-1的平均速率降低,经10s又达到平衡。T_______ 100℃(填“大于”“小于”),判断理由是________ 。
(3)温度T时反应达平衡后,将反应容器的容积减少一半,平衡向_______ (填“正反应”或“逆反应”)方向移动,判断理由是__________________ 。
(4)已知:
甲醇脱水反应2CH3OH(g)=CH3OCH3(g)+H2O(g) △H1=-23.9kJ·mol-1
甲醇制烯烃反应2CH3OH(g)=C2H4 (g)+H2O(g) △H2=-29.1kJ·mol-1
乙醇异构化反应2CH3OH(g)=CH3OCH3(g)) △H3=+50.7kJ·mol-1
则乙烯气相直接水合反应C2H4 (g)+H2O(g)=C2H5OH(g)的△H=____________ kJ·mol-1。
(1)某化学研究性学习小组模拟工业合成氨的反应。在容积固定为2L 的密闭容器内充入1mol N2和3mol H2,加入合适催化剂(体积可以忽略不计)后在一定温度压强下开始反应,并用压力计监测容器内压强的变化如下:
| 反应时间 /min | 0 | 5 | 10 | 15 | 20 | 25 | 30 |
| 压强/MPa | 16.80 | 14.78 | 13.86 | 13.27 | 12.85 | 12.60 | 12.60 |
(2)工业合成氨的反应方程式为: N2(g)+3H2(g)
 2NH3(g) ΔH 下图Ⅰ是合成氨反应的能量与反应过程相关图(未使用催化剂);图Ⅱ是合成氨反应在2L 容器中、相同投料情况下、其它条件都不变时,某一反应条件的改变对反应的影响图。
2NH3(g) ΔH 下图Ⅰ是合成氨反应的能量与反应过程相关图(未使用催化剂);图Ⅱ是合成氨反应在2L 容器中、相同投料情况下、其它条件都不变时,某一反应条件的改变对反应的影响图。
下列说法正确的是
A.ΔH=-92.4kJ/mol
B.使用催化剂会使E1的数值增大
C.为了提高转化率,工业生产中反应的浓度越低越好
D.图Ⅱ是不同温度下反应体系中氨的物质的量与反应时间关系图,且TA>TB;
E.在曲线A条件下,反应从开始到平衡,消耗N2的平均速率为
 mol·L-1·min-1
mol·L-1·min-1(3)一定温度下,向一个容积为2 L的密闭容器中通入2 mol N2和7 mol H2,达到平衡时测得容器的压强为起始时的7/9倍,在同一温度,同一容器中,将起始物质改为amol N2,b molH2,c mol NH3 (a,b,c均不为零)欲使平衡混合物中各物质的质量与原平衡相同,则a,b,c满足的关系为
(二) 在容积为1.00L的容器中,通入一定量的N2O4,发生反应N2O4(g)
 2NO2(g),随温度升高,混合气体的颜色变深。回答下列问题:
2NO2(g),随温度升高,混合气体的颜色变深。回答下列问题:
(1)反应的△H
(2)100℃时达到平衡后,改变反应温度为T,c(N2O4)以0.0020mol·L-1·s-1的平均速率降低,经10s又达到平衡。T
(3)温度T时反应达平衡后,将反应容器的容积减少一半,平衡向
(4)已知:
甲醇脱水反应2CH3OH(g)=CH3OCH3(g)+H2O(g) △H1=-23.9kJ·mol-1
甲醇制烯烃反应2CH3OH(g)=C2H4 (g)+H2O(g) △H2=-29.1kJ·mol-1
乙醇异构化反应2CH3OH(g)=CH3OCH3(g)) △H3=+50.7kJ·mol-1
则乙烯气相直接水合反应C2H4 (g)+H2O(g)=C2H5OH(g)的△H=
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐2】氮是生产硝酸、尿素等物质的重要原料。
(1)氨催化氧化法是工业制硝酸的主要方法。已知:
2NO(g)+3H2(g) 2NH3(g)+02(g) △H1=-272.9kJ/mol
2NH3(g)+02(g) △H1=-272.9kJ/mol
2H2(g)+02(g) 2H2O(g) △H2=-483.6kJ/mol
2H2O(g) △H2=-483.6kJ/mol
则4NH3(g)+5O2(g) 4NO(g)+6H2O(g) △H3=
4NO(g)+6H2O(g) △H3=__________
(2)恒容密闭容器中进行合成知反应:N2(g)+3H2(g) 2NH3(g) △H4==-92.4kJ/mol,其化学平衡常数(K)与温度的关系如下表:
2NH3(g) △H4==-92.4kJ/mol,其化学平衡常数(K)与温度的关系如下表:
K1____ K2(填“>”或“<”),其判断理由是_____________ 。
(3)向氨合成塔中充入10molN2和40molH2合成氨,一定温度(T)下平衡混合物中氨气的体积分数与压强(p)的关系如图1所示。
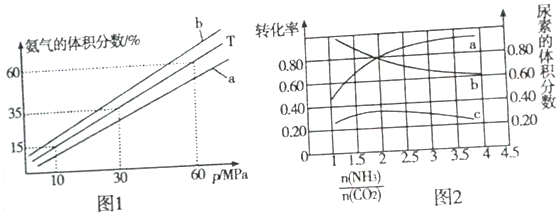
①下列说法正确的是______ (填字母)。
A.由图1可知增大体系压强(p)有利于增大氨气在混合气体中的体积分数
B.若图1中T=500℃,则温度为450℃时对应的曲线是b
C.工业上采用500℃温度的主要目的是提高氮气的转化率
D.当3v正(H2)=2v逆(NH3)时,反应达到平衡状态
②当温度为T、氨气的体积分数为25%时,N2的转化率为__________ 。
(4)工业上用NH3生产硝酸时,将NH3和O2按体积比1:2混合通入某特定条件的密闭容器中进行反应,所有物质不与外界交换,最后得到溶液中溶质的质量分数为_______ 。
(5)氮碳比[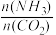 ]对合成尿素的反应:2NH3(g)+CO2(g)
]对合成尿素的反应:2NH3(g)+CO2(g) CO(NH2)2(g)+H2O(g)有影响。T℃时,在2L的恒容密闭容器中,将物质的量之和为3mol的NH3和CO2以不同的氨碳比进行反应,结果如图2所示,a、b分别表示CO2成NH3的转化率,c表示平衡体系中尿素的体积分数,当
CO(NH2)2(g)+H2O(g)有影响。T℃时,在2L的恒容密闭容器中,将物质的量之和为3mol的NH3和CO2以不同的氨碳比进行反应,结果如图2所示,a、b分别表示CO2成NH3的转化率,c表示平衡体系中尿素的体积分数,当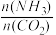 =
=_______ 时,尿素的产量最大,该条件下反应的平衡常数K=________ 。
(1)氨催化氧化法是工业制硝酸的主要方法。已知:
2NO(g)+3H2(g)
 2NH3(g)+02(g) △H1=-272.9kJ/mol
2NH3(g)+02(g) △H1=-272.9kJ/mol 2H2(g)+02(g)
 2H2O(g) △H2=-483.6kJ/mol
2H2O(g) △H2=-483.6kJ/mol则4NH3(g)+5O2(g)
 4NO(g)+6H2O(g) △H3=
4NO(g)+6H2O(g) △H3=(2)恒容密闭容器中进行合成知反应:N2(g)+3H2(g)
 2NH3(g) △H4==-92.4kJ/mol,其化学平衡常数(K)与温度的关系如下表:
2NH3(g) △H4==-92.4kJ/mol,其化学平衡常数(K)与温度的关系如下表:| 温度/K | 298 | 398 | 498 | … |
| 平衡常数(K) | 4.1×106 | K1 | K2 | … |
K1
(3)向氨合成塔中充入10molN2和40molH2合成氨,一定温度(T)下平衡混合物中氨气的体积分数与压强(p)的关系如图1所示。

①下列说法正确的是
A.由图1可知增大体系压强(p)有利于增大氨气在混合气体中的体积分数
B.若图1中T=500℃,则温度为450℃时对应的曲线是b
C.工业上采用500℃温度的主要目的是提高氮气的转化率
D.当3v正(H2)=2v逆(NH3)时,反应达到平衡状态
②当温度为T、氨气的体积分数为25%时,N2的转化率为
(4)工业上用NH3生产硝酸时,将NH3和O2按体积比1:2混合通入某特定条件的密闭容器中进行反应,所有物质不与外界交换,最后得到溶液中溶质的质量分数为
(5)氮碳比[
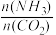 ]对合成尿素的反应:2NH3(g)+CO2(g)
]对合成尿素的反应:2NH3(g)+CO2(g) CO(NH2)2(g)+H2O(g)有影响。T℃时,在2L的恒容密闭容器中,将物质的量之和为3mol的NH3和CO2以不同的氨碳比进行反应,结果如图2所示,a、b分别表示CO2成NH3的转化率,c表示平衡体系中尿素的体积分数,当
CO(NH2)2(g)+H2O(g)有影响。T℃时,在2L的恒容密闭容器中,将物质的量之和为3mol的NH3和CO2以不同的氨碳比进行反应,结果如图2所示,a、b分别表示CO2成NH3的转化率,c表示平衡体系中尿素的体积分数,当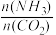 =
=
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐3】合成氨反应为: 。一定温度下,向恒容密闭容器中充入一定量的
。一定温度下,向恒容密闭容器中充入一定量的 和
和 。测得各物质的浓度随时间变化如下表所示。
。测得各物质的浓度随时间变化如下表所示。
(1) 时,
时,
_________  。
。
(2) 内,以
内,以 的浓度变化表示反应的平均速率:
的浓度变化表示反应的平均速率: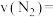
_________ 。
(3)下列能说明该反应达到平衡状态的是_________(填标号)。
(4)合成氨反应中,随温度升高氨的产率下降。生产中选定的温度为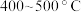 ,温度不宜过高的原因有
,温度不宜过高的原因有_________ 、_________ 。
(5)合成氨反应可能的微观历程如图所示:
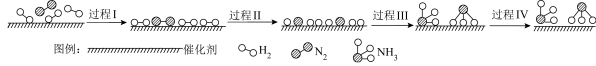
吸附在催化剂表面的物质用*标注。已知过程Ⅲ可以表示为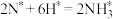 ,则过程Ⅱ可以表示为
,则过程Ⅱ可以表示为_________ 。
(6)氮的固定对农业生产具有重要意义,N2与O2在一定条件下可转为NO,1mol N2 转化为NO过程中能量大小为_________ 。已知:断开1molN≡N、O=O、N≡O(NO中的氮氧键)时分别需要吸收945kJ、498kJ、630kJ的能量。
 。一定温度下,向恒容密闭容器中充入一定量的
。一定温度下,向恒容密闭容器中充入一定量的 和
和 。测得各物质的浓度随时间变化如下表所示。
。测得各物质的浓度随时间变化如下表所示。| 浓度/(mol/L) 时间/(h) | c(N2) | c(H2) | c(NH3) |
| 0 | 1.0 | 3.0 | 0 |
| t1 | 0.8 | ||
| t2 | 2.1 |
 时,
时,
 。
。(2)
 内,以
内,以 的浓度变化表示反应的平均速率:
的浓度变化表示反应的平均速率: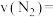
(3)下列能说明该反应达到平衡状态的是_________(填标号)。
A.消耗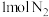 的同时消耗 的同时消耗 | B.容器中的压强不随时间变化 |
| C.混合气体的密度不随时间变化 | D. |
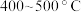 ,温度不宜过高的原因有
,温度不宜过高的原因有(5)合成氨反应可能的微观历程如图所示:

吸附在催化剂表面的物质用*标注。已知过程Ⅲ可以表示为
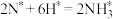 ,则过程Ⅱ可以表示为
,则过程Ⅱ可以表示为(6)氮的固定对农业生产具有重要意义,N2与O2在一定条件下可转为NO,1mol N2 转化为NO过程中能量大小为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐1】请回答下列问题:
(1)已知:N2、O2分子中化学键的键能分别是946 kJ·mol-1、497 kJ·mol-1 N2(g)+O2(g)=2NO(g) ∆H=+180.0 kJ·mol-1.则相同条件下破坏1mol NO的化学键需要吸收的能量为___________ kJ。
(2)25℃时,pH=5的CH3COOH溶液中,由水电离出的c(H+)=___________ mol/L;往溶液中加入少量NaOH固体(不考虑温度变化),则溶液中
___________ (填“增大”、“减小”或“不变”)。
(3)常温下,0.1 mol/L的CH3COOH溶液加水稀释过程,下列表达式的数据一定增大的是___________ 。
A.c(H+) B. C.c(H+)·c(OH-) D.
C.c(H+)·c(OH-) D.
(4)常温下0.1 mol/L醋酸溶液的pH=a,下列能使溶液pH=(a+1)的措施是___________ 。
A.将溶液稀释到原体积的2倍
B.加入适量的醋酸钠固体
C.加入等体积0.2 mol·L-1盐酸
D.加少量冰醋酸
(1)已知:N2、O2分子中化学键的键能分别是946 kJ·mol-1、497 kJ·mol-1 N2(g)+O2(g)=2NO(g) ∆H=+180.0 kJ·mol-1.则相同条件下破坏1mol NO的化学键需要吸收的能量为
(2)25℃时,pH=5的CH3COOH溶液中,由水电离出的c(H+)=

(3)常温下,0.1 mol/L的CH3COOH溶液加水稀释过程,下列表达式的数据一定增大的是
A.c(H+) B.
 C.c(H+)·c(OH-) D.
C.c(H+)·c(OH-) D.
(4)常温下0.1 mol/L醋酸溶液的pH=a,下列能使溶液pH=(a+1)的措施是
A.将溶液稀释到原体积的2倍
B.加入适量的醋酸钠固体
C.加入等体积0.2 mol·L-1盐酸
D.加少量冰醋酸
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐2】连二次硝酸(H2N2O2)是一种二元酸,可用于制N2O气体。
(1)连二次硝酸中氮元素的化合价为____________ 。
(2)常温下,用0.01mol·L-1的NaOH溶液滴定10mL0.01mol·L-1的H2N2O2溶液,测得溶液pH与NaOH溶液体积的关系如图所示。

①写出H2N2O2在水溶液中的电离方程式:______________ 。
②常温下H2N2O2的Ka1约为______________
③b点时溶液中c(H2N2O2)_____ (填“>”、“<”或“=”,下同)c(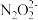 )。
)。
④a点时溶液中c(Na+)________ c(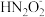 )+c(
)+c(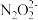 )。
)。
⑤a、b、c三点,水的电离程度最大的是__________ 。
(3)硝酸银溶液和连二次硝酸钠溶液混合,可以得到黄色的连二次硝酸银沉淀,向该分散系中滴加硫酸钠溶液,当白色沉淀和黄色沉淀共存时,分散系中 =
=______ 。[已知Ksp(Ag2N2O2)=4.2×10-9,Ksp(Ag2SO4)=1.4×10-5]
(1)连二次硝酸中氮元素的化合价为
(2)常温下,用0.01mol·L-1的NaOH溶液滴定10mL0.01mol·L-1的H2N2O2溶液,测得溶液pH与NaOH溶液体积的关系如图所示。

①写出H2N2O2在水溶液中的电离方程式:
②常温下H2N2O2的Ka1约为
③b点时溶液中c(H2N2O2)
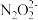 )。
)。④a点时溶液中c(Na+)
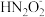 )+c(
)+c(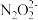 )。
)。⑤a、b、c三点,水的电离程度最大的是
(3)硝酸银溶液和连二次硝酸钠溶液混合,可以得到黄色的连二次硝酸银沉淀,向该分散系中滴加硫酸钠溶液,当白色沉淀和黄色沉淀共存时,分散系中
 =
=
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐3】碲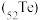 被誉为“国防与尖端技术的维生素”。工业上常用铜阳极泥(主要成分是
被誉为“国防与尖端技术的维生素”。工业上常用铜阳极泥(主要成分是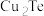 、含Ag、Au等杂质)为原料提取碲并回收金属,其工艺流程如下:
、含Ag、Au等杂质)为原料提取碲并回收金属,其工艺流程如下:
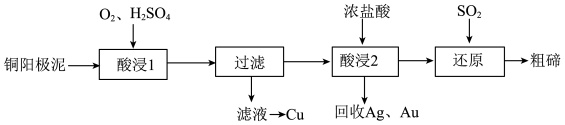
已知: 微溶于水,易与较浓的强酸、强碱反应。回答下列问题:
微溶于水,易与较浓的强酸、强碱反应。回答下列问题:
(1)已知Te为ⅥA族元素, 被浓NaOH溶液溶解,所生成盐的化学式为
被浓NaOH溶液溶解,所生成盐的化学式为________ 。
(2)“酸浸1”过程中,为加快浸出速率,可采取的方法有________ (填1种)。“酸浸2”时温度过高会使Te的浸出率降低,原因是________ 。
(3)“酸浸1”过程中,控制溶液的酸度使 转化为
转化为 ,反应的化学方程式为
,反应的化学方程式为________ ;“还原”过程中,发生反应的离子方程式为________ 。
(4)工业上也可用电解法从铜阳极泥中提取碲,方法是:将铜阳极泥在空气中焙烧使碲转化为 ,再用NaOH溶液碱浸,以石墨为电极电解所得溶液获得Te。电解过程中阴极上发生反应的电极方程式为
,再用NaOH溶液碱浸,以石墨为电极电解所得溶液获得Te。电解过程中阴极上发生反应的电极方程式为________ 。在阳极区溶液中检验出有 存在,生成
存在,生成 的原因是
的原因是________ 。
(5)常温下,向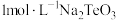 溶液中滴加盐酸,当溶液
溶液中滴加盐酸,当溶液 时,
时, ;
;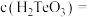
________ 。(已知: 的
的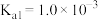
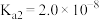 )
)
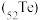 被誉为“国防与尖端技术的维生素”。工业上常用铜阳极泥(主要成分是
被誉为“国防与尖端技术的维生素”。工业上常用铜阳极泥(主要成分是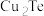 、含Ag、Au等杂质)为原料提取碲并回收金属,其工艺流程如下:
、含Ag、Au等杂质)为原料提取碲并回收金属,其工艺流程如下: 
已知:
 微溶于水,易与较浓的强酸、强碱反应。回答下列问题:
微溶于水,易与较浓的强酸、强碱反应。回答下列问题:(1)已知Te为ⅥA族元素,
 被浓NaOH溶液溶解,所生成盐的化学式为
被浓NaOH溶液溶解,所生成盐的化学式为(2)“酸浸1”过程中,为加快浸出速率,可采取的方法有
(3)“酸浸1”过程中,控制溶液的酸度使
 转化为
转化为 ,反应的化学方程式为
,反应的化学方程式为(4)工业上也可用电解法从铜阳极泥中提取碲,方法是:将铜阳极泥在空气中焙烧使碲转化为
 ,再用NaOH溶液碱浸,以石墨为电极电解所得溶液获得Te。电解过程中阴极上发生反应的电极方程式为
,再用NaOH溶液碱浸,以石墨为电极电解所得溶液获得Te。电解过程中阴极上发生反应的电极方程式为 存在,生成
存在,生成 的原因是
的原因是(5)常温下,向
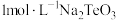 溶液中滴加盐酸,当溶液
溶液中滴加盐酸,当溶液 时,
时, ;
;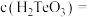
 的
的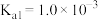
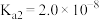 )
)
您最近一年使用:0次



